篇一 :7.电导法测定难溶盐的溶解度(1)
电导法测定难溶盐的溶解度
一、实验目的
1.掌握电导法测定难溶盐溶解度的原理和方法
2.掌握电导率仪的使用方法
二、基本原理
第二类导体导电能力的大小,常以电阻的倒数表示,
即电导: G?1
R (1)
式中G称为电导,单位是西门子S、 导体的电阻与其长度成正比,与其截面积成反比,即: R?ρl
A (2)
ρ 是比例常数,称为电阻率或比电阻。 根据电导与电阻的关系,则有:G?κ??A??
?l? (3)
导体 k称为电导率或比电导κ=1/ρ,它相当于两个电极相距1m
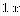
,截面积为
的电导,其单位是。
对于电解质溶液,若浓度不同,则其电导亦不同。如取1mol电解质溶液来量度,即可在给定条件下就不同电解质来进行比较。1mol电解质全部置于相距为1m的两个电极之间,溶液的电导称之为摩尔电导,以Λ表示之。如溶液的浓度以C表示,则摩尔电导可以表示为: Λm?
式中Λm

的单位是;C的单位是κc (4) 。Λm的数值常通过溶液的电导
?l?? A??率k,经(10.4)式计算得到。而k与电导G有下列关系,由(10.3)式可知:κ?G?
…… …… 余下全文
篇二 :电导法测定难溶盐的溶解度
电导法测定难溶盐的溶解度
一、实验目的
1.掌握电导法测定难溶盐溶解度的原理和方法
2.掌握电导率仪的使用方法
二、基本原理
惠斯顿电桥

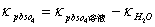 由电导率仪测出
由电导率仪测出
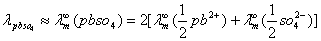 由离子独立移动定律,查表计算
由离子独立移动定律,查表计算
 或
或 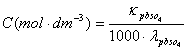
三、装置图
四、操作步骤
1、制备硫酸铅饱和溶液。
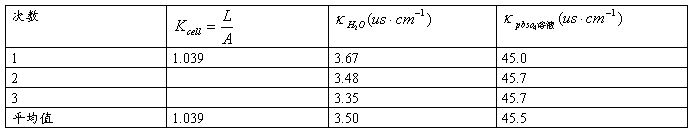
2、用0.02mol/L氯化钾溶液校正电导池常数。
用25℃,0.02mol/lKCL溶液。查附录二十二,其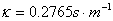 。若实测
。若实测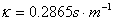 ,则
,则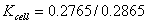 。或把电导电极插入KCL溶液,若显示
。或把电导电极插入KCL溶液,若显示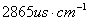 ,只需调“常数”旋钮,使显示为
,只需调“常数”旋钮,使显示为 ,然后把“选择”开关指向“检查”,此时显示值即为
,然后把“选择”开关指向“检查”,此时显示值即为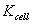
3、测水电导率。
4、测硫酸铅溶液电导率。
五、结果记录与处理
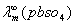 =
=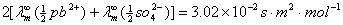 (查附录二十三)
(查附录二十三)
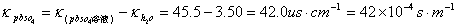
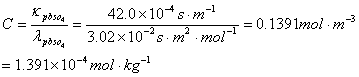
溶解度S=C×M=1.391×10-4×0.303=4.21×10-5 (无单位)
或S=4.21×10-2g/l
…… …… 余下全文
篇三 :电导法测定难溶盐的溶解度
电导法测定难溶盐的溶解度
一、实验目的
1.掌握惠斯顿电桥测定电导的原理及方法
2.掌握电导测定的原理和电导仪的使用方法。
3.学会用电导法测定难溶盐的溶解度
二、基本原理
1、电导法原理
导体导电能力的大小常以电阻的倒数去表示,即有
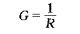
式中G称为电导,单位是西门子S。
导体的电阻与其长度成正比与其截面积成反比即:
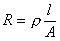
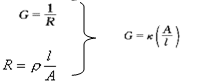 ρ是比例常数,称为电阻率或比电阻。根据电导与电阻的关系则有:
ρ是比例常数,称为电阻率或比电阻。根据电导与电阻的关系则有:
κ称为电导率或比电导,单位:S·m-1
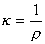
对于电解质溶液,浓度不同则其电导亦不同。如取1mol电解质溶液来量度,即可在给定条件下就不同电解质溶液来进行比较。lmol电解质溶液全部置于相距为1m的两个平行电极之间溶液的电导称之为摩尔电导,以λ表示之。如溶液的摩尔浓度以c表示。则摩尔电导可表示为
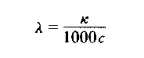
式中λ的单位是S.m2.mol-1,c的单位是mol.L-1。λ的数值常通过溶液的电导率k式计算得到。
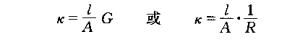
对于确定的电导池来说l/A是常数,称为电导池常数。电导池常数可通过测定已知电导率的电解质溶液的电导(或电阻)来确定。
本实验测定PbSO4的溶解度,首先测定PbSO4饱和溶液的电导率,因溶液极稀,必须从k溶液中减去水的电导率(kH20):
…… …… 余下全文
篇四 :实验电导法测难溶盐的溶度积
实验 电导法测难溶盐的溶度积
一、实验目的
1. 掌握电导测定的原理和电导仪的使用方法。
2. 通过实验验证电解质溶液电导与浓度的关系。
3. 掌握电导法测定BaSO4的溶度积的原理和方法。
二、实验原理
导体导电能力的大小常以电阻的倒数去表示,即有

式中G称为电导,单位是西门子S。
导体的电阻与其长度成正比与其截面积成反比即:

ρ是比例常数,称为电阻率或比电阻。根据电导与电阻的关系则有:
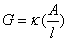
κ称为电导率或比电导

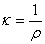
对于电解质溶液,浓度不同则其电导亦不同。如取1mol电解质溶液来量度,即可在给定条件下就不同电解质溶液来进行比较。1mol电解质溶液全部置于相距为1m的两个平行电极之间溶液的电导称之为摩尔电导,以λ表示之。如溶液的摩尔浓度以c表示。则摩尔电导可表示为
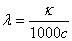
式中λ的单位是S.m2.mol-1,c的单位是mol.L-1。λ的数值常通过溶液的电导率k式计算得到。
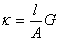 或
或 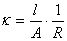
对于确定的电导池来说l/A是常数,称为电导池常数。电导池常数可通过测定已知电导率的电解质溶液的电导(或电阻)来确定。
…… …… 余下全文
篇五 :《物化问题及答案》实验十六 电导法测定氯化银的溶度积和溶解度思考题
实验十六 电导法测定氯化银的溶度积和溶解度思考题
1、电导、电导率和摩尔电导率是如何定义的?三者分别以何符号表示?三者之间有何联系和区别?
2、电导池常数K的物理意义是什么?其数值如何测得?
3、在运用公式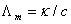 进行有关计算时,
进行有关计算时, 的单位是什么?
的单位是什么?
4、极限摩尔电导率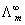 的物理意义和用途分别是什么?
的物理意义和用途分别是什么?
5、对于强、弱电解质,获得其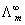 分别有哪几种方法?
分别有哪几种方法?
6、对于强电解质难溶盐,如何理论计算其 ?为什么?
?为什么?
7、难溶盐饱和溶液的电导率就是难溶盐的电导率吗?为什么?
8、简述难溶盐溶解度和溶度积的区别?
9、温度对电解质溶液的电导、电导率和摩尔电导率是否有影响?有何影响?
10、科尔劳施公式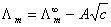 成立的条件是什么?
成立的条件是什么?
11、电导率的测定为何用交流电而不用直流电?
12、简述用DDS-11A型电导率仪测定溶液电导率的步骤?
13、简述用DDS-11A型电导率仪测定AgCl溶解度和溶度积的步骤?
答案:
1、电导G为电阻R的倒数,表示导体的导电能力大小。电导率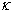 为单位体积导体的电导。摩尔电导率
为单位体积导体的电导。摩尔电导率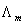 为单位浓度电解质溶液的电导率。三者均反映导体的导电能力,对第二类导体电解质溶液而言,电导对电解质溶液的体积和浓度均没有限制,而电导率和摩尔电导率则分别对电解质溶液有体积限制和浓度限制,分别为单位体积电解质溶液和单位浓度电解质溶液的电导。
为单位浓度电解质溶液的电导率。三者均反映导体的导电能力,对第二类导体电解质溶液而言,电导对电解质溶液的体积和浓度均没有限制,而电导率和摩尔电导率则分别对电解质溶液有体积限制和浓度限制,分别为单位体积电解质溶液和单位浓度电解质溶液的电导。
…… …… 余下全文
篇六 :大学物理化学实验报告-电导法测定水溶性表面活性剂的临界胶束浓度

物理化学实验报告
院系 化学化工学院
班级 化学 061
学号 13
姓名 沈建明
实验名称电导法测定水溶性表面活性剂的临界胶束浓度
日期 2009.5.10 同组者姓名 史黄亮
…… …… 余下全文
篇七 :CO2在水中溶解度的测定 实验报告
CO2在水中溶解度的测定
1.取2000ml蒸馏水,加热至沸腾,加盖放置到室温,备用。
2.制备Ca(OH)2饱和溶液:取11.1gCaCl2和8.0gNaOH,将二者放入500ml大烧杯中,加煮沸的蒸馏水500ml,用玻璃棒搅拌,加盖放置过夜,取上层清液备用。
3.将800ml煮沸过的蒸馏水放入1000ml带塞广口瓶中。如图连接实验装置。锥形瓶A中放入适量煮沸过的蒸馏水,取10.6gNa2CO3和10ml 2%的HCl溶液,将NaCO3放入吸滤瓶中,在吸滤瓶上方放置一只长颈漏斗,迅速将HCl溶液倒入漏斗中,待导管另一端有气流流出时,将橡胶管插入盛有800ml水的广口瓶中,插入水中的导管一端有气泡冒出。待碳酸钠和盐酸反应结束,拆除吸滤瓶,保留锥形瓶A,静置10分钟,把导管移动到水面上方,在A中加入4gNaOH,以吸收广口瓶水面上方未被水吸收的二氧化碳气体,再静置10分钟。拆除锥形瓶A,广口瓶塞上胶塞。
4.取下广口瓶上的胶塞,迅速将150ml氢氧化钙饱和溶液倒入广口瓶中,再迅速盖上胶塞。
5.倒入饱和氢氧化钙溶液后,溶液中有颗粒状沉淀产生。静置,过夜。
6.静置过夜后,广口瓶底有薄薄的白色沉淀,上层为澄清液体。小心地迅速地将上层清液倒出,注意不要干扰到底层沉淀。倒至底层液体约有3-4cm时,停止。
…… …… 余下全文
篇八 :难溶盐溶度积的测定
电导法测定PbSO4的溶度积
张玉 吴玲
一、实验目的
(1)掌握电导法测定难溶盐溶解度的原理和方法;
(2)掌握电导率仪的使用方法;
(3)注意有毒物质的排放。
二、基本原理
难溶电解质在水中会建立一种特殊的动态平衡。尽管难溶电解质无法溶解, 但仍有一部分阴阳离子进入溶液, 当这两个过程的速率相等时, 难溶电解质的溶解就达到平衡状态, 这样的平衡状态叫沉淀溶解平衡, 其平衡常数叫溶度积。在一定温度下, 一种难溶电解质的饱和溶液中形成一种多相离子平衡, 可表示为:
AmBn( s) ? nAm+ ( aq) + mBn- ( aq)
K sp= αn (Am+ ) αm( Bn- )
K sp 称为溶度积常数, 简称溶度积。若能测出难溶电解质的饱和溶液中相应离子浓度, 就可计算出溶度积。难溶盐的饱和溶液浓度很低,可以把浓度当做活度处理,即c≈α,所以:
K sp= cn (Am+ ) cm ( Bn- )
难溶盐PbSO4在其饱和溶液中存在如下溶解平衡:
PbSO4(s)?Pb2+(aq)+ SO42-(aq)
其溶度积为:
K sp= c (Pb2+ ) c (SO42-)=c(PbSO4)
…… …… 余下全文