篇一 :大学化学实验 滴定分析基本操作 酸碱浓度的比较 实验报告
滴定分析基本操作及酸碱浓度的比较 实验报告
实验目的就不写出来了大家肯定都有
一 实验原理
1.酸碱指示剂有其变色范围(pH),甲基橙的变色范围是3.1-4.4,0-3.1为红色,
3.1-4.4为橙色,4.4-14为黄色。酚酞的变色范围是8.2-10.0,0-8.2为无色,8.2-10.0为浅红色,10.0-14为红色
2.盐酸和氢氧化钠的反应方程式为:HCl+NaOH=NaCl+H2O
在中和反应过程中,溶液的pH会发生突变,可以通过溶液的颜色变化判断滴定终点,之后测定出消耗的酸或者碱的体积,就可以利用公式:
VB*cB*νA=VA*cA*νB
求出碱和酸的浓度之比(ν代表化学计量数,对于盐酸和氢氧化钠的反应盐酸和氢氧化钠的化学计量数均为1)
3.滴定分析法是将滴定剂(已知准确浓度的标准溶液)滴加到含有被测组分的溶液中,直到达到滴定终点,然后根据滴定剂的浓度和消耗的体积计算被测组分含量的一种方法
4,。标准溶液的配置方法一般有两种:直接配制法和间接配制法,本实验是用间接配制法,以酚酞或甲基橙为指示剂来确定滴定终点
二 实验步骤
1. 实验试剂
浓度为cNaOH=1mol/LNaOH溶液(要求不含碳酸根离子)
…… …… 余下全文
篇二 :酸碱中和滴定实验报告
酸碱中和滴定实验报告
时间:
组别: 第 组 指导教师: 组长: 组员:
一、实验目的:用已知浓度溶液(标准溶液)【本实验盐酸为标准溶液】测定未知溶液(待测
溶液) 浓度【本实验氢氧化钠为待测溶液】
二、实验原理:c(标)×V(标) = c(待)×V(待)【假设反应计量数之比为1:1】
…… …… 余下全文
篇三 :酸碱中和滴定实验报告[1]
石门二中化学实验报告单
年级:高二 班次 姓名: 同组人: 月 日
实验测定酸碱滴定曲线
一、实验目的:测量未知溶液的浓度 二、实验原理:酸碱中和 三、实验仪器和药品
酸式滴定管、碱式滴定管、锥形瓶、铁架台、滴定管夹、NaOH溶液(标准液)、未知浓度的HCl (待测液)、酚酞(变色范围8~10)

…… …… 余下全文
篇四 :酸碱中和滴定学生实验报告模板
酸碱中和滴定
实验人员:____________ 第____组
实验目的:测定某未知浓度的盐酸的pH值及物质的量浓度
实验原理:HCl + NaOH = NaCl + H2O
实验用品:仪器:点滴板、玻璃棒、烧杯、容量瓶(250mL)、胶头滴管、锥形瓶、量筒托盘天平
药品:未知浓度盐酸、氢氧化钠固体、酚酞试液
测定pH
测量pH值的方法:____________________________________________________
…… …… 余下全文
篇五 :酸碱中和滴定 实验报告
实验名称: 酸碱中和滴定
时间 实验(分组)桌号 合作者 指导老师
一:实验目的:用已知浓度溶液(标准溶液)【本实验盐酸为标准溶液】测定未知溶液(待测
溶液) 浓度【本实验氢氧化钠为待测溶液】
二:实验仪器: 酸式滴定管、碱式滴定管、锥形瓶、铁架台(含滴定管夹)。
…… …… 余下全文
篇六 :酸碱中和滴定实验报告单
实验名称: 酸碱中和滴定
时间 实验(分组)桌号 合作者 指导老师
一:实验目的:用已知浓度溶液(标准溶液)【本实验盐酸为标准溶液】测定未知溶液(待测溶液) 浓度【本实验氢氧化钠为待测溶液】
二:实验仪器: 酸式滴定管、碱式滴定管、锥形瓶、铁架台(含滴定管夹)。
…… …… 余下全文
篇七 :酸碱滴定和AA测定实验报告
酸碱滴定和AA测定实验报告

一、实验目的
答:1.熟练酸碱中和滴定实验有关仪器(锥形瓶、移液管和滴定管等)的基本操作规范。通过中和滴定实验,掌握中和滴定实验操作方法。
2.理解中和滴定实验中指示剂选择和使用。通过中和滴定终点时指示剂的颜色突变等感受量变引起质变的规律。
3.理解中和滴定实验过程要记录的实验数据。通过中和滴定实验,理解化学定量分析实验中有关实验数据的收集和处理、实验结果的计算、实验误差的分析等。通过中和滴定实验数据的处理和计算,培养实事求是的实验态度。
4.掌握中和滴定实验操作过程。难点是实验数据的处理和实验误差的分析。
二、实验原理
答:研究物质组成时,一般有两种目的:一是研究物质的组成成份,在化学上叫做定性分析;另一种是研究物质中各种成份的含量,叫做定量分析。
在定量分析中,用已知物质的量浓度的酸和碱来测定未知浓度的碱和酸的方法叫做酸碱中和滴定。滴定的目的是测定酸或碱的物质的量浓度。
1.酸碱中和滴定原理
根据酸碱中和反应的实质:
H+ + OH- = H2O
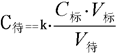
根据上式,已知酸和碱的体积,并知道标准溶液的物质的量浓度,可以计算出另一种物质的浓度。
…… …… 余下全文
篇八 :酸碱中和滴定实验报告
酸碱中和滴定实验报告
班级 姓名 学号 合作者 日期
一、实验目的:用已知浓度溶液(标准溶液)【本实验NaOH为标准溶液】测定未知溶液(待测溶液) 浓度【本实验盐酸为待测溶液】
二、实验用品:
1.所用仪器:酸式滴定管、碱式滴定管、锥形瓶、滴管、烧杯
2.所用试剂:0.1000mol/LNaOH溶液、待测盐酸、酚酞
三、实验原理:c(标)×V(标) = c(待)×V(待)【假设反应计量数之比为1:1】
【本实验具体为:c(H+)×V(酸) = c(OH-)×V(碱)】
…… …… 余下全文