酸碱中和滴定实验报告
酸碱中和滴定实验报告
时间:
组别: 第 组 指导教师: 组长: 组员:
一、实验目的:用已知浓度溶液(标准溶液)【本实验盐酸为标准溶液】测定未知溶液(待测
溶液) 浓度【本实验氢氧化钠为待测溶液】
二、实验原理:c(标)×V(标) = c(待)×V(待)【假设反应计量数之比为1:1】
三、实验仪器和药品
酸式滴定管、碱式滴定管、锥形瓶、铁架台、滴定管夹、0.1000mol/L盐酸(标准液)、未知浓度的NaOH溶液(待测液)、酚酞(变色范围8~10)、甲基橙(3.1~4.4)
四、实验步骤
(一)滴定前的准备阶段
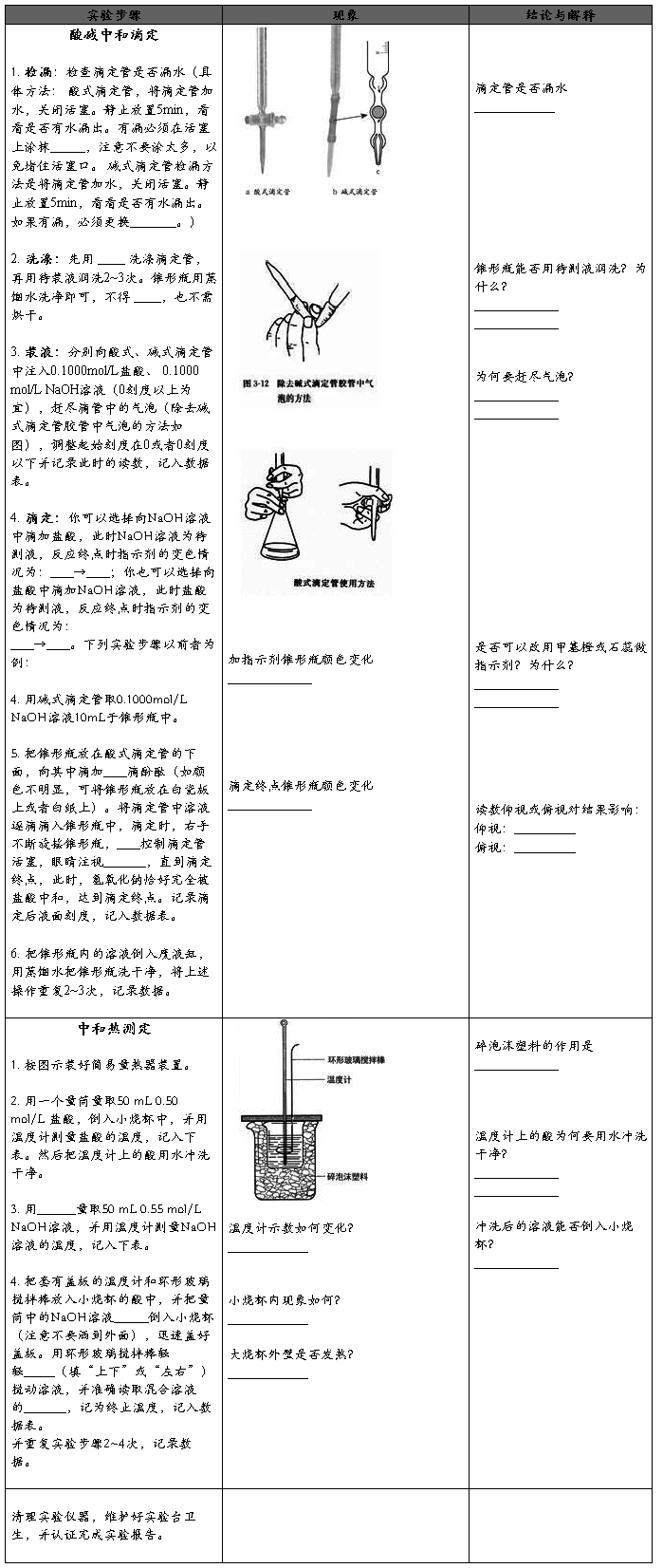
1、检漏:检查滴定管是否漏水
2、洗涤:先用蒸馏水洗涤滴定管,再用待装液润洗2~3次
3、量取:用碱式滴定管量出一定体积的未知浓度的NaOH溶液,注入锥形瓶中,并往
锥形瓶中滴加几滴酚酞,现象为 。用酸式滴定管量取标准液盐酸,使液面恰好在0刻度或0刻度以下某准确刻度,记录读数V1,读至小数点后第二位。

(二)滴定阶段
1、把锥形瓶放在酸式滴定管的下面,将滴定管中溶液逐滴滴入锥形瓶中,滴定时,右手不断旋摇锥形瓶,左手控制滴定管活塞,眼睛注视锥形瓶内溶液颜色的变化,直到滴入一滴盐酸后溶液变为无色且半分钟内不恢复原色。此时,氢氧化钠恰好完全被盐酸中和,达到滴定终点。记录滴定后液面刻度V2。
2、把锥形瓶内的溶液倒入废液缸,用蒸馏水把锥形瓶洗干净,将上述操作重复2~3次。
(三)数据处理
注意:取两次测定数值的平均值,计算待测液的物质的量浓度
(四)误差分析
1、来自滴定管产生的误差:
①滴定管用蒸馏水洗后,未用标准液润洗 ②滴定管未用待测液润洗
③盛标准液的滴定管滴定前有气泡,滴定后无气泡
④盛标准液的滴定管滴定前无气泡,滴定后有气泡
⑤盛待测液的滴定管滴定前有气泡,滴定后无气泡
2、来自锥形瓶中产生的误差
锥形瓶用蒸馏水洗后又用待测液润洗
3、读数带来的误差
如:标准液读数时 ①先俯视后仰视 ②先仰视后俯视
课后巩固:
1、进行中和滴定时,事先不应该用所盛溶液润洗的仪器是( )
A、酸式滴定管 B、碱式滴定管 C、锥形瓶 D、量筒
2、准确量取25.00mL 高锰酸钾溶液,可选用的仪器是( )
A、50mL量筒 B、10mL量筒
C、50mL酸式滴定管 D、50mL 碱式滴定管
3、有一支50mL的酸式滴定管,其中盛有溶液,液面恰好在10.00mL刻度处,把滴定管中的溶液全都流下排出,承接在量筒内,量筒中溶液的体积 ( )
A、大于40.0mL B、为40.0mL C、小于40.0mL D、为10.0mL
4、用0.1mol/L的氢氧化钠溶液测定某浓度的浓硫酸,其实验步骤如下:
1.配制稀硫酸溶液100mL,操作方法是:在___ _里盛适量蒸馏水,用___ _滴定管取1mL浓硫酸,使其缓缓沿烧杯内壁注入盛有适量蒸馏水的___ ____中,并用___ __搅拌,以达___ __的目的。将___ __后的溶液沿____ __注入___ ___中,用蒸馏水洗涤___ _和___ _2~3次,洗液都注入____ __中,振荡摇匀后,将水注入___ __,直至液面接近刻度线___ _处,改用____ __加水至___ ___。盖好瓶塞,振荡摇匀后,转移至贴有标签的试剂瓶中。
2.滴定:用酸式滴定管取10mL稀硫酸,注入___ _中,滴入3至5滴酚酞并摇匀后,用0.1mol/L的氢氧化钠溶液滴定,直到加入最后一滴氢氧化钠,刚好使溶液___ _,即达滴定终点。
3.记录和计算:求:稀释前后硫酸物质的量的浓度。
4.讨论:
①碱式滴定管在盛氢氧化钠溶液前要先用___ _洗净再用__ __润洗,盛待测硫酸溶液的容器是__ __,容器在盛稀硫酸前,要用_ ___洗。
②碱式滴定管未用标准碱溶液洗,只用水洗,立即注入氢氧化钠溶液,将会使测定的稀硫酸浓度___ _(偏高、偏低、不受影响,下同)。
③滴定前,盛稀硫酸的容器水洗后,用稀硫酸润洗,再盛稀硫酸10mL,再用标准氢氧化钠溶液滴定,将会使测定硫酸溶液的浓度结果___ _。
④滴定前碱式滴定管内无气泡,后因操作不当进了气泡,测定结果,使稀硫酸的浓度_。
⑤盛稀硫酸的容器内盛10mL稀硫酸后,再加入10mL水后滴定,则测定结果,硫酸溶液浓度将___ _。
⑥滴定前平视读数,滴定终点时,仰视读数,并记录读数,测得的硫酸溶液浓度将___ _。
第二篇:酸碱中和滴定、中和热测定实验报告
 学生实验 酸碱中和滴定 酸碱中和中和热测定
学生实验 酸碱中和滴定 酸碱中和中和热测定
一、预习思考
◆实验目的
1、练习使用pH计测量溶液的pH;探究酸碱中和反应过程中pH的变化特点;体会定量实验在化学研究中的作用。
2、测定强酸和强碱反应的反应热,体验化学反应的热效应。
◆实验原理
1、在酸碱中和反应中,使用一种 的酸(或碱)溶液跟 的碱(或酸)溶液完全中和,测出二者的 ,再根据化学方程式中酸和碱的物质的量的比值,就可以计算出碱(或酸)溶液的浓度。
计算公式: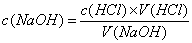 或
或 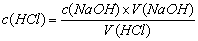 。
。
2、中和反应原理:H+(aq) + OH-(aq)===H2O(l);△H=-57.3kJ/mol
中和热计算方法:(强酸和强碱反应) Q=mCΔt
(1)其中 Q为 ,m为 ,C为反应混合液的比热容, △t为 ;
(2)因为m = V(酸)ρ(酸)+V(碱)ρ(碱),V(酸)=V(碱)=50mL,而酸的浓度是0.50 mol/L ,碱的浓度是0.55mol/L;且ρ(酸)=ρ(碱)=1 g/cm3、C=4.18 J/(g·℃),所以
Q = ; 。
。
◆实验用品
1、0.1mol/L左右的盐酸、0.1mol/L左右的NaOH溶液、酚酞溶液、蒸馏水、pH计、酸式滴定管、碱式滴定管,烧杯、锥形瓶、滴定管夹、铁架台
2、大烧杯(500 mL)、小烧杯(100 mL)、温度计、量筒(50 mL)两个、泡沫塑料或纸条、
泡沫塑料板或硬纸板(中心有两个小孔)、环形玻璃搅拌棒、0.50 mol/L 盐酸、0.55 mol/L NaOH溶液(为了保证盐酸完全被氢氧化钠中和,采用 )。
◆要点提示
1、酸和碱反应的实质是 。
2、酸碱中和滴定选用酚酞作指示剂,但其滴定终点的变色点并不是pH=7,这样对中和滴定终点的判断有没有影响?
3、滴定管和量筒读数时有什么区别?
4、中和热实验所测得的数据若不是57.3 kJ/mol,则产生误差可能的原因有哪些?
二、记录与分析
实验时间: 年 月 日 第 节 同组成员:
三、数据记录与处理
酸碱中和滴定数据表

中和热测定数据表

四、问题讨论
1、误差分析

2、中和热测定实验酸、碱混合时,为何要把量筒中的NaOH溶液一次倒入小烧杯而不能缓缓倒入?
3、酸碱中和滴定的关键是什么?
实验成绩:
-
酸碱中和滴定实验报告
酸碱中和滴定实验报告酸碱中和滴定实验报告时间组别第组指导教师组长组员一实验目的用已知浓度溶液标准溶液本实验盐酸为标准溶液测定未知溶…
-
酸碱中和滴定 实验报告
实验名称酸碱中和滴定时间实验分组桌号合作者指导老师一实验目的用已知浓度溶液标准溶液本实验盐酸为标准溶液测定未知溶液待测溶液浓度本实…
-
酸碱滴定实验报告
氢氧化钠溶液的标定及盐酸溶液对氢氧化钠溶液的滴定一实验目的1培养同学们通过实验手段用已知测未知的实验思想2学习相关仪器的使用方法掌…
-
酸碱中和滴定实验报告[1]
NaOH滴定HAc的实验报告一实验目的测量未知溶液的浓度二实验原理三实验仪器和药品酸式滴定管碱式滴定管锥形瓶铁架台滴定管夹NaOH…
-
酸碱中和滴定实验报告
酸碱中和滴定实验一所用仪器酸式滴定管碱式滴定管和锥形瓶1酸式滴定管和碱式滴定管的构造对比不同点及其原因2对比滴定管和量筒刻度的不同…
-
大学化学实验 滴定分析基本操作 酸碱浓度的比较 实验报告
滴定分析基本操作及酸碱浓度的比较实验报告实验目的就不写出来了大家肯定都有一实验原理1酸碱指示剂有其变色范围pH甲基橙的变色范围是3…
-
酸碱滴定实验报告
氢氧化钠溶液的标定及盐酸溶液对氢氧化钠溶液的滴定一实验目的1培养同学们通过实验手段用已知测未知的实验思想2学习相关仪器的使用方法掌…
-
酸碱中和滴定实验报告[1]
NaOH滴定HAc的实验报告一实验目的测量未知溶液的浓度二实验原理三实验仪器和药品酸式滴定管碱式滴定管锥形瓶铁架台滴定管夹NaOH…
-
酸碱中和滴定 实验报告
实验名称酸碱中和滴定时间实验分组桌号合作者指导老师一实验目的用已知浓度溶液标准溶液本实验盐酸为标准溶液测定未知溶液待测溶液浓度本实…
-
酸碱中和滴定实验预习报告
酸碱中和滴定和溶液配制实验预习报告实验原理c标V标c待V待实验目的1通过中和滴定实验掌握中和滴定实验操作方法2通过中和滴定实验理解…
-
分析化学实验 碱度的测定 实验报告
实验报告姓名班级同组人项目碱度的测定课程分析化学学号一实验目的1掌握酸碱滴定法测定碱度的原理和方法2掌握碱度测定结果的计算3熟练滴…