篇一 :化学反应速率与活化能的测定实验报告
化学反应速率与活化能的测定
(实验报告及数据处理)
实验目的
1.了解浓度、温度及催化剂对化学反应速率的影响。
2.测定(NH4)2S2O8与KI反应的速率、反应级数、速率系数和反应的活化能。
实验原理
(NH4)2S2O8和KI在水溶液中发生如下反应:
S2O82-(aq)+ 3I-(aq) = 2SO42- (aq)+ I3-(aq) (1)
这个反应的平均反应速率为
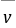 = -
= - 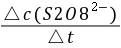 =
= 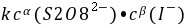 式中:
式中: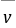 ── 反应的平均反应速率;
── 反应的平均反应速率;
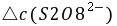 ──
── 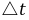 时间内
时间内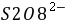 的浓度变化;
的浓度变化;
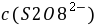 ,
,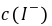 ──
── 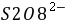 ,
,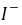 的起始浓度;
的起始浓度;
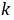 ── 该反应的速率系数;
── 该反应的速率系数;
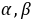 ──反应物
──反应物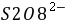 ,
,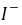 的反应级数,
的反应级数,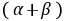 为该反应的总级数。
为该反应的总级数。
为了测出在一定时间(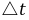 )内S2O82-的浓度变化,在混合(NH4)2S2O8和KI溶液的同时,加入一定体积的已知浓度的Na2S2O3溶液和淀粉,这样在反应(1)进行的同时,还有以下反应发生:
)内S2O82-的浓度变化,在混合(NH4)2S2O8和KI溶液的同时,加入一定体积的已知浓度的Na2S2O3溶液和淀粉,这样在反应(1)进行的同时,还有以下反应发生:
2S2O32- (aq) + I3-(aq) ══ S4O62-(aq) + 3I-(aq) (2)
由于反应(2)的速率比反应(1)的大得多,由反应(1)生成的I3-会立即与S2O32-反应生成无色的S4O62-和I-。这就是说,在反应开始的一段时间内,溶液呈无色,但当Na2S2O3一旦耗尽,由反应(1)生成的微量I3-就会立即与淀粉作用,使溶液呈蓝色。
…… …… 余下全文
篇二 :化学反应速率与活化能的测定实验报告
化学反应速率与活化能的测定实验报告
姓名 班级 试验时间
第 室 号位 指导教师
实验目的
1. 了解浓度、温度及催化剂对化学反应速率的影响。
2. 测定(NH4)2S2O8与KI反应的速率、反应级数、速率系数和反应的活化能。
实验原理
(NH4)2S2O8和KI在水溶液中发生如下反应:
S2O82-(aq)+ 3I-(aq) = 2SO42- (aq)+ I3-(aq) (1)
这个反应的平均反应速率为
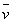 = -
= - 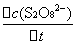 =
= 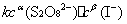
式中: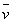 ── 反应的平均反应速率;
── 反应的平均反应速率;
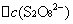 ──
── 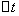 时间内
时间内 的浓度变化;
的浓度变化;
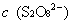 ,
,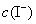 ──
──  ,
,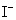 的起始浓度;
的起始浓度;
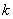 ── 该反应的速率系数;
── 该反应的速率系数;
…… …… 余下全文
篇三 :实验六 化学反应速率和活化能的测定
实验六化学反应速率和活化能的测定——Chemlab软件模拟
一、实验目的
1、 了解虚拟化学实验室Corel Chemlab软件的功能和使用。
2、 模拟氧化-还原反应过程,推导反应速率方程并计算反应的活化能,研究浓度和温度对化学反应速率的影响。
二、实验原理
Corel ChemLab是一款免费软件,在化学实验中主要有以下功能:
(1)提供30多个预设实验;(2)提供化学活动课的基本实验和气体实验平台;(3)可做自主设计性、探究性的实验;(4)提供常见化学分子的三维演示;(5)提供各化学元素的基本信息。
双击Corel ChemLab可执行文件图标,进入Corel ChemLab虚拟化学实验室界面,图1为实验室界面,包含以下主要内容:

图1 Corel ChemLab实验界面
(1)实验操作台。中间是实验操作台,台上有烧杯、酸度计、滴定管和水龙头;台下面有四个实验柜,里面放有备用烧杯和一些化学药品。当鼠标移动到这些器具上,指针变成手形状时,点击便可使用它们。使用烧杯时,右键点击烧杯会出现一个菜单,上面有“装料”、“显示体积”、“快流”或 “慢流”等操作,可装入溶液、显示溶液体积和控制溶液的倒出速度。
…… …… 余下全文
篇四 :化学反应速率及活化能的测定实验报告
化学反应速率及活化能的测定实验报告
1.概述
化学反应速率用符号J或ξ表示,其定义为:
J=dξ/dt (3-1)
ξ为反应进度,单位是mol,t为时间,单位是s。所以单位时间的反应进度即为反应速率。
dξ=v-1BdnB (3-2)
将式(3-2)代入式(3-1)得:
J=v-1BdnB/dt
式中nB为物质B的物质的量,dnB/dt是物质B的物质的量对时间的变化率,vB为物质B的化学计量数(对反应物vB取负值,产物vB取正值)。反应速率J总为正值。J的单位是mol·s-1。

根据质量作用定律,若A与B按下式反应:
aA+bB→cC+dD
其反应速率方程为:
J=kca(A)cb(B)
k为反应速率常数。
a+b=n
n为反应级数。n=1称为一级反应,n=2为二级反应,三级反应较少。反应级数有时不能从方程式判定,如:
2HI→I2+H2
看起来是二级反应。实际上是一级反应,因为
HI→H+I(慢)
HI+H→H2+I(快)
I+I→I2(快)
反应决定于第一步慢反应,是一级反应。从上述可知,反应级数应由实验测定。
…… …… 余下全文
篇五 :实验7 化学反应速率与活化能
实验7 化学反应速率与活化能
一、实验目的
1.了解实验原理,测定过二硫酸铵与碘化钾反应的反应速率,计算反应级数、反应速率常数及反应的活化能;
2.掌握浓度、温度及催化剂对化学反应速率的影响;
3.学习实验数据的处理方法。
二、实验原理
在水溶液中,(NH4)2S2O8和KI发生以下反应:
S2O82- + 3I- → 2SO42-+ I3- (1)
这个反应的平均反应速率可用下式表示:
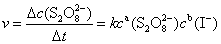
式中Δc(S2O82-)为Δt时间内S2O82-浓度的变化,a、b为反应级数,k为反应速率常数。为了测定(NH4)2S2O8(过二硫酸铵)和KI反应的速率,也就是测定一定时间间隔Δt内S2O82-浓度的变化Δc(S2O82-),可以利用 “记时反应”来实现。在将(NH4)2S2O8溶液和KI溶液混合时,同时加入一定体积的已知浓度的Na2S2O3溶液和淀粉溶液。当S2O82-离子与I-离子反应产生I3-离子时,它立即与S2O32-反应:
…… …… 余下全文
篇六 :实验 化学反应速率与活化能
实验 化学反应速率与活化能
一、实验目的
1.了解浓度、温度和催化剂对反应速率的影响。
2.测定过二硫酸铵与碘化钾反应的速率,并计算反应级数、反应速率常数和反应的活化能。
二、实验原理:
在水溶液中过二硫酸铵与碘化钾反应为:
(NH4)2S2O8 + 3KI === (NH4)2SO4 + K2SO4 + KI3
其离子反应为: S2O82- + 3I- === SO42- + I3- (1)
反应速率方程为: 
式中r是瞬时速率。若 、
、 是起始浓度,则r表示初速率(v0)。在实验中只能测定出在一段时间内反应的平均速率。
是起始浓度,则r表示初速率(v0)。在实验中只能测定出在一段时间内反应的平均速率。
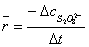
在此实验中近似地用平均速率代替初速率:
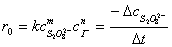
为了能测出反应在△t时间内S2O82-浓度的改变量,需要在混合(NH4)2S2O8 和KI溶液的同时,加入一定体积已知浓度的Na2S2O3溶液和淀粉溶液,这样在(1)进行的同时还进行着另一反应:
…… …… 余下全文
篇七 :化学反应速率与活化能的测定
《工程化学实验》教案
化学反应速率与活化能的测定
实验目的
1. 了解浓度、温度及催化剂对化学反应速率的影响。
2. 测定(NH4)2S2O8与KI反应的速率、反应级数、速率系数和反应的活化能。
实验原理
(NH4)2S2O8和KI在水溶液中发生如下反应:
S2O82-(aq)+ 3I-(aq) = 2SO42- (aq)+ I3-(aq) (1)
这个反应的平均反应速率为
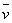 = -
= - 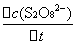 =
= 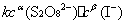
式中: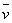 ── 反应的平均反应速率;
── 反应的平均反应速率;
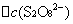 ──
── 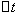 时间内
时间内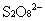 的浓度变化;
的浓度变化;
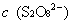 ,
,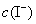 ──
── 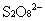 ,
,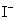 的起始浓度;
的起始浓度;
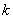 ── 该反应的速率系数;
── 该反应的速率系数;
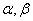 ──反应物
──反应物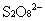 ,
,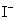 的反应级数,
的反应级数,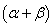 为该反应的总级数。
为该反应的总级数。
为了测出在一定时间(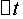 )内S2O82-的浓度变化,在混合(NH4)2S2O8和KI溶液的同时,加入一定体积的已知浓度的Na2S2O3溶液和淀粉,这样在反应(1)进行的同时,还有以下反应发生:
)内S2O82-的浓度变化,在混合(NH4)2S2O8和KI溶液的同时,加入一定体积的已知浓度的Na2S2O3溶液和淀粉,这样在反应(1)进行的同时,还有以下反应发生:
…… …… 余下全文
篇八 :实验七 化学反应速率与活化能的测定
实验七 化学反应速率、活化能的测定
实验目的
1.了解浓度、温度和催化剂对反应速率的影响。
2.练习恒温水浴操作。
实验原理
水溶液中(NH4)2S2O8 和KI的氧化还原反应为复合反应:
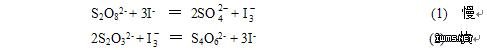
从不同浓度下测得反应速率,就可计算出该反应的反应级数m和n。
实验内容
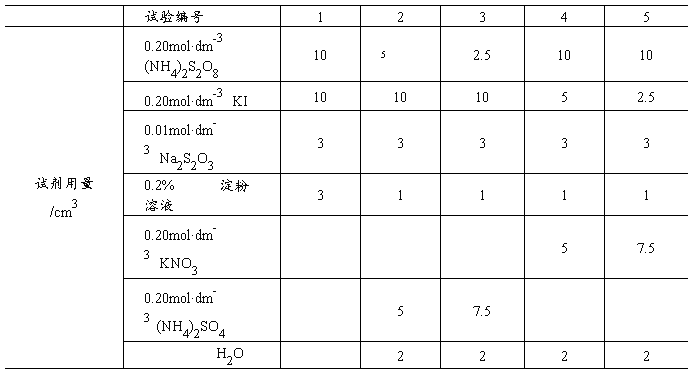
1.浓度对反应速率影响,求反应级数(m=? 和n=?)
2.温度对反应速率的影响求活化能

实验纪录
1.浓度对反应速率影响,求反应级数。
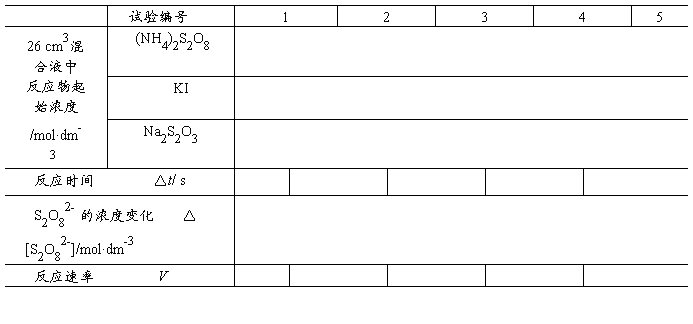
2.温度对反应速率的影响求活化能

实验思考
1.由反应方程式能否确定反应级数?为什么?试用本实验结果说明之。
2.对Na2S2O3用量过多或过少对实验结果有何影响?
3.2和3号中添加不同量的(NH4)2SO4溶液,在实验4和5中添加不同量KNO3溶液用意何在?如何选择添加试剂?
4.若不用S2O82- 而改用I- 或I3- 的浓度变化来表示反应速率,则反应速率常数k是否一样?
5.下列操作情况对反应结果有何影响?
(1)先加(NH4)2S2O8溶液,后加KI溶液。 (2)慢慢加入(NH4)2S2O8溶液。
…… …… 余下全文