分析化学习题总结
4)滴定过程中溶液的pH值发生变化。
氧化还原滴定法:
以电子传递反应为基础的滴定分析法。
滴定剂为强氧化剂或还原剂。
指示剂氧化还原指示剂和惰性指示剂。
滴定过程中溶液的氧化还原电对电位值发生变化
4. 比较摩尔法和佛尔哈德法的异同点。
答:两者均是以消耗银盐量来计算待测物含量。
摩尔法:1)反应:Ag+ + Cl- = AgCl¯(白色),中性或弱碱性介质。
2)滴定剂为AgNO3。
3)指示剂为K2CrO4,Ag+ + CrO42- = Ag2CrO4¯(砖红色)
4)SO42-、AsO43-、PO43-、S2-有干扰。
5)可测Cl-、Br-、Ag+,应用范围窄。
佛尔哈德法:1)反应:Ag+ + Cl- = AgCl¯(白色),Ag+ + SCN- = AgSCN¯(白色),酸性介质。
2)滴定剂为NH4SCN。
3)指示剂为铁铵钒,Fe3+ + SCN- = Fe(SCN)2+(红色)。
4)干扰少。
5)可测Cl-、Br-,I-、SCN-、Ag+,应用范围广。
5. 影响条件电势的因素。 答:离子强度、酸效应、络合效应和沉淀效应
6. 重量分析法对沉淀形式的要求。
答:1)沉淀的溶解度必须很小。
2)沉淀应易于过滤和洗涤。
3)沉淀力求纯净,尽量避免其它杂质的玷污。
4)沉淀易于转化为称量形式
三、简答(每小题5分,共30分)
影响沉淀溶解度的因素。
答:1)同离子效应;2)盐效应;3)酸效应;4)络合效应;5)温度的影响;6)溶剂的影响
含有相等浓度Cl和Br的溶液中,慢慢加入AgNO3溶液,哪一种离子先沉淀?第二种离子开始沉淀时,Cl和Br的浓度比为多少?(AgCl: Ksp=1.56×10-10; AgBr: Ksp=4.1×10-13)。
答:AgCl和AgBr属1:1型沉淀,因AgCl: Ksp=1.56×10-10 < AgBr: Ksp=4.1×10-13,所以,Br-先沉淀。
AgCl: Ksp=[Ag+][Cl-]=1.56×10-10; AgBr: Ksp=[Ag+][Br-]=4.1×10-13

氧化还原指示剂的类型?
答:1)自身指示剂;2)显色指示剂;3)氧化还原指示剂
晶体沉淀的沉淀条件有哪些?
答:1)沉淀作用应在适当稀的溶液中进行;2)应在不断搅拌下,缓慢加入沉淀剂;3)沉淀作用应当在热溶液中进行;4)陈化
5、简述吸光光度法显色反应条件。
1)溶液的酸度;2)显色剂用量;3)显色反应时间;4)显色反应温度;5)溶剂;6)干扰及其消除方法。
6、写出四种常用氧化还原滴定的原理(包括反应方程式、介质条件、指示剂)。
答:1)高锰酸钾法
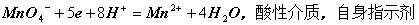
2)重铬酸钾法
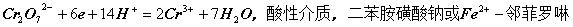
3)碘量法

4)铈量法
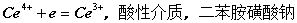
第二篇:分析化学考点总结
一:名词解释
绝对误差:测量值与真实值之差 相对误差:绝对误差与真值的比值
准确度:表示分析结果与真实值的接近程度
精密度:同样测试条件下,同一均匀供试品,经多次取样,测量的各实验值之间互相接近的程度
化学计量点:加入的标准溶液与待测定组分定量反映完全时,称反映达到化学计量点 滴定终点:在计量点前后发生明显的颜色变化以便停止滴定的点 滴定度:每毫升标准溶液所能滴定被测物质的质量
酸碱的定义:凡能给出质子的物质称酸;凡能接受质子的物质称碱 酸度:溶液中H+的浓度
滴定(终点)误差:由于指示剂的变色不恰好在化学计量点而使滴定终点和化学计量点不相符引起的相对误差
质子性溶剂:能给出质子或接受质子的溶剂,给出质子能力较强的称酸性溶剂,接受质子能力较强的称碱性溶剂,既易给出质子又易接受质子的称两性溶剂
均化效应:酸或碱的固有强度有区别,由于溶剂的作用,其强度被均化到溶剂合质子或溶剂阴离子水平的现象
区分效应:由于溶剂作用,使酸或碱离解度发生变化,从而使酸或碱的强度能够区分的现象 条件稳定常数:有副反应发生时配合物的稳定常数
金属离子指示剂:能与金属离子生成有色络合物的有机染料显色剂 封闭现象:化学计量点时不见指示剂变色或变色不敏锐 同离子效应:沉淀达平衡后,向溶液中加入含有某一构晶离子的试剂或溶液使沉淀溶解度降低的现象
盐效应:沉淀的溶解度随溶液中电解质浓度的增大而增大的现象 酸效应:溶液的酸度对沉淀溶解度的影响 络合效应:若溶液中存在能与构晶离子生成可溶性络合物的络合剂,则使沉淀溶解度增大甚至不产生沉淀的现象
共沉淀:可溶性杂质夹杂在沉淀中一起析出的现象
后沉淀:沉淀析出后,溶液中原来不能析出沉淀的组分,也在沉淀表面逐渐沉积出来的现象 均匀沉淀:化学反应时溶液中缓慢的逐渐增加所需沉淀剂,待沉淀剂达到一定浓度时即开始产生沉淀的现象 挥发法:利用被测组分的挥发性,或将它转化为挥发性物质来进行挥发组分质量分数测定的方法
指示电极:电极电位随电解质溶液的浓度或活度变化而改变的电极 参比电极:电极电位不受溶液组成变化影响,其电位值基本固定不变的 二:考点
考点一:系统误差包括:方法误差、仪器或试剂误差、操作误差。
四大特性:可测性、重现性、单向性、可校正性
消除方法:1、校准仪器2、做对照试验3、做回收试验4、做空白试验 偶然误差:不确定性、统计规律性
消除方法:可通过增加平行测定次数消除
考点二:1、PH值有效位数仅取决于小数点后两位
2、化学定量分析通常保留四位 3、四舍六入五成双
4、一次修约,不分次修约
5、加减法以小数点后位数最少为依据;乘除法以有效位数最小为依据
考点三:1、相关系数0<|r|<1
2、描述两个变量的相关性 3、|r|越接近1相关性越好
考点四:滴定分析的化学反应需具备的三大条件
1、反应需定量完成,完全程度达99.9%以上 2、反应必须迅速完成
3、有适宜的指示剂或其他简便确定终点的方法
考点五:基准物符合的条件
1、试剂组成和化学式完全符合
2、试剂纯度达99.9%以上,稳定无副反应 3、较大的相对分子质量
考点六:
三种指示剂法的比较
碘量法三种滴定方式的比较
比较项目 直接碘量法 I2+2e=2I
-
剩余碘量法 I2+还原剂→ I2
(剩余) I2+2S2O32-=2I
-
置换碘量法 I-+氧化剂=I2 I2+2S2O32-=2I-
+S4O62- Na2S2O3 氧化剂
基本反应
+S4O62- I2、Na2S2O3 还原剂
标准溶液 测定对象
I2 强还原剂 ①少数在酸性 ②中性或弱碱性 I2、淀粉指示
剂 滴定前 蓝色
滴定条件 中性或弱酸性 中性或弱酸性
指示剂 淀粉指示剂加入时机 终点颜色
淀粉指示剂 近终点 蓝色消失
淀粉指示剂 近终点 蓝色消失
-
个人学习和工作情况总结
大学四年,于我而言是人生中非常重要的四年。在领导的关心和照顾下,我不断进步成长,在学习,工作,生活中都收获颇丰。现将我大学四年的学…
-
大一学习总结
春去秋来,日复一日,大一学年生活,虽然短暂,但我过得充实而快乐。转眼间,在大学已经呆了一年多了。记得刚进大学时对大学充满了各种憧憬…
-
学习总结
无人旋翼机学习总结第一部分笔记整理无人机基础知识固定翼固定翼机英文Fixedwingaircraft泛指比空气重有动力装置驱动机翼…
-
个人学习总结
我是20xx春乡镇企业管理专业的一名学生,在平湖电大三年的学习时间即将结束。在这里学习的学生基本上都是利用业余时间来进修的,每天除…
-
学习总结
20xx年高考一轮研讨学习总结与反思一瞠目结舌的变局我称之为瞠目结舌或许带有强烈的个人感情色彩但是对突然要面对20xx年全新的高考…
-
关于做好20xx年度北京邮政职工技协工作总结及先进
集体、先进个人、优秀技术成果评选的通知各基层工会、各技协分会:20xx年,北京邮政职工技协在党的十七大、十七届四中全会精神指引下,…
-
沈阳玫瑰大酒店实习工作总结
沈阳玫瑰大酒店实习总结沈阳玫瑰大酒店的实习,对于我们这些教授酒店专业课程的老师来说是一次难得的机会。到酒店去实习,就是把课本的理论…
-
小学英语教师个人工作总结[1]
青年教师工作总结时光飞逝,岁月如流。仔细回味,充满着生机和活力的小学英语已经陪我走过了两个年头。我也已经不知不觉完成了两年的小学英…
-
食堂食品安全自查总结
城关三小食堂食品安全自查总结为切实加强我校食堂食品安全,保障教师饮食安全,防止食物中毒事件发生,我校根据浙江省食品药品监督管理局、…
-
20xx年度勤廉双述工作总结
为了进一步加强对干部的教育监督工作,促进对干部廉洁从政,推进农村基层组织建设和党风廉政建设,现将我村20xx年村干部勤廉双述工作总…