盐类的水解
第三节 盐类的水解
(第一课时)
河田中学 叶治章
教学目标:
1、知识与技能:
⑴ 掌握盐类水解的概念;以CH3COONa、NH4Cl为例理解盐类水解的原理; 了解多元弱酸酸根离子和多元弱碱阳离子的水解情况。 ⑵ 理解盐类水解的特点和规律。
⑶ 进一步熟练掌握溶液酸碱性检测的实验操作 2、过程和方法
⑴通过实验探究、分组讨论,进一步让学生掌握“提出问题-分析问题-理论解释-解决问题”的科学方法。
⑵通过问题探索,培养学生解决实际问题的能力。 3、情感、态度和价值观
⑴通过“盐溶液不一定显中性”的教学,让学生知道全面看事物的辩证思想。 ⑵培养学生实事求是、科学探索的精神。 【教学重点】盐类水解的概念、原理和规律 【教学难点】理解盐类水解的原理
【教学方法】实验探究、启发、多媒体辅助教学 教学过程:
【查阅资料】假如被红蚂蚁咬了,为减轻症状,如何应用家里常见物质进行处理?
【讨论交流】 可以用苏打水,小苏打水,或肥皂液来涂擦伤口,可以减轻症状。这是因为蜜蜂或者红蚂蚁咬人后会分泌一种叫蚁酸的酸性的物质,中和了蚁酸,从而达到减轻疼痛的效果。
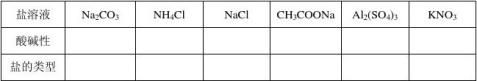
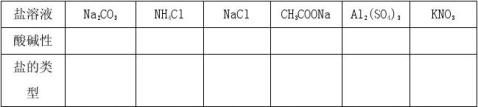
【提出问题】苏打Na2CO3,小苏打Na2HCO3都为盐,为什么它们的溶液不显中性,其他盐溶液是不是也这样呢?
【活动与探究】用pH试纸测定下列溶液的PH值
测定溶液PH值的方法: 在玻璃板上放一片干燥的pH试纸,用玻璃棒蘸取取待试液滴到pH试纸上,把试纸与标准比色卡比较,读出溶液的pH.(注意玻璃棒不能先用水润湿.)

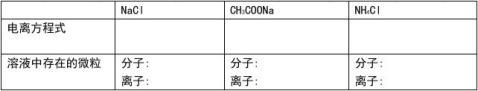
【提出问题】为什么有些盐的溶液不是中性呢?
1
[讨论交流】
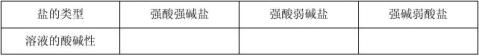
1、盐类水解的概念:在溶液中, 强酸弱碱盐或弱酸强碱盐电离出来的离子与水电离出来的+-H与OH生成弱电解质的过程。
2、盐类水解的本质:盐中的某些离子与水电离出的H+或OH-结合生成难电离的弱酸或弱碱,破坏了水的电离平衡,
思考:盐类水解与盐类类型的关系 NaOH + HCl = NaCl + H

2O 强碱 强酸 强酸强碱盐
CH3COOH + NaOH = CH3COONa + H2O 弱酸 强碱 弱酸强碱盐 NH3. H2O + HCl = NH4Cl + H2O 弱碱 强酸 强酸弱碱盐
3、盐类水解与盐类类型的关系
【巩固练习】
1、下列溶液因发生水解而呈酸性的( )
A、 NaHSO4 B、 FeCl3 C、

CH3COONa D、 KNO3
【思考与交流】是不是同类型的盐水解的程度都一样呢?如果是,1.0mol/LNa2CO3和1.0mol/LNa2SiO3的PH值应该是一样大小的。那是不是呢? 已知H2CO3、H2SiO3在常温条件下的电离常数为:
?+-7
? H2CO3 ? HCO3 + H Ka1 = 4.2×10 ;
?2?+-11
? HCO3 ? CO3 + H Ka2 = 5.61×10
?+-11
? H2SiO3 ? HSiO3 + H Ka1 = 1.7×10;
?2?+ -12
? HSiO3 ? SiO3 + H Ka2 = 1.60×10
【思考交流】已知下列物质在常温条件下的电离常数为
H2CO3 ? HCO3 + H Ka1 = 4.2×10
?
+
-7
2
HCO3? CO3 + H Ka2 = 5.61×10
NH3. H2O ? NH4+ OH Ka = 1.8×10
CH3COOH ? CH3COO + H Ka = 1.8×10
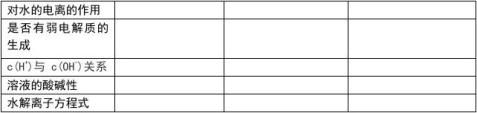
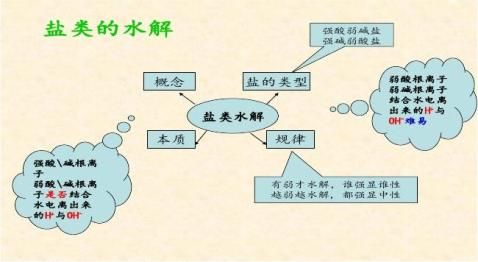
【归纳总结】盐类水解的规律:
? 有弱才水解,谁强显谁性。
? 越弱越水解, 都强显中性。
【课堂总结】
?+-5
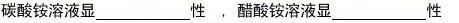
+ --5? 2?+-11巩固练习:
1、物质的量浓度相同的三种盐NaX、NaY、NaZ溶液,其pH依次为8、9、10,则HX、HY、HZ
的酸性由强到弱的是 ( )
A.HZ、HY、HX B.HX、HZ、HY
C.HX、HY、HZ D.HY、HZ、HX
2

、相同温度、相同物质的量浓度的四种溶液:①CH3COONa ②NaHSO4 ③NaCl ④NaClO,按PH由大到小的顺序排列,正确的是 ( )
A.④①③② B.①④③② C.①②③④ D.④③②①
3、在一元强碱MOH溶液中加入一元酸HA溶液,充分反应后,溶液呈中性.
甲同学认为溶液中c(A)=c(M),
而乙同学认为c(A)与c(M)是否相等,要看一元酸HA是强酸还是弱酸.
-+-+ 3
第二篇:盐类的水解学案(选修四)
第三节 盐类的水解
学习目标:
1.初步掌握盐类水解的概念,理解盐类水解的实质,并能够运用盐类水解知识判断盐溶液的酸碱性。
2.学会正确书写盐类水解的离子方程式。 3.了解影响盐类水解的因素。 学习重点
盐类水解的本质,理解强酸弱碱盐与强碱弱酸盐水解规律 学习难点
判断盐溶液的酸碱性 导学过程
由上述实验结果分析,盐的组成与盐溶液酸碱性的关系:
【自主探知】 2、阅读课本,(1)分析CH3COONa水溶液呈碱性的原因。
(2)分析一下NH4Cl为什么显酸性?用离子方程式表示一下NH4C1的水解过程。
(3)请同学们再分析一下。为什么NaCl溶液是中性的?
【结论】3.盐类的水解:
①定义:在溶液中 电离出来的离子跟 所电离出来的H+或 OH-结合生成 的反应,叫做盐类的水解。 ②实质:水的电离平衡向 移动。
③原因:弱酸 离子或弱碱 离子与H+或OH-结合生成 弱电解质。
④盐类水解的条件
1
? ?
3.规律:有弱才水解,无弱不水解;越弱越水解,谁强显谁性。
【小结】:填写酸性、碱性、或中性:
强酸强碱形成的盐溶液显 性;
强酸弱碱形成的盐溶液显 性;
弱酸强碱形成的盐溶液显 性;
4、水解离子方程式的书写
① 盐类水解是可逆反应,反应方程式中要写“ ”
② 一般水解程度很小,水解产物很少,通常不生成沉淀和气体,不用“↓”、“↑”
符号,生成物(如H2CO3、NH3?H2O等)也不写分解产物;
③ 多元弱酸盐分步水解,第一步为主,水解方程式一般只写第一步。
【探究练习】:
1)根据水解规律,判断Na2CO3、A12(SO4)3、KNO3三种盐溶液的酸碱性,并指
出所显性质的原因。
2)写出Na2CO3 和A12(SO4)3的水解方程式:
【当堂达标】:
1.盐类水解的过程中正确的说法是 ( )
A.盐的电离平衡破坏 B.水的电离平衡发生移动
C.溶液的pH发生改变 D.没有发生中和反应
2、下列化合物中,其水溶液由于水解而显酸性的是 ( )
A.NaHCO3 B.NaHSO4 C.HCl D.NH4Cl
3、下列物质的水溶液,常温下pH值大于7的是 ( )
A.硫化钠 B.氯化铜 C.硝酸钠 D.乙醇
4、下列盐的水溶液,其pH值小于7的是 ( )
A.NaHCO3溶液 B.NaCl溶液 C.CH3COONH4溶液 D.NH4Cl溶液
5、物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,其pH值依次为8、9、10,则
HX、HY、HZ的酸性由强到弱的顺序是 ( )
A.HX、HZ、HY B.HZ、HY、HX C.HX、HY、HZ D.HY、HZ、HX
6.请判断下列盐溶液的酸碱性,并用离子方程式表示其显酸性或碱性的原因。:
CuSO4、FeCl3、Na2S、KNO3、BaCl2、Na2SO3
2
第二课时
学习目标:
1.学会正确书写盐类水解的离子方程式。
2.了解影响盐类水解的因素。
学习重点
盐类水解的本质,理解强酸弱碱盐与强碱弱酸盐水解规律
学习难点
盐类水解方程式的书写和分析
【复习回顾】
1、实质:盐中 与水电离出的 结合生
成 ,破坏 ,_______水的电离,造成了溶液中______和________不相等,使溶液显示不同程度的酸碱性.
2、特征:
①属可逆反应,其逆反应为 。
②水解反应为 热反应。
③水解程度一般微弱。
【探究学习】
一、水解离子方程式的书写的注意事项:
①盐类水解的程度通常是很小的,所以书写方程式时用“ _ ”。
②水解反应生成的挥发性物质和难溶性物质一般不标 “ _ ” 和 “ _ ”。 如Cu2+的水解 :_____________________
③多元弱酸根水解是 进行的,多元弱碱阳离子一步写到位。
如S2-的水解 :_____________________, _____________________。 Al3+的水解:_____________________
二、水解规律:
1、谁弱水水解,谁强显谁性
(1)强碱弱酸盐:发生水解的离子为 ,溶液显 性。
如CH3COONa水解离子方程式为: ;
Na2CO3水解离子方程式: 。
(2)强酸弱碱盐:发生水解的离子为 ,溶液显 性。
如FeCl3水解离子方程式为: 。
NH4Cl 水解化学方程式为: 。
3
(3)弱酸弱碱盐:都弱都水解。水解程度增大,溶液可能显 性,
这取决于水解生成的弱酸、弱碱相对电离程度的大小,一般不做要求。 (4) 强酸强碱正盐:不水解,溶液显 性。如NaCl、Na2SO4等。 2、水解程度的判断:越弱越水解
(1)比较均为0.1mol/L的NaCl、NaF、CH3COONa、Na2CO3、NaHCO3的pH _______________________________________________________________ (2)已知电离程度:H2CO3〉C6H5OH〉HCO3-,则同浓度的碳酸钠、苯酚钠、碳酸氢钠的碱性强弱顺序是:_______________________________
3、强烈双水解:指能使水解反应进行到底,生成沉淀、气体的弱酸弱碱 这时要用=连接,沉淀标↓符号,气体标↑符号。
①如 Al3+与S2-、HS-、CO32-、HCO3-、AlO2- SO32-、HSO3-在溶液中水解进行到底, ②Fe3+与 CO32-、HCO3-、AlO2-在溶液中水解进行到底,但Fe3+与S2-、HS- SO32-、HSO3-为氧化还原反应。
练习:写出下列反应的化学方程式、离子方程式: Al2(SO4)3溶液和Na2CO3溶液:
Al2(SO4)3溶液和NaHCO3溶液:
Al2(SO4)3溶液和NaAlO2溶液:
4、酸式盐溶液的酸碱性的判断:
酸式盐溶液的酸碱性通常由水解和电离程度的相对大小来决定。例如: (1)NaHSO3 NaH2PO4 溶液显 ________性,因为_________________________ (2)NaHS NaHCO3 溶液显 ________性,因为_________________________ 三、影响盐类水解的因素:
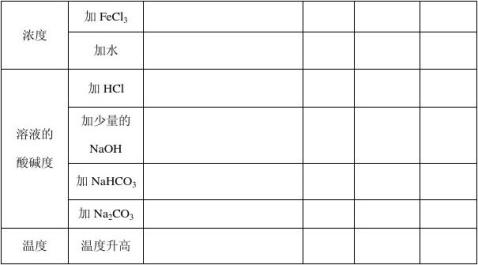
[科学探究]通过实验探究促进或抑制FeCl3水解的条件,了解影响盐类水解程度的因素。 写出FeCl3水解的化学方程式 ,设计实验完成下表

4



【总结】影响盐类水解的因素
1、主要因素:盐的本性, ,盐的水解程度越大。 2、温度:因水解是_____热过程,所以温度越 ,水解程度越大。 3、浓度:盐的浓度越 ,水解程度越大,但是。 4、外加酸碱性: 。 【当堂达标】
1.在一定条件下发生下列反应,其中属于盐类水解反应的是 ( ) A.NH4+ +2H2O
-
+
NH3·H2O + H3O+ B.HCO3- + H2O H3O+ + CO32- H+Cl+HClO
-
+
-
C.HS+H=== H2S D.Cl2+H2O
2、当Mg(OH)2在水中达到溶解平衡时:Mg(OH)2Mg2++2OH 要使Mg(OH)2进一步溶解,应向溶液中加少量的固体是 ( ) A.NH4Cl B.NaOH C.Na2CO3 D.干冰
5
第三课时
四、比较溶液中离子浓度 : 1、同一溶液中不同离子浓度比较
Na2CO3溶液中离子浓度由大到小的顺序为________________________. 2、不同溶液中相同离子浓度比较:
(1)对比同浓度的下列溶液中c(NH4+)的大小 。
①NH4HCO3 ②(NH4)2CO3 ③NH4HSO4 ④(NH4)2SO4 ⑤CH3COONH4 ⑥NH3H2O (2)物质的量浓度相同的下列各溶液,由水电离出的OH-的浓度由大到小的顺序________________________________①NaHSO4 ② NaHCO3 ③ Na2CO3 ④ Na2SO4 3、混合溶液中离子浓度比较:
pH=3的HCl与、pH=11的氨水等体积混合,混合后溶液中离子浓度由大到小的顺序为 。
2判断溶液中离子浓度的大小:
(1)CH3COONa溶液中离子浓度大小顺序为(2)(NH4)2SO4溶液中离子浓度大小顺序为 (3)Na2CO3溶液中离子浓度大小顺序为五、解释某些化学现象及在生活生产中的应用:
1.配制盐溶液时,加酸或碱抑制水解:
为了防止配制FeCl3溶液时可能浑浊,应向溶液中加入 抑制 水解。 2.试剂存放:盛放Na2CO3溶液的试剂瓶不能用玻璃塞,原因是
_______ 盛放NH4F溶液不能用玻璃瓶,是因为_______________________________________ 3.日常生活中的应用:
(1)泡沫灭火器原理(方程式)_____________ __________________ (2)为什么,KAl(SO4)2 ,Fe2(SO4)3、Al2(SO4)3等盐可用做净水剂
___________ (3)草木灰为什么不能和铵态氮肥混合使用
. (4)为什么热的纯碱溶液去污效果好?
6
【当堂达标】
1.NH4Cl溶液中,离子浓度由大到小顺序正确的是 ( )
A.c(NH4+)>c(C1-)>c(H+)>c(OH-) B.c(C1-)>c(NH4+)>c(H+)>c(OH-)
C.c(H+)>c(OH-)>c(NH4+)>c(Cl-) D.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
2.下列离子既能电离又能水解,且能与强酸或强碱反应的是 ( )
A.CH3COO- B.HCO3 - C.H2PO4- D.A1O2-
3.练习:同浓度的下列溶液的pH值由大到小的顺序为 。 ①NH4HSO4 ②NaHCO3 ③Na2CO3 ④C6H5ONa ⑤H2SO4
⑥Ba(OH)2 ⑦NH4Cl ⑧(NH4)2SO4 ⑨CH3COONH4 ⑩KOH
【例2】【3.2第83页3】(2010广东理综卷,12)HA为酸性略强与醋酸的一元弱酸,在0.1 mol·L-1 NaA溶液中,离子浓度关系正确的是
A.c(Na)>c(A)>c(H+)>c(OH) +--
B.c(Na)>c(OH)>c(A)>c(H+) +--
C.c(Na)+ c(OH)= c(A)+ c(H+) +--
D.c(Na)+ c(H+) = c(A)+ c(OH) +--
解析:A明显错误,因为阳离子浓度都大于阴离子浓度,电荷不守恒;D是电荷守恒,明显正确。NaA的水解是微弱的,故c(A)>c(OH),B错;C的等式不符合任何一个守恒关系,是错误的;
答案:D
1判断溶液的酸碱性:
(1)将0.1mol/L的下列溶液按PH由小到大的顺序排列①Na2CO3②NaHCO3 ③NaOH ④NaNO3 ⑤CH3COOH ⑥NaHSO4 ⑦NH4______ --
4把盐溶液蒸干制取无水盐晶体:把下列盐溶液蒸干得到何种物质:
AlCl3 Al2(SO4)3___ FeCl3__
Na2CO3 CuSO4 ___
5判断溶液中的离子能否共存:主要掌握Al3+(Fe3+)与HCO3-、CO32- ,AlO2-、S2-不共存。
6某些活泼金属与盐溶液的反应:Mg粉投入NH4Cl溶液中反应的离子方程式:
_______.
2.在CH3COONa溶液中各离子的浓度由大到小排列顺序正确的是 ( ) 7
A.c(Na+)﹥c(CH3COO-)﹥c(OH-)﹥c(H+) B.c(CH3COO-)﹥c(Na+)﹥c(OH-)﹥c(H+)
C.c(Na+)﹥c(CH3COO-)﹥c(H+)﹥c(OH-) D.c(Na+)﹥c(OH-)﹥c(CH3COO-)﹥c(H+)
6、等物质的量浓度的下列溶液中,NH4离子的浓度最大的是( C )
A.NH4Cl B.NH4HCO3 C.NH4HSO4 D.NH4NO3
3.25℃时,在物质的量浓度均为1mol/ L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2三种溶液中,c(NH4)分别为a、b、c(单位为mol/ L)。下列判断正确的是 ( )
A. a>b>c B. b>a>c C. a>c>b D. c>a>b
4.能使Na2CO3溶液中Na+与CO32- 更接近2:1的措施是 ( )
A 加水 B 加Na2CO3粉末 C 加KOH固体 D 加热
5.下列物质加入水中,能使水的电离度增大,溶液的pH值减小的是 ( )
A、HCl B、Al2(SO4)3 C、Na2S D、NH3.H2O 7、25℃时,在浓度均为1mol·L-1的(NH4)2SO4 、(NH4)2CO3 、(NH4)2Fe(SO4)2的
+溶液中,测得其中c(NH4)分别为a、b、c(mol·L-1),则下列判断正确的是( )
A.a>b>c B.c>a>b C.b>a>c D.a >c>b
42、Na2S的水溶液洗患处可以用来治疗由一种小芥虫在皮肤内生活引起的皮肤病,而且用热水配制的Na2S溶液治疗效果更好。请说明原因,并写出有关的化学方程式。
43、水玻璃在工业上可作粘合剂,当它与NH4Cl溶液接触时,会很快凝结。原因是 。 ++ 8
第三节 盐类的水解
第一课时
学习目标:
1.初步掌握盐类水解的概念,理解盐类水解的实质,并能够运用盐类水解知识判断盐溶液的酸碱性。
2.学会正确书写盐类水解的离子方程式。 3.了解影响盐类水解的因素。 学习重点
盐类水解的本质,理解强酸弱碱盐与强碱弱酸盐水解规律 学习难点
判断盐溶液的酸碱性 导学过程
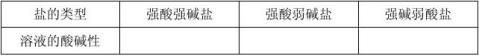
由上述实验结果分析,盐的组成与盐溶液酸碱性的关系:
【自主探知】 2、阅读课本,(1)分析CH3COONa水溶液呈碱性的原因。
(2)分析一下NH4Cl为什么显酸性?用离子方程式表示一下NH4C1的水解过程。
(3)请同学们再分析一下。为什么NaCl溶液是中性的?
【结论】3.盐类的水解:
①定义:在溶液中 电离出来的离子跟 所电离出来的H+或 OH-结合生成 的反应,叫做盐类的水解。 ②实质:水的电离平衡向 移动。
③原因:弱酸 离子或弱碱 离子与H+或OH-结合生成 弱电解质。
④盐类水解的条件
9
? ?
3.规律:有弱才水解,无弱不水解;越弱越水解,谁强显谁性。
【小结】:填写酸性、碱性、或中性:
强酸强碱形成的盐溶液显 性;
强酸弱碱形成的盐溶液显 性;
弱酸强碱形成的盐溶液显 性;
4、水解离子方程式的书写
① 盐类水解是可逆反应,反应方程式中要写“ ”
② 一般水解程度很小,水解产物很少,通常不生成沉淀和气体,不用“↓”、“↑”
符号,生成物(如H2CO3、NH3?H2O等)也不写分解产物;
③ 多元弱酸盐分步水解,第一步为主,水解方程式一般只写第一步。
【探究练习】:
1)根据水解规律,判断Na2CO3、A12(SO4)3、KNO3三种盐溶液的酸碱性,并指
出所显性质的原因。
2)写出Na2CO3 和A12(SO4)3的水解方程式:
【当堂达标】:
1.盐类水解的过程中正确的说法是 ( )
A.盐的电离平衡破坏 B.水的电离平衡发生移动
C.溶液的pH发生改变 D.没有发生中和反应
2、下列化合物中,其水溶液由于水解而显酸性的是 ( )
A.NaHCO3 B.NaHSO4 C.HCl D.NH4Cl
3、下列物质的水溶液,常温下pH值大于7的是 ( )
A.硫化钠 B.氯化铜 C.硝酸钠 D.乙醇
4、下列盐的水溶液,其pH值小于7的是 ( )
A.NaHCO3溶液 B.NaCl溶液 C.CH3COONH4溶液 D.NH4Cl溶液
5、物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,其pH值依次为8、9、
10,则HX、HY、HZ的酸性由强到弱的顺序是 ( )
A.HX、HZ、HY B.HZ、HY、HX C.HX、HY、HZ D.HY、HZ、HX
6.请判断下列盐溶液的酸碱性,并用离子方程式表示其显酸性或碱性的原因。:
CuSO4、FeCl3、Na2S、KNO3、BaCl2、Na2SO3
10
第二课时
学习目标:
1.学会正确书写盐类水解的离子方程式。
2.了解影响盐类水解的因素。
学习重点
盐类水解的本质,理解强酸弱碱盐与强碱弱酸盐水解规律
学习难点
盐类水解方程式的书写和分析
【复习回顾】
1、实质:盐中 与水电离出的 结合生
成 ,破坏 ,_______水的电离,造成了溶液中______和________不相等,使溶液显示不同程度的酸碱性.
2、特征:
①属可逆反应,其逆反应为 。②水解反应为 热反应。 ③水解程度一般微弱。
【探究学习】
一、水解离子方程式的书写的注意事项:
①盐类水解的程度通常是很小的,所以书写方程式时用“ _ ”。
②水解反应生成的挥发性物质和难溶性物质一般不标 “ _ ” 和 “ _ ”。 如Cu2+的水解 :_____________________
③多元弱酸根水解是 进行的,多元弱碱阳离子一步写到位。
如S2-的水解 :_____________________, _____________________。 Al3+的水解:_____________________
二、水解规律:
1、谁弱水水解,谁强显谁性
(1)强碱弱酸盐:发生水解的离子为 ,溶液显 性。
如CH3COONa水解离子方程式为: ;
Na2CO3水解离子方程式: 。
(2)强酸弱碱盐:发生水解的离子为 ,溶液显 性。
如FeCl3水解离子方程式为: 。
NH4Cl 水解化学方程式为: 。
11
(3)弱酸弱碱盐:都弱都水解。水解程度增大,溶液可能显 性,
这取决于水解生成的弱酸、弱碱相对电离程度的大小,一般不做要求。 (4) 强酸强碱正盐:不水解,溶液显 性。如NaCl、Na2SO4等。 3、强烈双水解:指能使水解反应进行到底,生成沉淀、气体的弱酸弱碱 这时要用=连接,沉淀标↓符号,气体标↑符号。
①如 Al3+与S2-、HS-、CO32-、HCO3-、AlO2- SO32-、HSO3-在溶液中水解进行到底, ②Fe3+与 CO32-、HCO3-、AlO2-在溶液中水解进行到底,但Fe3+与S2-、HS- SO32-、HSO3-为氧化还原反应。
4、酸式盐溶液的酸碱性的判断:
酸式盐溶液的酸碱性通常由水解和电离程度的相对大小来决定。例如: (1)NaHSO3 NaH2PO4 溶液显 ________性,因为_________________________ (2)NaHS NaHCO3 溶液显 ________性,因为_________________________ 【当堂达标】
1.在一定条件下发生下列反应,其中属于盐类水解反应的是 ( ) A.NH4+ +2H2O
NH3·H2O + H3O+ B.HCO3- + H2O
H3O+ + CO32- H++Cl-+HClO
C.HS-+H+=== H2S D.Cl2+H2O
2.下列离子既能电离又能水解,且能与强酸或强碱反应的是 ( ) A.CH3COO- B.HCO3 - C.H2PO4- D.A1O2- 3、水解程度的判断:越弱越水解
(1)比较均为0.1mol/L的NaCl、NaF、CH3COONa、Na2CO3、NaHCO3的pH _______________________________________________________________ (2)已知电离程度:H2CO3〉C6H5OH〉HCO3-,则同浓度的碳酸钠、苯酚钠、碳酸氢钠的碱性强弱顺序是:_______________________________
12
第三课时
学习目标:
1. 了解影响盐类水解的因素及其应用 学习重难点 盐类水解的应用 【探究学习】
三、影响盐类水解的因素:
[科学探究]通过实验探究促进或抑制FeCl3水解的条件,了解影响盐类水解程度的因素。
写出FeCl3水解的化学方程式 ,设计实验完成下表
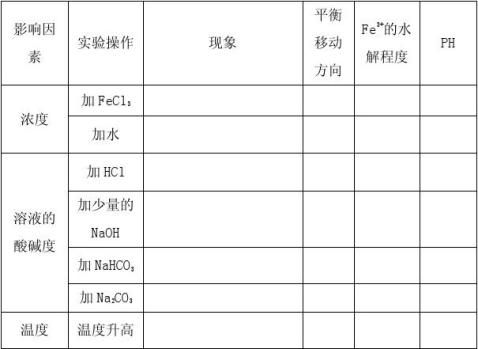
【总结】影响盐类水解的因素
1、主要因素:盐的本性, ,盐的水解程度越大。 2、温度:因水解是_____热过程,所以温度越 ,水解程度越大。 3、浓度:盐的浓度越 ,水解程度越大,但是。 4、外加酸碱性: 。 【精讲释疑】
四、比较溶液中离子浓度 :
13
1、同一溶液中不同离子浓度比较
Na2CO3溶液中离子浓度由大到小的顺序为________________________. 【练习1】判断溶液中离子浓度的大小:
(1)CH3COONa溶液中离子浓度大小顺序为________________________ (2)(NH4)2SO4溶液中离子浓度大小顺序为__________________ (3)Na2CO3溶液中离子浓度大小顺序为__________________________ 2、不同溶液中相同离子浓度比较:
(1)对比同浓度的下列溶液中c(NH4+)的大小 。
①NH4HCO3 ②(NH4)2CO3 ③NH4HSO4 ④(NH4)2SO4 ⑤CH3COONH4 ⑥NH3H2O (2)物质的量浓度相同的下列各溶液,由水电离出的OH-的浓度由大到小的顺序________________________________①NaHSO4 ② NaHCO3 ③ Na2CO3 ④ Na2SO4 3、混合溶液中离子浓度比较:
pH=3的HCl与、pH=11的氨水等体积混合,混合后溶液中离子浓度由大到小的顺序为 。 五、解释某些化学现象及在生活生产中的应用: 1.配制盐溶液时,加酸或碱抑制水解:
为了防止配制FeCl3溶液时可能浑浊,应向溶液中加入 抑制 水解。
2.试剂存放:盛放Na2CO3溶液的试剂瓶不能用玻璃塞,原因是
_____________________________________________
盛放NH4F溶液不能用玻璃瓶,是因为_______________________________________ 3.日常生活中的应用:
(1)泡沫灭火器原理(方程式)_____________ __________________
(2)为什么,KAl(SO4)2 ,Fe2(SO4)3、Al2(SO4)3等盐可用做净水剂 _______________________ (3)草木灰为什么不能和铵态氮肥混合使用
______________ __________________. (4)为什么热的纯碱溶液去污效果好?
______________ __________________.
14
(5)某些活泼金属与盐溶液的反应:Mg粉投入NH4Cl溶液中反应的离子方程式: ___________________________________ ___________ 【当堂达标】
1.NH4Cl溶液中,离子浓度由大到小顺序正确的是 ( )
A.c(NH4+)>c(C1-)>c(H+)>c(OH-) B.c(C1-)>c(NH4+)>c(H+)>c(OH-) C.c(H+)>c(OH-)>c(NH4+)>c(Cl-) D.c(Cl-)>c(NH4+)>c(OH-)>c(H+) 2.同浓度的下列溶液的pH值由大到小的顺序为 。 ①NH4HSO4 ②NaHCO3 ③Na2CO3 ④C6H5ONa ⑤H2SO4
⑥Ba(OH)2 ⑦NH4Cl ⑧(NH4)2SO4 ⑨CH3COONH4 ⑩KOH 3.将0.1mol/L的下列溶液按PH由小到大的顺序排列①Na2CO3②NaHCO3 ③NaOH
⑤NaNO3 ⑤CH3COOH ⑥NaHSO4 ⑦NH4Cl_________________ ______
4把盐溶液蒸干制取无水盐晶体:把下列盐溶液蒸干得到何种物质: AlCl3____ ___ Al2(SO4)3 _____ ___ FeCl3______ __ Na2CO3______ _ CuSO4 __ ___
5、等物质的量浓度的下列溶液中,NH4+离子的浓度最大的是( ) A.NH4Cl B.NH4HCO3 C.NH4HSO4 D.NH4NO3 【能力提升】
6在CH3COONa溶液中各离子的浓度由大到小排列顺序正确的是 ( )
A.c(Na+)﹥c(CH3COO-)﹥c(OH-)﹥c(H+) B.c(CH3COO-)﹥c(Na+)﹥c(OH-)﹥c(H+)
C.c(Na+)﹥c(CH3COO-)﹥c(H+)﹥c(OH-) D.c(Na+)﹥c(OH-)﹥c(CH3COO-)﹥c(H+)
7.25℃时,在物质的量浓度均为1mol/ L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2
三种溶液中,c(NH4+)分别为a、b、c(单位为mol/ L)。下列判断正确的是 ( )
A. a>b>c B. b>a>c C. a>c>b D. c>a>b 8.HA为酸性略强与醋酸的一元弱酸,在0.1 mol·L-1 NaA溶液中,离子浓度关系正确的是
A.c(Na+)>c(A-)>c(H+)>c(OH-) B.c(Na+)>c(OH-)>c(A-)>c(H+) C.c(Na+)+ c(OH-)= c(A-)+ c(H+)
15
D.c(Na+)+ c(H+) = c(A-)+ c(OH-)
16
-
盐类的水解知识点总结
1盐类的水解1复习重点1盐类的水解原理及其应用2溶液中微粒间的相互关系及守恒原理2难点聚焦一H2OH盐的水解实质nnn当盐AB能电…
-
盐类的水解知识点(学生版)
盐类的水解知识大复习一探究盐溶液的酸碱性结论强酸弱碱盐显酸性强碱弱酸盐显碱性强酸强碱盐显中性二盐溶液呈现不同酸碱性的原因三盐的水解…
-
盐类的水解知识点总结
1盐类的水解1复习重点1盐类的水解原理及其应用2溶液中微粒间的相互关系及守恒原理2难点聚焦一H2OH盐的水解实质nnn当盐AB能电…
-
盐类的水解知识点总结
盐类的水解知识点总结1复习重点1盐类的水解原理及其应用2溶液中微粒间的相互关系及守恒原理2难点聚焦一H2OH盐的水解实质nnn当盐…
-
盐类的水解知识点总结
1盐类的水解1复习重点1盐类的水解原理及其应用2溶液中微粒间的相互关系及守恒原理2难点聚焦一盐的水解实质H2OHOHnnn当盐AB…
-
化学选修4第四章第三节《盐类的水解》知识总结
化学选修四第四章第3节《盐类的水解》知识总结一、探究盐溶液的酸碱性强碱弱酸盐的水溶液,呈碱性;强酸弱碱盐的水溶液,呈酸性;强酸强碱…
-
盐类的水解知识点总结
1盐类的水解1复习重点1盐类的水解原理及其应用2溶液中微粒间的相互关系及守恒原理2难点聚焦一H2OH盐的水解实质nnn当盐AB能电…
-
盐类水解知识点总结
盐类水解基础知识点在溶液中盐的离子跟水所电离出来的H或OH生成弱电解质的过程叫做盐类的水解盐类的水解所条件盐必须溶于水盐必须能电离…
-
盐类的水解知识点总结
1盐类的水解1复习重点1盐类的水解原理及其应用2溶液中微粒间的相互关系及守恒原理2难点聚焦一H2OH盐的水解实质nnn当盐AB能电…
-
盐类的水解知识点总结
盐类的水解知识点总结1复习重点1盐类的水解原理及其应用2溶液中微粒间的相互关系及守恒原理2难点聚焦一H2OH盐的水解实质nnn当盐…