酸碱中和滴定实验报告[1]
NaOH滴定HAc的实验报告
一、实验目的:测量未知溶液的浓度
二、实验原理
三、实验仪器和药品
酸式滴定管、碱式滴定管、锥形瓶、铁架台、滴定管夹、NaOH溶液(标准液)、未知浓度的HAc
(待测液)、酚酞(变色范围8~10)
四、实验步骤
(一)滴定前的准备阶段
1、检漏:检查滴定管是否漏水
2、洗涤:先用蒸馏水洗涤滴定管,再用待装液润洗2~3次
3、量取:用酸式滴定管量出一定体积的未知浓度的HAc溶液,注入锥形瓶中,并往
锥形瓶中滴加几滴酚酞,现象为溶液不变色。用碱式滴定管量取标准液NaOH,使液面恰好在0刻度或0刻度以下某准确刻度,记录读数V1,读至小数点后第二位。
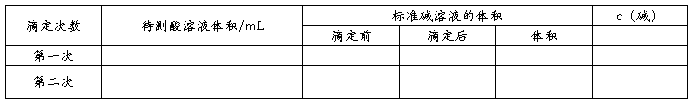
(二)滴定阶段
1、把锥形瓶放在碱式滴定管的下面,将滴定管中溶液逐滴滴入锥形瓶中,滴定时,右手不断旋摇锥形瓶,左手控制滴定管活塞,眼睛注视锥形瓶内溶液颜色的变化,直到滴入一滴氢氧化钠后溶液变为粉红色且半分钟内不恢复原色。此时,醋酸恰好完全被氢氧化钠中和,达到滴定终点。记录滴定后液面刻度V2。
2、把锥形瓶内的溶液倒入废液缸,用蒸馏水把锥形瓶洗干净,将上述操作重复3次。
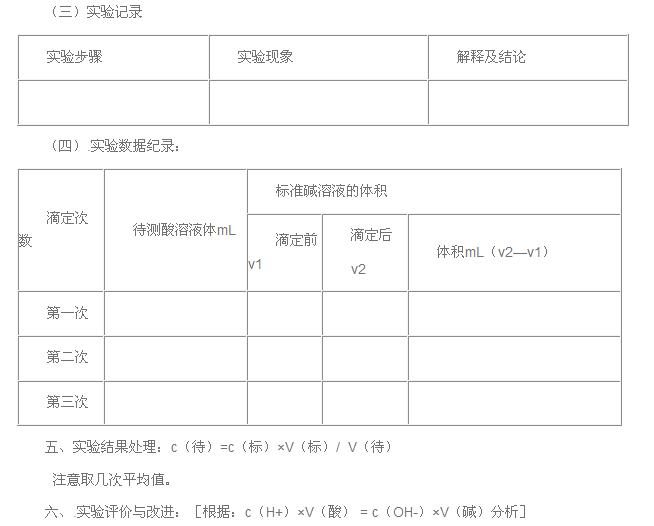
(三)数据处理
注意:取三次测定数值的平均值,计算待测液的物质的量浓度
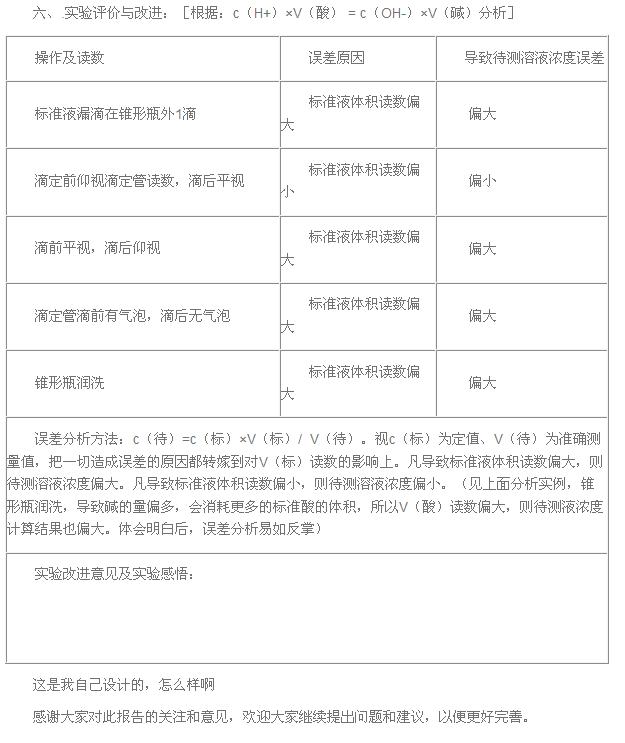
(四)误差分析
1、来自滴定管产生的误差:
①滴定管用蒸馏水洗后,未用标准液润洗 ②滴定管未用待测液润洗
③盛标准液的滴定管滴定前有气泡,滴定后无气泡
④盛标准液的滴定管滴定前无气泡,滴定后有气泡
⑤盛待测液的滴定管滴定前有气泡,滴定后无气泡
2、来自锥形瓶中产生的误差
锥形瓶用蒸馏水洗后又用待测液润洗
3、读数带来的误差
如:标准液读数时
①先俯视后仰视 ②先仰视后俯视
第二篇:酸碱中和滴定练习题1
酸碱中和滴定练习题1
1、在下列叙述仪器“0”刻度位置正确的是
A. 在量筒的上端
C. 在托盘天平刻度尺的正中 B. 在滴定管上端 D. 在托盘天平刻度尺的右边
D. 有刻度的50ml烧杯 2、准确量取25.00ml KMnO4溶液,可选用的仪器是 A. 25ml量筒 B. 25ml酸式滴定管 C. 25ml碱式滴定管
3、酸碱完全中和时
A、酸与碱的物质的量一定相等 C、酸与碱的质量相等
+- B、酸所能提供的H和碱所能提供的OH的物质的量相等 D、溶液呈中性
4、要准确量取25.00mL的稀盐酸,可用的仪器是
A、25mL容量瓶 B、25mL量筒 C、25mL酸式滴定管 D、25mL碱式滴定管
5、在25mL的碱式滴定管中盛有溶液,液面恰好在20mL刻度处,现将滴定管内溶液全部放出,流入量筒内,所得溶液的体积为
A、5mL B、20mL C、大于5mL D、小于5mL
6、用物质的量浓度相同的盐酸、硫酸、磷酸溶液,分别中和质量相同、浓度相同的NaOH溶液生成正盐,消耗这三种酸的体积比是
A、1:1:1 B、3:2:1 C、6:3:2 D、1:2:3
7、中和相同体积、相同pH的Ba(OH)2、NaOH和NH3·H2O三种稀溶液,所用相同浓度的盐酸的体积分别为V1、V2、V3,则三者的大小关系为
A、V3>V2>V1 B、V3>V2=V1 C、V3=V2>V1 D、V1=V2>V3,
8、用NaOH溶液滴定盐酸时,由于滴定速度太快,当混合溶液变红时不知NaOH是否过量,判断它是否过量的方法是
A、加入5mL盐酸再进行滴定 B、返滴一滴待测盐酸
C、重新进行滴定 D、以上方法均不适用
9、下列有关中和滴定的操作:①用标准液润洗滴定管;②往滴定管内注入标准溶液;③检查滴定管是否漏水;④滴定;⑤滴加指示剂于待测液;⑥洗涤。正确的操作顺序是
A.⑥③①②⑤④ B.⑤①②⑥④③
C.⑤④③②①⑥ D.③①②④⑤⑥
-110、某学生用碱式滴定管量取0.1mol·L的NaOH溶液,开始时仰视液面读数为1.0mL, 取出部
分溶液后,俯视液面,读数为11.0mL,该同学在操作中实际取出的液体体积为
A.大于10.0mL B.小于10.0mL C.等于10.0mL D.等于11.0mL
-1-111、用0.01mol·LH2SO4滴定0.01mol·LNaOH溶液,中和后加水至100mL .若滴定时终点
+判断有误差:①多加了1滴H2SO4;②少加了1滴H2SO4(设1滴为0.05mL),则①和②[H]之比值
3 4A.10 B.50 C.5×10D.10
12. 下列关于中和反应的说法正确的是
A.酸碱中和反应的实质是H+OH=H2O B. 酸碱完全中和时,溶液一定呈中性。
C.酸碱反应达到滴定终点时,两者物质的量相等。
D. 任何酸碱中和反应的离子方程式都可以写成H+OH=H2O
13.下列实验方法能够达到要求的是
1 +-+-
A.用托盘天平称量25.20gNaCl B.用250mL的容量瓶配制200mL的Na2CO3溶液
C.用25mL的滴定管量取14.80mL溶液D.用广泛PH试纸测某碱液的PH为12.5
13、现有下列仪器或用品:①铁架台(含铁圈、各种铁夹);②锥形瓶;③滴定管(酸式与碱式);④烧杯(若干个);⑤玻璃棒;⑥天平(含砝码);⑦滤纸;⑧量筒;⑨三角漏斗。有下列药品:①NaOH固体;②标准NaOH溶液;③未知浓度的盐酸;④Na2CO3溶液。试回答以下问题。
(1)做酸碱中和滴定时,还缺少的试剂是 。
(2)配制250mL0.1mol/L溶液时,还缺少的仪器是 。
(3)过滤时,应选用上述仪器中的 (填编号)。
14.某学生中和滴定实验的过程如下:
①取一支碱式滴定管,②用蒸馏水洗净,③加入待测NaOH溶液,④记录液面刻度的读数,⑤用酸式滴定管精确放出一定量标准酸液,⑥置于用标准酸液洗涤过的锥形瓶中,⑦加入蒸馏水,⑧加入2滴酚酞试剂,⑨开始滴定,先慢后快,边滴边摇荡,⑩边注视滴定管液面变化,⑾小心滴到溶液由无色变为红色时,即停止滴定。⑿记录液面读数,⒀重复滴定,根据两次读数得出NaOH的体积21ml。
上述学生操作错误的有
15.(1)图Ⅰ表示10mL量筒中液面的位置,A与B,B与C刻度
相差1mL,如果A为6,量筒中液体的体积是 mL。
(2)图Ⅱ表示50mL滴定管中液面的位置,如果液面处的读数是a,
则滴定管中液体的体积(填代号) 。 Ⅰ Ⅱ
A、是amL B、是(50-a)mL C、一定大于a D、一定大于(50-a)mL
(3)若图Ⅰ表示50mL滴定管中液面位置,A与C刻度间相差1mL,如果刻度A为6,则液面读数 mL。
16、用标准盐酸滴定未知浓度的氨水时,锥形瓶中通常盛放 和 指示剂.
滴定时左手 ,右手 ,双眼注视 ;当 指示剂颜色由 变 且 时达到滴定终点。
17. 某学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(A)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)______________________.
(2)上述(B)操作的目的是___________________________________。
(3)上述(A)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是(填偏大、偏小、不变,)_________________________。
(4)实验中用左手控制_________(填仪器及部位),眼睛注视_______,直至滴定终点。判断到达终点的现象是___________。
15、5.8, D , 6.08
2
17(1)BDCEAF
(2)防止将标准液稀释
(3)偏大
(4)滴定管活塞;锥形瓶中溶液的颜色变化;锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色。
3
-
酸碱中和滴定实验报告
酸碱中和滴定实验报告酸碱中和滴定实验报告时间组别第组指导教师组长组员一实验目的用已知浓度溶液标准溶液本实验盐酸为标准溶液测定未知溶…
-
酸碱中和滴定 实验报告
实验名称酸碱中和滴定时间实验分组桌号合作者指导老师一实验目的用已知浓度溶液标准溶液本实验盐酸为标准溶液测定未知溶液待测溶液浓度本实…
-
酸碱滴定实验报告
氢氧化钠溶液的标定及盐酸溶液对氢氧化钠溶液的滴定一实验目的1培养同学们通过实验手段用已知测未知的实验思想2学习相关仪器的使用方法掌…
-
酸碱中和滴定实验报告[1]
NaOH滴定HAc的实验报告一实验目的测量未知溶液的浓度二实验原理三实验仪器和药品酸式滴定管碱式滴定管锥形瓶铁架台滴定管夹NaOH…
-
酸碱中和滴定实验报告
酸碱中和滴定实验一所用仪器酸式滴定管碱式滴定管和锥形瓶1酸式滴定管和碱式滴定管的构造对比不同点及其原因2对比滴定管和量筒刻度的不同…
-
大学化学实验 滴定分析基本操作 酸碱浓度的比较 实验报告
滴定分析基本操作及酸碱浓度的比较实验报告实验目的就不写出来了大家肯定都有一实验原理1酸碱指示剂有其变色范围pH甲基橙的变色范围是3…
-
酸碱中和滴定实验报告
酸碱中和滴定实验报告酸碱中和滴定实验报告时间组别第组指导教师组长组员一实验目的用已知浓度溶液标准溶液本实验盐酸为标准溶液测定未知溶…
-
酸碱滴定实验报告
氢氧化钠溶液的标定及盐酸溶液对氢氧化钠溶液的滴定一实验目的1培养同学们通过实验手段用已知测未知的实验思想2学习相关仪器的使用方法掌…
-
酸碱中和滴定 实验报告
实验名称酸碱中和滴定时间实验分组桌号合作者指导老师一实验目的用已知浓度溶液标准溶液本实验盐酸为标准溶液测定未知溶液待测溶液浓度本实…
-
酸碱中和滴定实验预习报告
酸碱中和滴定和溶液配制实验预习报告实验原理c标V标c待V待实验目的1通过中和滴定实验掌握中和滴定实验操作方法2通过中和滴定实验理解…
-
分析化学实验 碱度的测定 实验报告
实验报告姓名班级同组人项目碱度的测定课程分析化学学号一实验目的1掌握酸碱滴定法测定碱度的原理和方法2掌握碱度测定结果的计算3熟练滴…