骨髓活检在常见血液病诊断中的意义
骨髓活检在常见血液病诊断中的意义
单位:
摘要: 本文介绍了骨髓活检在常见血液病诊断中的作用,尤其是在全血减少性疾病的诊断与鉴别中的意义,把全血减少疾病
分为骨髓不增生性全血减少与骨髓增生性全血减少两大类,对全血减少疾病的病理发生机制作了简介,并介绍了红系
细胞增生性贫血与骨髓不增生性贫血(如再生障碍性贫血),除原发性血小板增多症外,本文主要对急性髓系白血病,
急性淋巴细胞白血病,慢性淋巴细胞白血病及毛细胞白血病的定义,临床表现,细胞化学,免疫表型,细胞遗传学,
骨髓病理组织学及鉴别诊断要点作了介绍。
` 关键词: 骨髓活检 骨髓病理学 全血细胞减少 急性髓系白血病
一、全血细胞减少疾病 全血细胞减少(pancytopenia)是一种常见的血液病表现,不是独立性疾病。因为很多血液病均可表现为全血细胞减少,即血红蛋白(Hb),白细胞(WBC),血小板(Plt)均低于正常值。根据全血细胞减少病因不同将其分为骨髓不增生性全血细胞减少和骨髓增生性全血细胞减少两大类。
全血细胞减少或某一系血细胞减少一般至少有四方面的原因:
①“土地里不长苗”,“土地”比如骨髓造血微环境,“种子”比如造血干细胞,这两方面的一方或两方出问题,造血细胞均不能正常生长,出现再生障碍性贫血,或纯红细胞性再生障碍贫血;
②“光长苗不结果”,比如生长的造血细胞均是幼稚的,不能分化成熟,外周血是贫血的,如 MDS等;
③结的果不成熟,由于“肥料”不足,仅有少量成熟或果实不饱满,类似巨幼细胞贫血因缺叶酸或/和维生素B12,缺铁性贫血因缺铁; ④成熟的果实被破坏了,如溶血性贫血及失血。为了寻找贫血原因,往往需要做多种血液学检查才能最后确诊,首选检查项目就是BMA和BMB,即从“根”上找原因。BMB 对明确全血减少原因至关重要。
1.骨髓不增生性全血细胞减少:主要是再生障碍性贫血(AA),患者呈贫血貌,外周血血红蛋白(或红细胞),白细胞及血小板明显减少,外周血网织红细胞<1%。骨髓造血组织增生极度减低或较低下,脂肪细胞增生或不增生,骨小梁间一片荒凉,不见巨核细胞,淋巴细胞,浆细胞或肥大细胞相对增多。(图1)
脂肪细胞不增生
造血细胞缺乏,无巨核细胞。塑料包埋切片,H-Giemsa-E 染色 100× 图1 急性再生障碍性贫血 骨髓增生极度低下,间质水肿,
2.骨髓增生性全血细胞减少:
骨髓三系细胞增生性全血细胞减少疾病中有的可能是由于骨髓细胞分化成熟障碍,无效造血所致,如骨髓增生异常综合征(MDS),白血病等;有的是由于血细胞成熟障碍所致,如营养性贫血,或骨髓转移瘤、骨髓肉芽肿、骨髓纤维化及骨髓硬化症等骨髓造血功能衰竭;有的则是由于血细胞破坏过多所致如:脾功能亢进,自身免疫性溶血性贫血(红细胞溶血破坏),特发性血小板减少性紫癜(ITP)(血小板被破坏)等。
笔者统计本院2001~20xx年的5025例BMB中,伴有全血减少表现的病例649例(13%),经BMB及其相关检查最终确诊结果排在前8位的病种(表1),最常见为AA(241例,37%),其次为MDS(69例,11%),再次为急性髓细胞白血病(40例,6%)。全血细胞减少疾病仅仅根据BMA是不易明确诊断的。必须同时做 BMB 及其它相关检查(包括免疫组化,流式细胞术免疫分型,染色体,血清免疫电泳,叶酸、维生素 B12 检测等)才能够使绝大部分全血细胞减少的患者明确诊断。
红细胞疾病根据骨髓增生程度可分为 骨髓红系增生性 与 骨髓红系不增生性 两大类,根据患者外周血红细胞多少可分为红细胞增多(多血)疾病与红细胞减少(贫血)疾病两大类。
果 表1 694例全血细胞减少最终确诊结
(1)骨髓红系增生性疾病:骨髓红系细胞增多,外周血红细胞也增多为 有效增生或有效造血 ,如真性红细胞增多症和其他骨髓增殖性疾病;如骨髓红系细胞增多,外周血红细胞不增多反而减少称 无效增生或无效造血 。其原因主要有三种:
①红系细胞分化、成熟障碍而停留在成熟前状态,无成熟细胞向外周血释放,往往是肿瘤性的增生,此种情况为无效造血,如 MDS-RA 或 RAS ,红白血病等。
②营养缺乏:如缺铁性贫血血红蛋白合成减少(红细胞数量可不减少),又称小细胞性贫血;叶酸和/或维生素B12缺乏导致核分裂所需的合成核酸的原料(物质)缺乏,幼稚红细胞停留在分裂前状态而出现巨幼细胞性贫血。
③成熟后的红细胞破坏过多或失血,主要包括各种溶血性贫血及内、外出血。
(2)骨髓红系不增生性疾病包括:
①单纯红系不增生,即纯红细胞再生障碍性贫血;
②红粒两系或红巨核两系不增生称“早期再生障 碍 性贫血”;
③粒、红、巨核三系不增生即为再生障碍性贫血。
上述骨髓不增生疾病或全血细胞减少性疾病做BMB是首选的检查项目,仅做BMA的诊断结果是不准确的。有关 红系增生性疾病及不增生性疾病的骨髓活检组织学特点详见有关资料。
粒系细胞减少性疾病及巨核细胞(血小板)减少疾病(略)。
二、骨髓增生异常综合征(MDS)
MDS是一组一系以上髓细胞系增生异常(又称病态造血)和无效造血为特征的克隆性造血干细胞疾病。
(一)临床与病理特征(表2)
ning RD et al) 表2 20xx年WHO骨髓增生异常综合征WHO分型标准(2001,Brun
1.RA和RARS:主要是红系细胞正色素正细胞或正色素巨幼细胞贫血,白细胞、血小板正常。病态造血限于红系:包括红系前体细胞核发芽、分叶,核间桥,核崩解,多核及巨幼样变。胞浆空泡及 PAS弥漫或颗粒状阳性。有核红细胞中铁粒幼细胞<15%为RA,>15%为RARS,两者骨髓原始细胞均<5%,外周血<1%。
骨髓病理组织学:增生极度活跃,也可增生正常或低下。以红系细胞增生为主,由于石蜡切片观察红系病态造血不理想,不能观察铁粒幼颗粒,故BMB仅可排除一些疾病,而主要根据外周血和MBA分类、铁染色、PAS染色和染色体检查等诊断RA、RARS。
2.RCMD和RCMD-RS:是指骨髓两系或三系病态造血髓细胞占10%以上,原始细胞比例与RA一致, 单核细胞<1×109/L,与RA一样无Auer小体。除RA的红系病态造血表现以外,中性粒细胞胞浆颗粒过少,核分叶过少(假Pelger-Huet细胞或“眼镜核细胞”),多核及巨幼样变。原始粒细胞<5%,环形铁粒幼细胞<15%,如>15%应诊断RCMD-RS。
骨髓病理组织学:增生程度与RA类似,细胞成分以粒系增生更活跃,中幼以上阶段粒细胞比例增多,可见前体细胞异常定位(ALIP)现象,可见巨核细胞胞体小,分叶少,常见单个圆核巨核细胞是BMB诊断本病的最重要线索。 3.RAEB:RAEB是在RCMD的病理改变基础上骨髓原始细胞(5%~19%)和外周血原始细胞(5%~19%)进一步增多,各系病态造血的形态改变与RCMD无显著差异,只是数量更多,WHO分类将其分为RAEB1与RAEB2。
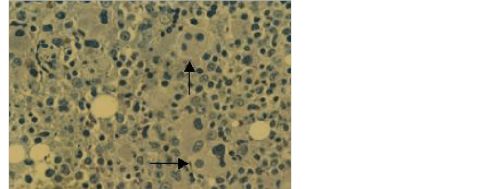
骨髓病理组织学:大部分病例增生极度活跃,少部分增生正常或较低下(10~15%),中幼以上阶段粒细胞比例增多,前体细胞异常定位(ALIP)现象和小单圆核巨核细胞比RA更常见(图2)。低增生性MDS(增生程度≤20%) 应与再生障碍性贫血或低增生白血病鉴别。
4.MDS伴5q-染色体异常综合征:主要见于中老年妇女,但不是绝对的,表现为严重的难治性巨幼细胞性贫血,白细胞轻微减少,血小板正常,偶尔显著升高。外周血偶见原始细胞,<5%,骨髓原始细胞<5%。
图 3-2 骨髓增生异常综合征 骨髓增生极度活跃,幼稚粒细胞易见,
可见单圆核及三圆核巨核细胞。塑料包埋切片, H-Giemsa-E 染色 200×
骨髓病理组织学:增生极度活跃或增生正常,粒红比例常减低,巨核细胞数量正常或增多,胞体小,核分叶少,以单个圆核巨核细胞为主是其特征。红系前体细胞不同程度增生异常,常见散在分布的小淋巴细胞簇。必须做染色体检查确诊。
部分病例染色体(非特异性)异常,如单纯5q-、20q-、7q-、5号单体、7号单体、8号3体、-5、-7、+8等。
国内尚未见大系列WHO新分类的MDS骨髓活检病理组织学研究的报告。
(二)MDS骨髓活检诊断要点:
1.骨髓增生活跃、明显活跃或极度活跃,少数增生减低(约17%)。造血细胞可以红系细胞增生为主或粒、红细胞比例减低(多见于MDS-RA或RARS),粒、红比例正常(多见于RAEB1)或者粒、红比例增高(易见于RAEB-2型)。
2.中幼以上阶段粒系细胞比例增多,形态与分布有异常。
3.骨髓增生异常(病态造血):
(1)粒系细胞增生异常:粒系幼稚细胞巨幼样变(核“幼”浆“老”)、双核粒细胞、或假 Pelger-Heut 核异常。约40%~70%可见幼稚细胞异常定位(ALIP)现象,RAEB较RA(或RARS)多见。(图3,4)
1000× 图3 骨髓增生异常综合征(RAEB1) 可见幼稚的双核粒细胞,方法同前,
1000× 图4 骨髓增生异常综合征(RAEB2)图中央可见ALIP现象,方法同前,
(2)红系增生异常:幼稚红系细胞巨幼样变、核发芽、核间桥、或三核红细胞,有的可见同一阶段幼稚红系细胞成片分布(“热点”现象)。(图5)粒、红系凋亡细胞增多。
(3)巨核细胞胞体偏小,核分叶过少,易见不同大小的单圆核巨核细胞(约 90%)(图6),有的可见淋巴样小巨核细胞(约40%,需CD41,CD61
单克隆抗体免疫组化染色识别)。
EB2) 红系细胞“热点” 现象,
红系原始细胞岛中不含其他阶段红系细胞。方法同前 400× 图 3-5 骨髓增生异常综合征(RA
核圆,
核膜光滑无切迹或凹陷,不见核仁。方法同前 200× 图 3-6 骨髓增生异常综合征(RCMD) 示单圆核巨核细胞,
4.间质变化:少数病例伴有淋巴细胞、浆细胞及含铁血黄素沉积。部分病例网状纤维增多(++~+++)或有胶原纤维增生,MDS伴骨髓纤维化相当于19xx年WHO髓系肿瘤分类中的“急性全髓增殖伴骨髓纤维化”(过去称“骨髓增生异常/骨髓纤维化综合征”、“急性骨髓纤维化”)。
5.凋亡细胞增多:凋亡细胞胞核染色质凝集呈各种形态:①环形,②间断环行,③古钱币形,④口型,⑤内切三角形,⑥固缩球形,⑦核碎片形。良性血液病骨髓中凋亡细胞十分罕见。
(三)病理鉴别诊断:
与溶血性贫血、巨幼细胞性贫血、慢性粒单细胞白血病、急性髓细胞白血病-M6型、慢性再生障碍性贫血及原发性骨髓纤维化等鉴别。根据20xx年WHO骨髓增生异常综合征分型标准,骨髓活检不能独立诊断MDS。
三、原发性血小板增多症(ET)
ET是一种累及巨核细胞的克隆性慢性骨髓增殖性疾病,其特征是血小板持续性增多及骨髓巨核细胞增多,30岁发病,以女性多见,50~60岁为高峰。初诊时20~50%有血管栓塞或出血症状,可伴肝大(15~20%)、中度脾大(50%)及血栓形成引起的症状和体征。持续性血小板计数≥600×109/L,WBC<30×109/L,Hb正常或减低,骨髓巨核细胞增多、胞体大、胞浆丰富,可见含其他血细胞的共生现象(emperipolesis),无原始细胞增多及病态造血。
BMB示增生较活跃或极度活跃,偶见增生减低。粒、红系细胞及各阶段比例大致正常。巨核细胞显著增多(2),成群(簇)或散在分布,胞体是所有血液病骨髓巨核细胞中平均切面面积最大的,核分叶很多(图7)。以此可与其他骨髓增殖性疾病及反应性血小板增多相鉴别。嗜酸性细胞常较多,40~70%铁染色阳性,本病可有轻度网状纤维增生,除非晚期ET患者,初诊时不见胶原纤维增生,否则不支持本病。本病脾髓外造血不明显,无特征性染色体异常。不能切脾治疗,中位存活10~15年,5%转化为MDS或AML。有的先发展为骨髓纤维化,后转化为急性白血病。
图7 原发性血小板增多症 骨髓增生极度活跃,粒红系细胞比例及各系各阶段细胞比例大致正常,巨核细胞明显增多,胞体巨大,核分叶较多。方法同前 400×
病理鉴别诊断:与真性红细胞增多症、慢性粒细胞白血病 -巨核细胞增多型、原发性骨髓纤维化-细胞期、继发性血小板增多鉴别。
慢性原(特)发性骨髓纤维化(CIMF)见另文。
四、急性髓性系白血病(AML)
20xx年版WHO急性白血病分型根据形态学、免疫表型、遗传学和临床表现相结合以界定生物学行为相似且临床表现相关的疾病实体种类。 急性髓系白血病(AML)分为四大类:①AML伴重现性细胞遗传学异常、②AML伴多系增生异常、③治疗相关AML和MDS、④AML非特殊型(表3-3)。由于国内开展分子生物学及细胞遗传学不太广泛,本文仅对髓系及部分淋系白血病骨髓形态学、细胞化学、免疫表型及骨髓组织学特
征进行介绍。
(一)急性髓细胞白血病(AML-M0) 表3 急性髓系白血病分类(Brunning R D et al 2001)
是指没有形态学、光镜细胞化学的髓系分化表现的AML。约占AML的5%(1),大部分为成人。
1.临床表现为严重的贫血、血小板减少和中性粒细胞减少的症状和体征。白细胞增多伴原始细胞显著增多,骨髓幼稚细胞中等大小,胞浆很少,嗜碱性,无颗粒,核圆、椭圆或稍不规则,染色质细致、弥散,1~2个核仁,少数胞体小,核染色质稍致密,核仁不明显,无Auer小体。
2.细胞化学:POX、SBB、CE均阴性,CE<3%。
3.免疫表型:幼稚细胞表达一种或多种髓系抗原(1,4):CD13+、CD33+、CD117+及对B、T限制性抗体阴性的cCD3+、cCD79a+、cCD22+。少数幼稚细胞抗MPO可阳性。CD34+、CD38+、HLA-DR+、TdT+(1/3以上病例),CD7. CD2.CD19可弱阳性。
4.细胞遗传学:无重现性染色体异常。
5.骨髓病理组织学:骨髓增生极度活跃,分化不良的幼稚细胞单一性增生,光镜下不能区别髓系与淋系细胞,可识别的粒、红系及巨核系细胞缺乏(图8)。透射电镜下MPO染色在内浆网、Golgi区和/或核膜有细小阳性颗粒。
6.鉴别诊断:主要根据免疫表型与急性淋巴细胞白血病、急性巨核细胞白血病、双表型/混合型急性白血病及大细胞淋巴瘤白血病鉴别。
(二)急性髓细胞白血病,未成熟型(AML-M1)
指原始粒细胞≥90%,MPO+和SBB+原始细胞>3%和/或有Auer小体的AML(1)。
1.临床表现与 AML-M0 基本一致。骨髓涂片均为原始粒细胞,无成熟粒细胞,有的可见嗜天青颗粒和/或明确的Auer小体。有的类似淋巴细胞无嗜天青颗粒。
2.细胞化学示MPO+、SBB+的原始细胞≥ 3% 。
3.免疫表型:CD13+、CD33+、CD117+和/或MPO+、CD34+,CD11b-、CD14-(1,2)。
4.细胞遗传学:无重现性染色体异常。
5.骨髓病理组织学:骨髓增生极度活跃,有的增生程度正常或较低下。绝大多数为原始粒细胞,偶见早幼粒细胞。红系及巨核系细胞极少或缺乏(图9)(2)。
6.鉴别诊断:主要根据免疫表型与急性淋巴细胞白血病、急性粒单核细胞白血病、双表型/混合型急性白血病鉴别。
单一性增生。 图8 急性髓细胞白血病(M0)骨髓增生极度活跃,原始细胞
基本不见可识别的其他阶段或其他系造血细胞。塑料包埋切片, H-Giemsa-E 染色, 400×
图9 急性髓细胞白血病(M1)骨髓增生极度活跃,主要为原始粒
细胞,偶见早幼粒细胞,
散在数个晚幼红细胞,未见巨核细胞。塑料包埋切片, H-Giemsa-E 染色, 200×
(三)AML伴成熟型(AML-M2a)
指骨髓或外周血原始粒细胞≥20% ,不同成熟阶段的中性粒细胞≥10% ,骨髓单核细胞<20%的AML。与FAB分型中ANLL-M2b为同义名。
1.临床表现:常有贫血、血小板减少和中性粒细胞减少的表现。白细胞计数及原始细胞数多少不定。骨髓涂片原始粒细胞≥20%~90%(非红系细胞),早幼、中幼及晚幼粒细胞≥10% ,单核细胞<20%,Auer小体常见。
2.细胞化学:MPO+、SBB+、CE+(1,2)。
3.免疫表型:CD13+、CD33+、CD15+、还可CD117+、CD34+、HLA-DR+。(以上AML-M0、M1.M2均未见特征性或重现性染色体异常) 。
4.细胞遗传学:无重现性染色体异常。
5.骨髓病理组织学:骨髓增生极度活跃。绝大多数为原始粒细胞,易见早幼、中幼及晚幼粒细胞。红系及巨核系细胞很少或缺乏(图10)。
6.鉴别诊断:主要根据细胞化学和免疫表型与ALL、急性粒单核细胞白血病(AMML)、急性早幼粒细胞白血病(APL)伴t(15;17)鉴别 。
(四)急性髓细胞白血病伴t(8;21)(p22;q22)或AML-M2b
本病是指伴有t(8;21)(p22;q22);AML1(CBFa)/ETO的AML相当于FAB分型中的ANLL-M2b型或过去国内称亚急性粒细胞白血病。约占AML的5%~12%。对规范性化疗疗效好,缓解率高,生存期长。
1.临床表现:主要见于较年轻的患者,初诊时有的可伴有粒细胞肉瘤,此时,即使骨髓涂片原始粒细胞少于20%,也应诊断AML。外周血可见较大或较小的原始粒细胞,骨髓穿刺原始粒细胞及早幼粒细胞明显增多,以异常的中性中幼粒细胞增生为主,核仁明显,有明显的核浆发育不平行,此类细胞>30%。早幼、中幼及晚幼粒细胞不同程度病态造血,有的胞浆颗粒巨大(假Chediak-Higashi颗粒),中性粒细胞异常核分叶(核分叶过少及假Pelger-Huet核)和/或颗粒过少,Auer小体常见,前体嗜酸性细胞增多,红系及巨核细胞系形态正常。
2.细胞化学:有两种类型:一种POX+,SBB+,CE+胞浆内呈弥漫分布,另一种阳性物质主要在核旁凹陷处呈块状阳性,提示为较早期粒细胞。
3.免疫表型:免疫表型与AML-M2a一致。
4.遗传学:t(8;21)(p22;q22);AML1(CBFa)/ETO。
5.骨髓病理组织学:骨髓增生极度活跃,有的增生程度正常。原始粒细胞较AML-M2少见,易见早幼、中幼及晚幼粒细胞核浆发育不平行,常见粗大的杆状核粒细胞有大核仁(图11),红系及巨核系细胞易见。
6.鉴别诊断:主要根据细胞形态学,遗传学与细胞形态学与AML-M2.AML-M3.AML-M4.MDS、类白血病反应等鉴别。
主要为原始粒细胞,散在较多早幼粒细胞,
不见偏成熟粒细胞,未见巨核细胞。塑料包埋切片,H-Giemsa-E染色, 200× 图10 急性髓细胞白血病(M2/M2a)骨髓增生极度活跃,
图11 急性髓细胞白血病伴t(8;21)(q22;q22)或AMLM2b。骨髓增生极度活跃,原始细胞少,易见早幼、中幼及晚幼粒细胞核浆发育不平行,常见粗大的杆状核粒细胞有大核仁。塑料包埋切片,H-Giemsa-E染色,200×
五)急性髓细胞白血病伴t(15;17)(p22;q12)
又名早幼粒细胞白血病(APL)或AML-M3,占AML的5%~8%。
1.临床表现:见于任何年龄,以成人多见。常有播散性血管内凝血(DIC)。骨髓穿刺以颗粒增多的异常早幼粒细胞增生为主(>20%),大多数可见Auer小体。根据胞浆颗粒大小不等分为粗颗粒与细颗粒两种形态类型(1)。白血病细胞具有维甲酸受体,用维甲酸治疗可诱导白血病细胞分化成熟而完全缓解或治愈。
2.细胞化学:MPO+、SBB+、CE+、NAE+及NSE弱阳性(25%的病例)。
3.免疫表型:CD33+、CD13+/-、CD15-/+、CD34-、CD2+、CD9+。
4.遗传学:t(15;17)(p22;q11-22);(PML/RARa)
5.骨髓病理组织学:骨髓增生极度活跃,异常的早幼粒细胞较单一性增生,胞浆丰富,充满嗜中性颗粒,制片良好时可见Auer小体。胞核呈圆形、椭圆形或不规则形。核仁小或不明显,红系及巨核细胞极少或缺乏,常有过目不忘的感觉(图12)。
6.鉴别诊断:主要与AML-M2型鉴别,制片不良时应与非霍奇金淋巴瘤、浆细胞性骨髓瘤鉴别。细胞遗传学或分子生物学检测有确诊意义。
(六)急性粒单核细胞白血病(AML-M4)
急性粒单核细胞白血病(acute myelomonocytic leukemia,AMML)与FAB分型ANLL-M4为同义名,占AML的 15-25% ,有的有慢性粒-单核细胞白血病病史(1)。
1.临床表现:各年龄均发病,平均发病年龄50岁,男:女为1.4:1。外周血Hb、Plt减少,WBC增高,大量幼稚粒单核细胞。
骨髓象:有3种亚型:M4a:原始和早幼粒细胞。增生为主,原、幼单和单核细胞≥20%(非红系细胞); M4b:原、幼和单核细胞增生为主,原始和早幼粒细胞≥20%(非红系细胞); M4c:原始细胞既有粒细胞系、又具有单核细胞系形态特征者≥20%(非红系细胞)。
2.细胞化学:至少3%的原始粒细胞MPO+、SBB+、CE+,原单、幼单及单核细胞NSE+,NSE和萘酚ASD氯醋酸酯酶或MPO双染色可见两类细胞阳性。如形态符合单核细胞,NSE+也不能排除诊断。NAE+NaF可抑制反应。
3.免疫表型:幼稚粒系细胞表达CD13+、CD33+/CD34+、单核系细胞表达CD14+、CD4+、CD64+、CD36+、CD11b+、CD11c+及lysozyme+。
4.细胞遗传学:无重现性染色体异常。
5.骨髓病理组织学:骨髓增生极度活跃,主要为不同比例的幼稚粒 - 单核系细胞增生,原始单核细胞普通染色光镜下不易识别,幼稚及成熟
单核细胞胞浆丰富、无颗粒,核圆、椭圆、或呈肾形。核染色质细致,核仁明显(图13)。红系及巨核细胞少见,塑料切片,H-Giemsa-E染色不难识别(2)。
6.鉴别诊断:骨髓组织学主要与AML-M2、AML-M5、非霍奇金淋巴瘤鉴别。
骨髓增生极度活跃,
异常的早幼粒细胞较单一性增生,胞浆丰富,充满嗜中性颗粒。
胞核呈圆形、椭圆形或不规则形。核仁小或不明显。红系及巨核细胞极少。
塑料包埋切片,H-Giemsa-E染色,200× 图12 急性髓细胞白血病(M3)或AML伴t(15;17)(q22;q12)
不同比例的幼稚粒-单核系细胞增生。
塑料包埋切片,H-Giemsa-E 染色,200×
(七)急性髓细胞白血病伴inv(16)(p13;q22)或t(16;16)(p13;q22);(CBFβ/MYH11) 图13 急性髓细胞白血病(M4)骨髓增生极度活跃,主要为
是指骨髓粒系与单核细胞系增生伴有异常嗜酸细胞增多。伴有异常嗜酸细胞的急性粒-单核细胞白血病,称之为AMMLEO。与FAB分型中的AML-M4EO为同义名。约占AML的10%-12%。
1.临床表现:初诊或复发时可有粒细胞肉瘤,成为有的患者复发的原因。
实验室检查:血象:与其他急性粒单核细胞白血病类似,可伴有异常嗜酸细胞。骨髓象:除具有急性粒单核细胞白血病特点外,还有早幼以下阶段的嗜酸细胞>5%(非红系细胞),这些嗜酸细胞核分叶少,胞浆除粗大而圆的嗜酸颗粒外,还有嗜碱颗粒细胞。幼稚粒细胞有Auer小体。偶尔,AMML伴inv(16)(p13;q22)还见于无嗜酸细胞增多,仅有粒系而无单核细胞,或仅有单核细胞的病例。少数病例原始细胞刚够20%或低于20%,只要有此遗传学异常就应明确诊断。
2.细胞化学:上述异常嗜酸细胞萘酚ASD氯乙酸酯酶阳性,[正常和AML伴t(8;21)的嗜酸细胞阴性]。原始粒细胞MPO+(3%以上),原单及幼单核细胞NSE+。
3.免疫表型:除幼稚粒系细胞CD13+、CD33+及MPO+外,单核系细胞CD14+、CD4+、CD11b+、CD11c+、CD64+、CD36+和Lysozyme+。AMML伴inv(16)还与T细胞标记CD2共表达。
4.遗传学:inv(16)和t(16;16)(p13;q22)均导致在16q22位点的CBF β基因与16p13位点的平滑肌浆蛋白重链MYH11基因融合形成CBF β/MYH11融合基因。通过FISH或RT-PCR技术可以检测到。
5.骨髓病理组织学:骨髓增生极度活跃或增生正常,嗜酸细胞较多见(图14),易见圆核的嗜酸细胞。其他与急性粒单核细胞白血病一致。
6.鉴别诊断:骨髓活检病理形态鉴别同AML-4型。
(八)急性原始单核细胞白血病和急性单核细胞白血病(AMbL和AmoL)(AML-M5a和M5b)
急性原始单核细胞白血病和急性单核细胞白血病(acute monoblastic leukemia and monocytic leukemia,AMbL和AMoL)与FAB分型中的ANLL-M5a和M5b为同义语。AMbL占AML的5%-8%,AMoL占AML的3%-6%。
1.临床表现:(1)AMbL各年龄均可发病,最常见于年轻人。在婴幼儿常伴有11q23异常,常有髓外浸润或肿块(1)。骨髓象:M5a:骨髓非红系细胞中原始单核细胞≥80%。
(2)AMoL多见于成人。平均年龄49岁。二者出血最常见,髓外肿块和皮肤、牙龈浸润和中枢神经受累较常见。贫血和血小板减少,白细胞增高或不增高,有原始单核细胞和前(幼)单核细胞。M5b:骨髓非红系细胞中原始单核细胞<80%。其余大多数为前(幼)单核细胞。中性粒细胞<20%。伴有吞噬现象。
2.细胞化学:NAE+、NAE+NaF受抑制,ANAE+、ACP+、PAS+、Lysozyme+。
3.免疫表型:单核系抗原CD14、CD4、CD11b、CD11c、CD64、CD68、CD36,Lysozyme阳性。粒系标记CD13、CD33、CD117阳性。
4.细胞遗传学:无重现性染色体异常。
5.骨髓增生极度活跃,也可较低下(低增生性白血病中此型最多见)。AMbL主要为胞核呈圆形的原始单核细胞单一性增生,胞核呈肾形的单核细胞可见,胞浆不见颗粒(图15)。AMoL主要为胞核呈肾形,胎儿样,生姜样等多形性,胞浆丰富无颗粒的单核细胞单一性增生,有的酷似裂核淋巴细胞(图16),石蜡切片与裂核细胞型(中心细胞)淋巴瘤难以鉴别。粒、红系及巨核细胞极少或缺乏。偶见吞噬红细胞现象。
6.骨髓病理组织学:主要与急性淋巴细胞白血病、B-细胞淋巴瘤(中心细胞型)、AML-M0/M1型、AML-M4型鉴别。
2)
或t(16;16)(p13;q22)骨髓增生极度活跃,
除幼稚的粒系细胞单核细胞外,有较多的嗜酸性粒细胞。 塑料包埋切片,H-Giemsa-E染色,200× 图14 急性髓细胞白血病(M4EO)或AML伴inv(16)(p13;q2
主要为胞核呈圆形的原始单核细胞单一性增生, 胞核呈肾形的单核细胞可见,胞浆不见颗粒。 塑料包埋切片,H-Giemsa-E 染色,200× 图15 急性原始单核细胞白血病(AML-M5a)
主要为胞核呈肾形,胎儿样, 生姜样等多形性,
胞浆丰富无颗粒的单核细胞单一性增生。
塑料包埋切片,H-Giemsa-E染色,200×
(九)AEL(AML-M6)
图16 急性单核细胞白血病(AML- M5b)
急性红白血病(acute erythroid leukemia,AEL)是以红系细胞增生为主的白血病,根据是否有显著粒系增生可分为红白血病(红系/粒系型)和纯红白血病(1)。同义名:FAB分型的AEL-M6a(红系/粒系),AEL-M6b(纯红白血病),红细胞过多性骨髓病(纯红系),纯红白血病罕见。
1.临床表现:红白血病(红系/粒系型)多见,主要为成人,占AML的5%-6%,显著正细胞性贫血,可以是原发性,也可由MDS(RAEB或RCMD伴有或不伴有RAS)转化而成。
2.骨髓象:红白血病(红系/粒系型):骨髓红系(各阶段前体)细胞≥50%,且伴有形态异常(巨幼样变、和/或双核或多核,胞浆空泡,大的多核幼红细胞),骨髓非红细胞系原粒细胞(或原始+幼稚单核细胞)Ⅰ+Ⅱ型≥20%;若血片中原粒细胞或原单核细胞>5% ,骨髓非红系细胞中原始粒细胞或原始+幼稚单核细胞>20%(1,5)。
3.细胞化学:既有粒系细胞特点的细胞,又有红系细胞特点的细胞(原红细胞PAS+等)。
4.免疫表型:有粒系细胞抗原表达和红系细胞抗原表达两类细胞。纯红白血病:红系细胞占骨髓细胞的80%以上。无明显原粒细胞成分。
5.细胞遗传学:无重现性染色体异常。
6.骨髓病理组织学:骨髓增生极度活跃,主要为原始、早幼、中幼红细胞增生,晚幼红细胞少见。原始及早幼粒细胞易见,较成熟的粒细胞及巨核细胞少见(图17),石蜡切片时很难与 巨幼细胞性贫血、原始细胞过多的难治性贫血(MDS-RAEB)鉴别 。
7.鉴别诊断:主要与原始细胞过多的难治性贫血,巨幼细胞性贫血,非霍奇金淋巴瘤,其他类型AML及ALL鉴别。
(十)急性巨核细胞白血病(AML-M7)
急性巨核细胞白血病(acute megakaryoblastic leukemia,AMeL)约占 AML 的3%~5%。
1.临床表现:多见于成人和儿童,常见肝、脾大,骨质破坏,成人男性可同时伴有生殖细胞肿瘤(1)。外周血有原始巨核细胞,Hb减少、血小板减少或增多,巨大血小板及中性粒细胞颗粒过少。
骨髓象:骨髓原始巨核细胞≥50%,胞体12-18μm,有的似原始淋巴细胞,胞浆少,嗜碱性,有伪足或突起,核圆或稍不规则,染色质细网状。1-3个核仁。小巨核细胞胞浆成熟,可有双核。
2.细胞化学:原始巨核细胞胞浆PAS+、ACP+、NSE点状阳性。
3.免疫表型:原始巨核细胞CD41+和/或CD61、CD42+(约1/4)、CD34+、CD36+、CD13-、CD33-、CD45-、HLA-DR-、MPO-。
4.细胞遗传学:无重现性染色体异常。
5.骨髓病理组织学:骨髓增生极度活跃,以淋巴样小巨核细胞及小单圆核巨核细胞增生为主,不见成熟巨核细胞,网状纤维增多,可伴胶原纤维增生,粒红系细胞极少或缺乏(图18);有的以小单圆核巨核细胞和中单圆核巨核细胞增生为主,大片状增生,可见胞体稍大的巨核细胞,网状纤维增生多伴胶原纤维增生(图19)。
透射电镜:巨核细胞核膜及内浆网血小板过氧化酶阳性(PPO+),免疫电镜:CD41+ 、CD61+。
6.鉴别诊断:主要与骨髓纤维化(部分病例)、慢性粒细胞白血病(巨核细胞增生型)、骨髓转移性非造血系小细胞肿瘤、骨髓转移癌、间变性大细胞淋巴瘤侵犯骨髓鉴别。
主要为原始、早幼、中幼红细胞增生,晚幼红细胞少见。
原始及早幼粒细胞易见,较成熟的粒细胞及巨核细胞少见。
塑料包埋切片, H-Giemsa-E 染色, 200× 图17 急性红白血病(AEL)骨髓增生极度活跃,
以淋巴样小巨核细胞及小单圆核巨核细胞增生为主, 图18 急性巨核细胞白血病(M7a)骨髓增生极度活跃,
不见成熟巨核细胞。塑料包埋切片,H-Giemsa-E染色,1000×
以小单圆核巨核细胞和中等大单圆核巨核细胞增生为主,
大片状增生,可见胞体稍大的巨核细胞。
塑料包埋切片,H-Giemsa-E染色,200×
(十一)APMMF 图19 急性巨核细胞白血病(M7b)
急性全髓增殖伴骨髓纤维化(acute panmyelosis with myelofibrosis,APMMF)为罕见的 AML 类型,与急性骨髓纤维化,急性骨髓硬化,急性骨髓增生异常伴骨髓纤维化为同义名。
1.临床表现:主要见于成人,亦见于儿童。既可原发,也可继发于烷化剂治疗和/或放疗后。临床表现虚弱,疲倦,严重全血减少。有或无脾大,病程进展快。显著全血减少,无或有轻微异形红细胞,有的有不同程度红细胞大小不等伴巨形及幼红细胞。偶见原始粒及粒系病态改变和不典型血小板。骨穿常失败。主要见原始粒细胞及以下阶段细胞(1) 。
2.细胞化学:粒系幼稚细胞MPO+、萘酚ASD氯醋酸酯酶(+)。
3.免疫表型:原始细胞CD13+、CD33+、CD117+及MPO+;幼稚巨核细胞CD41+、CD61+和Ⅷ因子抗原(+);红系标记血型糖蛋白A和血红蛋白A阳性。
4.细胞遗传学:无重现性染色体异常。
5.骨髓病理组织学:骨髓增生极度活跃,红系前体细胞、粒系、巨核三系增生活跃。幼稚细胞簇状及散在分布,幼稚红细胞簇突出,巨核细胞较多,不同大小的均可见,核分叶少(图20)。大多数网状纤维增生显著,胶原纤维增生不明显。
6.鉴别诊断:主要与AML伴MF、AMeL伴MF、慢性特发性骨髓纤维化(CIMF)、AML伴多系增生异常伴MF、骨髓转移瘤伴骨髓纤维化及骨髓取材人为挤压所致纤维化假象鉴别。
(十二)前体B-急性淋巴细胞白血病/淋巴母细胞性淋巴瘤
1.定义:
前体B-急性淋巴细胞白血病(Pre-B-ALL)与淋巴母细胞性淋巴瘤(Pre-B-LBL)是同一种淋巴细胞肿瘤疾病的不同期(stage)或相(phase)。Pre-B-ALL是指患者外周血及骨髓原始淋巴细胞(病理学称淋巴母细胞)达到白血病诊断标准(原始淋巴细胞占有核细胞的≥25%)(白血病期),即B-ALL。本病既可起初即为B-ALL,也可先有髓外Pre-B-LBL或称B-LBL(组织期),确诊时血象及骨髓象正常或虽有原始淋巴细胞累及但不够白血病诊断标准,即<25%,部分B-LBL确诊后一段时间(一般>2个月)才出现骨髓或/和外周血侵犯并且原始淋巴细胞达到B-ALL诊断标准(白血病期),即B-LBL/ALL。B-ALL 原发于骨髓,在髓外(淋巴结及结外)可伴有原始淋巴细胞肿块(往往是多个)或不伴有原始淋巴细胞肿块。B-LBL多原发于髓外(常见于淋巴结等),往往先有单个部位B-淋巴母细胞肿块,当进展为B-ALL后才出现多个淋巴母细胞肿块。
2.临床表现:
B-ALL除累及骨髓和外周血外,常累及淋巴结、脾、肝,生殖腺和中枢神经系统。常有淋巴结、脾和肝轻、中度增大。常见骨痛和关节神经痛,有不同程度贫血、血小板减少和中性粒细胞减少。 WBC 数减少、正常或显著增高。B- LBL最常累及淋巴结、皮肤、骨和软组织(常为单个部位)。纵隔肿块不常见。血象骨髓相正常或虽有血和骨髓原始淋巴细胞增多,但<25%。
3.细胞化学:原始淋巴(母)细胞PAS+,核周呈珠状阳性颗粒,SBB呈浅灰色颗粒POX-,NSE多点状或高尔基区阳性,氟化钠可不同程度抑制。
4.免疫表型:
淋巴母细胞表达TdT+,HLA-DR+,CD19+,CD79a+,大多数ALLCD10+和CD24+,但伴t(4;11)(q21;q23)的ALL CD10-,CD24-。不同程度表达CD22(cCD22系特异性标记)和CD20,CD45可阴性。部分病例伴有髓系标记CD33+,CD13+,但不影响B-ALL的诊断。分期:早期前B-ALL或前前B-ALL:CD19+,cD79a+,cCD22+,TdT+;中期B-ALL:CD10+(又称普通型B-ALL);成熟前体B-ALL(Pre-B-ALL):表达Cyμ链,Sμ链阴性。
5.遗传学:染色体异常有t(9;22)(q34;q11.2),t(4;11)(q21;q23),t(1;19)(q23;q13.3),t,12;21)(q13;q22)。高二倍体>50, B-ALL IgH 基因重排 PCR 检测阳性。
6.骨髓病理组织学:B-ALL 骨髓增生极度活跃,原始淋巴(母)细胞较单一性增生,胞体中等大小,胞浆少,淡嗜碱性。细胞核圆形或稍不规则,染色质细,核仁小或不明显。粒、红、巨核系细胞极少或缺乏。
7.鉴别诊断:
B-LBL骨髓增生程度正常,粒红系细胞比例及各阶段比例大致正常,不见淋巴细胞增多。如有淋巴母细胞呈散在或小灶性分布,根据血象、骨髓象、免疫组化、IgH 及TCR基因重排,排除反应性淋巴细胞增生后,诊断淋巴母细胞性淋巴瘤侵犯骨髓。病理组织学鉴别主要与慢性淋巴细胞白血病,幼淋巴细胞白血病,其他非霍奇金淋巴瘤侵犯骨髓相区别。
前体细胞、粒系、巨核三系增生活跃,
胶原纤维增生不明显。塑料包埋切片,H-Giemsa-E染色,100× 图20 急性全髓增殖伴骨髓纤维化 骨髓增生极度活跃, 红系
骨髓增生极度活跃,
原始淋巴(母)细胞较单一性增生,胞体中等大小,胞浆少,淡嗜碱性。 图21 前体B-急性淋巴细胞白血病/淋巴母细胞性淋巴瘤
细胞核圆形或稍不规则,染色质细,核仁小或不明显。塑料包埋切片,H-Giemsa-E染色,200×
(十三)B-幼淋巴细胞白血病(PLL)
本病主要累及外周血、骨髓和脾脏。很罕见,约占淋巴细胞白血病的 1% 。
1.临床表现:
男性多见,大多数在60岁以上(中位年龄70岁)。大多数患者有显著脾大而淋巴结不大。外周血白细胞增多,通常>100×109/L,其中幼淋细胞>55%。幼淋细胞胞体中等大,胞浆嗜碱,核圆,核仁清楚,核染色质浓密,核浆比例低。50%有贫血和血小板减少,部分病例血清有M成分。有的由套细胞淋巴瘤扩散至血液和骨髓形成。
2.细胞化学:Fulgen染色核仁阳性(>50%),胞浆PAS+、ACP+、TRAP-、POX-、SBB-、ANAE-。
3.免疫表型:B-PLL:SIgM+/-、CD19+、CD22+、CD20+、CD79a+、CD5+(1/3病例)、CD23-、CD10-。20%可见t(11;14)(q17;q32)。有IgH基因重排,T-PLL极少见。
4.细胞遗传学:无重现性染色体异常。
5.骨髓病理组织学:
骨髓增生极度活跃,骨小梁间幼淋细胞弥漫均一性增生浸润,细胞分化比ALL细胞成熟,比CLL细胞幼稚。几乎每一个细胞均有一个居中的小核仁(图22)。粒、红、巨核系细胞极少或缺乏。在脾脏幼淋巴细胞主要累及白髓和红髓。
6.鉴别诊断:主要与ALL,CLL,HCL,SLVL(或MZL侵犯骨髓)鉴别。
(十四)B-慢性淋巴细胞白血病/小淋巴细胞淋巴瘤
1.定义:
B-慢性淋巴细胞白血病(B-CLL)与小淋巴细胞淋巴瘤(B-SLL)是同一种小淋巴细胞肿瘤疾病的不同期或相。小淋巴细胞累及骨髓和外周血,并且外周血淋巴细胞计数>10×109/L)(白血病期)。如<10×109/L,但形态学及免疫表型(CD5+、CD23+)符合B-CLL,伴肝、脾、淋巴结及结外典型的小淋巴细胞浸润也应诊断CLL。本病既可起初即为B-CLL,也可先有髓外B-SLL(组织期),然后进展为CLL。如幼淋巴细胞>10%,<55%时,则诊断CLL/PLL,为过度型。
2.免疫表型:
CD5+、CD23+、CD20+/-;CD10-、CD19-/+。SIg+,K+或L+。
3.骨髓病理组织学:
B-CLL骨髓增生极度活跃,分化成熟的小淋巴细胞均一性,弥漫或塞实性(packed)增生,粒、红、巨核系细胞极少或缺乏(图23)。有的骨髓增生较活跃,小淋巴细胞呈间质性、或结节性、或结节加间质性(混合性)浸润,粒、红、巨核系细胞不同程度减少。
4.鉴别诊断:
①髓外单一部位的 B-SLL ,骨髓增生程度正常,粒、红系细胞比例及各阶段比例大致正常,不见小淋巴细胞增多。
② 如小淋巴细胞呈间质性或结节状浸润时,就应 结合有无 CLL 的血象和骨髓象,有无全身多部位淋巴结大和或肝脾大,以及免疫组化,分子生物学等方法排除 CLL 、反应性淋巴细胞增生(淋巴细胞结节)后,诊断 SLL 侵犯骨髓。
③另外还要与HCL、PLL、MCL、SMZL、LPL等鉴别。
(十五)毛细胞白血病及亚型
毛细胞白血病(HCL)是介于CLL细胞与浆细胞之间阶段的B淋巴细胞慢性增殖性疾病。起源未明,曾有人认为来源于脾边缘区淋巴细胞,同义名:白血病性网状内皮增生症。
1.临床表现:
主要累及脾和骨髓,亦可累及腹腔淋巴结、肝脏,偶见累及皮肤。起病缓慢,脾大为首发症状,伴贫血,发热。中位年龄55岁,男:女=5:
1。可有反复机会性感染,血管炎,或其他免疫功能异常。外周血及骨髓涂片wright染色见直径10-15μm、胞浆淡染有多毛状突起的毛细胞。相差显微镜下多毛突起最明显。骨穿常见干抽。外周血单核细胞减少(HCL亚型时不减少)。
2.细胞化学:毛细胞ACP+及TRAP+(HCL亚型时阴性),PAS+。
3.TPA(咐醇酯)诱导培养24小时即见细胞完全贴壁及细长的胞浆突起。
4.免疫表型:毛细胞CD22+(100%)、CD25+、CD11c+、CD103+、CD19+、CD20+、SIg+、CD5-、CD10-。DBA44+(HCL亚型时CD103-、CD25-)。 .
5.超微结构:透射电镜示胞膜有大量细绒毛,胞浆有核糖体板层复合物。
6.遗传学:50%-70%有CyclinD1过表达,但与t(11;14)或BCL1重排无关。有IgGH或L基因重排。
7.骨髓病理组织学:
毛细胞胞浆丰富、透明(HCL亚型时嗜碱性),核圆、椭圆,居中呈“煎蛋样”,多无核仁,有的核呈粗块状似成熟浆细胞胞核,有胞核似豆形核。根据毛细胞浸润骨髓程度不同,可呈间质性、大片状或弥漫均匀分布,胞浆丰富,胞核彼此间距宽而类似“铺药片”样或“蜂窝”状是其特征(图24),在骨髓“血湖样”改变不常见。粒、红、巨核三系细胞随毛细胞浸润加重而减少,网状纤维可增多。骨髓活检是金标准。
8.鉴别诊断:主要与SMZL,CLL/SLL,MCL,LPL等鉴别。
骨小梁间幼淋细胞弥漫均一性增生浸润,细胞分化比ALL细胞成熟, 比CLL细胞幼稚。几乎每一个细胞均有一个居中的小核仁。 塑料包埋切片,H-Giemsa-E染色,200× 图22 B-幼淋巴细胞白血病(PLL)骨髓增生极度活跃,
骨小梁间幼淋细胞弥漫均一性增生浸润,细胞分化比ALL细胞成熟, 比CLL细胞幼稚。几乎每一个细胞均有一个居中的小核仁。 塑料包埋切片,H-Giemsa-E染色,200× 图22 B-幼淋巴细胞白血病(PLL)骨髓增生极度活跃,
核圆、椭圆,居中呈“煎蛋样”,多无核仁, 有的核呈粗块状似成熟浆细胞胞核。 塑料包埋切片,H-Giemsa-E染色,200× 图24 毛细胞白血病毛细胞胞浆丰富、透明,
-
IDA骨髓检查报告
骨髓细胞学检查图文报告单姓名XXX年龄XX性别X科别血液科采取日期XXXXXXX报告日期20xx1113病案号5919xx采取部位…
-
骨髓涂片检查方法及报告内容
骨髓涂片检查方法及报告内容1骨髓涂片制作染色方法1制片骨髓涂片制作方法与血片制作方法基本相同但因有骨髓小粒和脂肪滴有核细胞较多因此…
-
骨髓细胞学检查图文报告单范本
骨髓细胞学检查图文报告单姓名XXX年龄XX性别X科别血液科采取日期XXXXXXX病案号5919xx采取部位髂骨胸骨涂片号8665临…
-
骨髓细胞学检查报告
表428骨髓细胞学检查报告姓名贾某某性别女年龄27病室内二203病历号997096临床诊断贫血送检医师赵某某标本编号9909187…
- 骨髓穿刺活检术知情同意书
-
妇幼保健工作总结
今年是卫生系统全面开展“我为白衣天使添光彩”主题活动第二年。一年来,我院在上级主管部门的正确领导下,坚持妇幼卫生工作方针,以病人为…
-
学前教育组工作总结1
学前教育组工作总结时光飞逝转眼间一学期又匆匆而过去了。这一学期来本科组在每位教师的共同努力下开展了丰富多彩的集体活动,同时也连连创…
-
一次函数题型总结【精讲】
1.一个正比例函数的图象经过点(2,-1),那么这个正比例函数的表达式为()Ay=2xBy=-2xCy?11xDy??x222.已…
-
成本会计年终总结
成本会计年度工作总结在公司各领导的领导下和各位同仁的帮助下,基本完成了20xx年公司11月份前的成本会计工作,在工作中也不断的发现…
-
高二下学期物理教学总结
(20xx-20xx学年度第二学期)旧州中学潘斌一、教学要求1.认真钻研教学大纲及调整意见、体会教材编写意图。注意研究学生学习过程…