物化实验报告_乙酸乙酯皂化反应速率
实验9 乙酸乙酯皂化反应速率系数测定
丛 乐 2005011007 生51
实验日期:20##年12月8日星期六 提交报告日期:20##年12月22日星期六
助教老师:曾光洪
1 引言
1.1实验目的
1. 学习测定化学反应动力学参数的一种物理化学分析方法——电导法。
2. 了解二级反应的特点,学习反应动力学参数的求解方法,加深理解反应动力学特征。
3. 进一步认识电导测定的应用,熟练掌握电导率仪的使用方法。
1.2 实验原理
反应速率与反应物浓度的二次方成正比的反应为二级反应,其速率方程式可以表示为
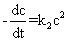 (1)
(1)
将(1)积分可得动力学方程:
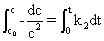 (2)
(2)
 (3)
(3)
式中: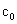 为反应物的初始浓度;
为反应物的初始浓度;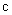 为t时刻反应物的浓度;
为t时刻反应物的浓度; 为二级反应的反应速率常数。将1/c对t作图应得到一条直线,直线的斜率即为
为二级反应的反应速率常数。将1/c对t作图应得到一条直线,直线的斜率即为 。
。
对于大多数反应,反应速率与温度的关系可以用阿累尼乌斯经验方程式来表示:
 (4)
(4)
式中: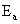 为阿累尼乌斯活化能或反应活化能;
为阿累尼乌斯活化能或反应活化能;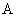 为指前因子;k为速率常数。
为指前因子;k为速率常数。
实验中若测得两个不同温度下的速率常数,就很容易得到
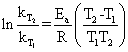 (5)
(5)
由(5)就可以求出活化能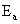 。
。
乙酸乙酯皂化反应是一个典型的二级反应,

t=0时, 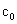
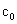 0 0
0 0
t=t时, 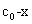
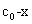
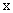
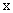
t=∞时, 0 0 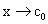
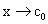
设在时间t内生成物的浓度为x,则反应的动力学方程为
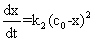 (6)
(6)
 (7)
(7)
本实验使用电导法测量皂化反应进程中电导率随时间的变化。设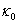 、
、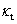 和
和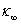 分别代表时间为0、t和∞(反应完毕)时溶液的电导率,则在稀溶液中有:
分别代表时间为0、t和∞(反应完毕)时溶液的电导率,则在稀溶液中有:
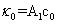


式中A1和A2是与温度、溶剂和电解质的性质有关的比例常数,由上面的三式可得
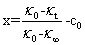 (8)
(8)
将(8)式代入(7)式得:
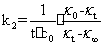 (9)
(9)
整理上式得到
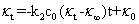 (10)
(10)
以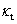 对
对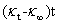 作图可得一直线,直线的斜率为
作图可得一直线,直线的斜率为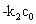 ,由此可以得到反应速率系数
,由此可以得到反应速率系数 。
。
溶液中的电导(对应于某一电导池)与电导率成正比,因此以电导代替电导率,(10)式也成立。本实验既可采用电导率仪,也可采用电导仪。
2 实验操作
2.1 实验药品、仪器型号及测试装置示意图
1.仪器
计算机及接口一套(或其他电导数据记录设备);DDS-11A型电导率仪一台;恒温槽一套;混合反应器3个;电导管2个;20ml移液管2支;10ml移液管2支;0.2ml移液管1支;100ml容量瓶1个;洗耳球一个。
2.药品
0.02mol·dm-3NaOH标准溶液(此浓度仅为大概值,具体值需实验前准确滴定);0.01mol·dm-3NaAc溶液(此浓度值为NaOH标准溶液的一半);乙酸乙酯(AR);新鲜去离子水或蒸馏水。
2.2 实验条件
表1 实验条件记录

2.3 实验操作步骤及方法要点
1. 乙酸乙酯溶液的配制
配制100ml乙酸乙酯溶液,使其浓度与氢氧化钠标准溶液相同。乙酸乙酯的密度根据下式计算:

配制方法如下:在100ml容量瓶中装2/3体积的水,用0.2ml刻度移液管吸取所需乙酸乙酯的体积,滴入容量瓶中,加水至刻度,混匀待用。
2. 仪器和药品准备
检查仪器药品,接通电源。设定恒温槽温度为20℃(可根据实际情况调整),用稀释一倍的氢氧化钠溶液调电导率仪指针在大约五分之四满刻度的位置(注意实验过程中不准在调指针位置),并接通相应设备电源,准备数据采集。
3. 测量
将混合反应器(如图2-9-1所示)置于恒温槽中,用20ml移液管移取氢氧化钠标准溶液于1池中,再移取20 ml乙酸乙酯溶液于2池中,将电导电极插入2池,恒温约10分钟,用洗耳球使1、2池中溶液混合均匀并立即开始电导数据采集,约20分钟后即可停止实验。
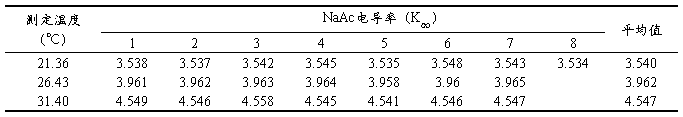
取适量醋酸钠溶液于电导管中,插入电导电极,恒温后测定醋酸钠溶液的电导率К∝。(应多次测量,直到显示数据没有太大变化为止)
升高温度3~5℃,重复以上步骤测定反应电导率的变化,直到35℃左右。
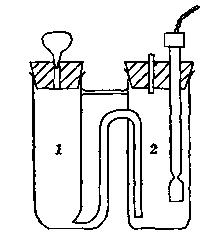
图1:混合反应器示意图
4. 实验注意事项
1) 温度的变化会严重影响反应速率,因此一定要保证恒温。
2) 不要敞口放置NaOH溶液,以防吸收空气中CO2,使其浓度变化。
3) 混合过程既要快速进行,又要小心谨慎。不要将溶液挤出混合器。
3 结果与讨论
3.1 原始实验数据
1) 实验相关条件及参数记录
实验中:NaOH标准溶液的浓度c0为:0.0177 (mol/L)
配制的乙酸乙酯溶液的密度ρ1为:0.90313 (g/ml)
配制的乙酸乙酯溶液的浓度c1为:0.0177 (mol/L)
2) 原始实验测量数据
为得到K∞的数值,配制浓度为NaOH一半,即c = 0.00885(mol/L)的NaAc溶液,并测定该溶液其在不同实验温度条件下的电导率,所得数据见下表(表2):
表2 不同实验温度条件下测定的NaAc电导率原始数据
3) 原始实验室物化实验软件处理结果见下表(表3):
表3 实验室物化实验软件处理结果

4) 实验相关数据文献值
乙酸乙酯皂化反应Ea = 46000 (J·mol-1)
3.2计算的数据、结果
1) 作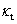 —
—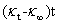 图,并由直线斜率求出相应温度下的反应速率系数k2。
图,并由直线斜率求出相应温度下的反应速率系数k2。
利用计算机保存的实验数据记录,选取相应的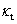 和t,在Origin Pro中以
和t,在Origin Pro中以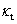 对
对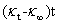 作图,并进行线性拟合。
作图,并进行线性拟合。
(a) 测定温度为21.36℃时,作图结果如下图2所示:
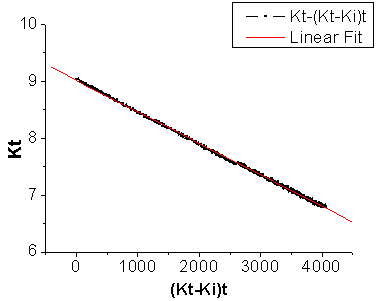
图2 测定温度21.36℃时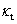 —
—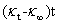 作图和拟合结果
作图和拟合结果
注:Kt代表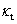 ,(Kt-Ki)t代表
,(Kt-Ki)t代表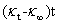 ,Linear Fit为线性拟合结果,下同。
,Linear Fit为线性拟合结果,下同。
通过回归分析,可得标准曲线的方程为:
Y = A + B * X; 其中A = 9.01247; B = -5.54043E-4 = -0.000554043; R = 0.9995
根据此式可以从直线斜率求得21.36℃下的反应速率系数k2(21.36℃):
斜率m = B = -k2·c0= -0.000554043;
则:k2(21.36℃)= 0.031302 (L/mol/s) = 3.1302 (×0.01L/mol/s)
(b) 测定温度为26.43℃时,作图结果如下图3所示:

图3 测定温度26.43℃时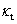 —
—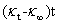 作图和拟合结果
作图和拟合结果
同前可得:标准曲线的方程为:
Y = A + B * X; 其中A = 9.81134; B = -7.63607E-4 = -0.000763607; R = 0.9986
k2(26.43℃)= 0.043142 (L/mol/s) = 4.3142 (×0.01L/mol/s)
(c) 测定温度为31.40℃时,作图结果如下图3所示(已去掉无效数据):
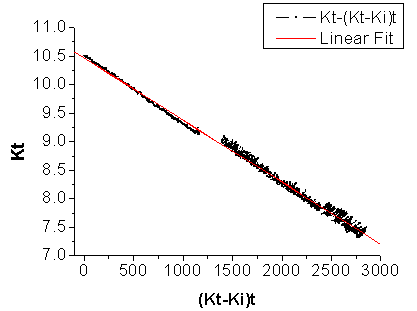
图4 测定温度31.40℃时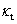 —
—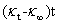 作图和拟合结果
作图和拟合结果
同前可得:标准曲线的方程为:
Y = A + B * X; 其中A = 10.46300; B = -0.00108605; R = 0.9974
k2(31.40℃)= 0.0061359 (L/mol/s) = 6.1359 (×0.01L/mol/s)
以上三组数据的结果汇总为下一页表4:
表4 反应速率常数计算结果汇总

2) 利用不同温度下反应速率常数计算活化能Ea
利用表4中的数据,以不同温度下的 对1/T作图,结果如下图4所示:
对1/T作图,结果如下图4所示:
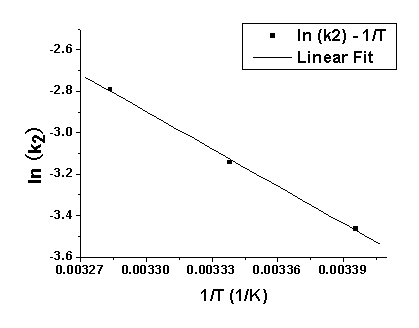
图5  对1/T作图和拟合结果
对1/T作图和拟合结果
Y = A + B * X; 其中A = 16.9309; B = -6008.8829; R = 0.9991
根据此式可以从直线斜率求得反应活化能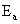 :
:
斜率m = B = -Ea/R = -6008.8829,(其中摩尔气体常量R = 8.314472);
则:Ea = -m · R = 49960.66 (J/mol)
3.3讨论分析
1) 测定结果与文献值的比较
由文献值可知:乙酸乙酯皂化反应Ea = 46000 (J·mol-1)
本实验中测得结果为: Ea = 49960.66 (J/mol)
与文献值的相对误差为:ε1(Ea)= (49960.66- 46000/49960.66)×100% = 7.93%
此结果与文献值的偏差较小,考虑到本次实验测定过程中可能存在的各种误差,这一偏差处在正常范围之内,说明实验测定的结果是基本准确的。
利用实验室软件得到的结果为:Ea = 28519.57(J/mol)
与文献值的相对误差为:ε2(Ea)= 38.0%
测定值与文献值之间的偏差较大,说明软件计算出的数值并不准确,而且与课后用Origin Pro软件处理所得的结果有很大的出入。产生这一差异的原因请见下文。
2) 实验测定值与文献值差异的分析
通过前文分析,我们可以发现用实验室计算机处理的结果与文献值和用Origin Pro处理的结果有很大差异。产生这一差异的主要原因如下:
(a) 温度为31.40℃数据采集中的异常波动。从图4中可以明显发现,测定温度为31.40℃时,所得的电导率数据出现异常波动。这是由于在实验室计算机进行电导率数据采集记录的过程中,我们为了查看一下之前的记录数据而打开了Windows的记事本程序。这一操作使得数据记录突然出现跳变(之前的数据则没有任何异常,而且数值稳定下降没有波动)。此后,计算机记录的所有数值都开始出现小范围波动(见图4中后半部分数据点)。这一波动最终得到的数据不准确,从而使得实验结果和文献值之间存在差异。
(b) 实验室软件处理时未完全去掉无效数据点。用实验室计算软件对数据进行处理时,我们并没有全部去掉无效的数据点,而课后用Origin Pro处理数据时则舍去了大部分无效的数据。所以用实验室软件计算出来的结果和课后用Origin Pro处理的结果并不一致,且课后所得的结果更加准确。
3) 测量过程中产生误差的可能原因及分析
对各个实验过程进行分析,产生误差的可能原因有以下几点:
(a) 温度测定过程中产生的误差:在进行温度测定的过程中,由于搅拌器的搅拌不可能使得体系中各部分的温度达到绝对均匀。所以,通过温度计得的是温度计水银球附近液体的温度,此温度与实验测定体系温度不一定完全一致,从而使所测数据和最终计算结果与实际值间存在误差。
(b) 实验中环境条件改变产生的误差:在测量过程中,虽然采用恒温槽使得体系的温度处于恒定状态,而且使用电子设备进行温度控制和数据采集,但仍然不能完全保证结果的准确。由于实验中测定仪器直接与外界环境接触,所以当外界环境温度、大气压力和湿度改变时,测量仪器(特别是数据记录和温度控制仪器)所处状态的改变可能影响其性能和测得数据的准确性。
特别是考虑到实验中使用了较多的数字式电子测定仪器,当温度和湿度改变时,电子元件的物理化学特性(如电阻、电容、电感等)很可能发生改变,从而导致所测得数据的误差。
(c) 反应体系混合过程中产生的误差:在实验中认为反应体系混合完全且记录起始点准确。但是在实际情况下,由于使用比较简单的洗耳球进行混合,同时人工控制数据记录起始点,所以反应体系很难完全均一地被混合,记录点的准确性也很难保证,由此最终测定的数据也会存在一定误差。
(d) 溶液配制产生的误差:由于配制溶液中所使用的移液管,容量瓶等仪器的容积存在误差,因此所配成的溶液浓度和体积并不一定完全和计算时使用的数值一致,由此也可能导致结果的误差。
(e) 反应和计算式本身的误差:实际进行的反应也不一定是一个没有偏差的二级反应,溶液电导率测定过程中实际的溶液性质也不可能完全符合无限稀溶液的特性。因此实验所使用的本身就是一个近似准确的方法,误差的存在是不可避免的。
(f) 测量仪器的系统误差:由于温度计和数据采集系统本身不可能绝对精确,实验测量过程中也可能存在由此导致的系统误差,影响结果的准确性。
4) 对实验中异常现象的分析和讨论
实验室数据记录时的波动:如前所述,我们在采集数据的过程中打开了Windows记事本,使数据记录出现明显的异常波动。而在无任何操作的情况下进行采集(参见图2和图3中21.36℃和26.43℃的数据点),数据记录则是非常稳定的。
由此可知,实验室记录数据过程中,进行任何一种计算机软件操作,包括点击鼠标或者敲击键盘都有可能影响数据的采集和记录。实验中必须避免这类操作。
5) 对仪器装置、操作步骤、实验方法的改进意见及体会
完成此次实验后,我深切地感受到蒸气压实验利用我们所掌握的物化知识,从实验的角度对我们进行了一次充分的训练。结果是次要的,所掌握的实验方法和总结分析才是关键。结合实验过程,我对本项试验有如下几点建议和体会:
(a) 数据的采集和记录:这一过程中最大的体会就是一定不要用采集数据中的电脑进行任何操作,否则会使得数据不稳定、不准确。
(b) 反应溶液配制和反应过程:实验中,为了避免反应物的挥发,务必要在取完溶液后及时加盖。移液管应该由同一个同学操作以保证移液过程的可靠性。而在反应中记录数据时,可以提前开始采集数据,之后再混合反应液并记录时间。但要注意后期处理时要在软件中选取适当的数据起始点。
(c) NaAc电导率测定和电导率仪的使用:实验中测定NaAc溶液标准电导率的过程中,应把装有NaAc溶液的试管始终放在恒温槽内,使得液体与反应体系始终处于同一温度,并注意加上盖子。
(d) 电导率仪的使用:每次测定时注意确保电导率测定仪的探头深入液面下,且在测定中不要拿出液面之外,否则数据会有异常波动。
6) 实验的总结与体会
本次物化实验中,物化实验室的曾光洪助教老师对我们进行了耐心的指导,给予了我们热情的帮助。特别是实验前老师为我们详细讲解了装置的使用和易出现的问题,使我们在随后的实验中能够从容应对和处理各种情况。
而且,老师还会为拓展我们的知识而在实验中引导我们思考和回答一些与实验有关的问题,让我受益良多。如果没有各位老师和助教的辛勤准备和付出,我们绝对无法顺利的完成本次的实验。非常感谢您,您辛苦乐!
4 结论
本次实验运用电导法测定了乙酸乙酯皂化反应的化学速率常数和活化能,结果如下:
表5 课后Origin Pro软件处理结果汇总

利用实验室计算软件对数据进行处理,得到的结果如下:
表6 实验室物化实验软件处理结果汇总

5 参考文献
[1]李德忠,化学通报,1992,(9) 53~55
[2]金家骏,化学通报,1974,(3);1981,(11)
[3]清华大学化学系物理化学实验编写组,《物理化学实验》,清华大学出版社,1991,201~209
[4]淮阴师范学院化学系,《物理化学实验》,高等教育出版社,2002,141~148
[5]Ed. by R. C. Weast. CRC Handbook of Chemistry and Physics, 58th Ed. Ohio CRC Press, 1977
[6]华侨大学材料学院,《物理化学实验指导》,2007,11-28~29
6 附录
思考题:
1. 配制乙酸乙酯溶液时,为什么在容量瓶中要先加入部分蒸馏水?
答:因为若直接加入干燥的容量瓶中,由于乙酸乙酯所取的量较少,而且容易挥发,所以会使倒入的溶质有一部分逸出容量瓶而损失,引起最终配制溶液的浓度不准确,所以需要在容量瓶中先加入部分蒸馏水。
2. 为什么乙酸乙酯和NaOH溶液浓度必须足够稀?请推导出公式κ0=A1·c0中A1的表达式,从而说明其为常数的条件。
答:实验中是通过测定溶液的电导率来计算乙酸乙酯皂化反应速率系数k和反应活化能Ea,只有当溶液足够稀时,才能认为溶液中的离子数符合离子独立运动定律;而且因为本反应是二级反应,根据所使用的计算公式,乙酸乙酯的浓度应与氢氧化钠的浓度相同而且如果氢氧化钠的浓度较高,电导率的变化与其初值相比将会很小,实验的灵敏度不高,结果不准确。综上,NaOH溶液和乙酸乙酯应该足够稀。
无限稀薄溶液中,对某一溶质而言Λm∞=Λm,+∞+ Λm,-∞。最初的电导率κ0实际上是初始时刻溶液(可视为标准NaOH溶液)中正负离子电导率之和,所以公式κ0=A1·c0中:
A1 = Λm,+∞(溶液)+ Λm,-∞(溶液),即 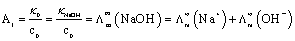
由此可知,A1是常数的条件是溶液无限稀,这是由于根据离子独立移动定律,在一定温度下无限稀溶液中,每种离子摩尔电导率Λm,B∞为常数,不受其它离子影响从而A1不变。
(注:以上计算中因为乙酸乙酯和乙醇对电导率的贡献相对NaOH很小,故予以忽略。)
3. 若配制溶液时用的不是去离子水,电导管和混合器未洗干净,对实验结果有影响?
答:配溶液不用去离子水或者未洗净反应器,则可能使得反应体系中存在能够使溶液电导率增大的杂质,从而使κt值增大。由公式kt=-kcat(kt-k∞)+k0可知,κt的增大将导致κt与(κt-κ∞)t不呈线性关系,影响实验结果的准确性。此外,如果管壁上的杂质在反应过程中逐渐溶解,则会使κt的变化将不再完全由本反应造成,使得测定结果不准确。
4. 预先单独用NaOH溶液来调整电导率仪有何作用?
答: 利用稀释一倍的标准NaOH溶液对电导仪的示数进行校正,使得该溶液的电导率约在0.8左右,由于反应过程中溶液电导率不断下降,因此这样操作让随后实验过程中所测定的数值处在电导仪的有效测量范围之内。(注:实验时将同浓度NaOH与乙酸乙酯溶液等体积混合,因此开始反应时NaOH溶液浓度为标准溶液一半,而此溶液电导率可视为κ0,即未发生反应时溶液的电导率)
5. 混合反应器设计思想是什么?请提出其他的混合方法。
答:混合反应器主要使NaOH在可记录的某时刻瞬时进入乙酸乙酯中切混合均匀,开始反应。亦可用漏斗加入并用磁力搅拌其搅拌进行混合,并记录加入时间即可。
答:设计思想:混合反应器在挤压洗耳球时将左管中的液体压到右管中去,在慢慢松开洗耳球时,液体又会从右管吸入左管中,经过多次挤压洗耳球可以达到很好的混合效果。
其他混合方法:可以直接利用注射器将同样温度的氢氧化钠溶液注射到装有乙酸乙酯的试管中,再用注射器将混合液吸入,并快速压回到试管里,就可以混合完全。也可用漏斗加入溶液并用磁力搅拌其搅拌进行混合。
6. 如何用化学方法来测定此反应速率常数?
答:如用化学方法测定此反应速率常数,则需要通过化学分析法测定反应达体系中各物质的浓度。对此反应而言,可采用同一浓度NaOH和乙酸乙酯溶液等体积混合,使初始反应物浓度相同,进而只需测定体系中NaAc或者乙醇的浓度即可。根据此反应特点,可采取测定溶液pH值得方法进行。或者,可以使用停止反应测定体系组成的方法,如采取骤冷、稀释或加入阻化剂使反应停止,然后进行组成分析。
-
乙酸乙酯皂化反应实验报告
聊城大学化学化工学院聂虎洋洋乙酸乙酯皂化反应速度常相数的测定一实验目的1通过电导法测定乙酸乙酯皂化反应速度常数2求反应的活化能3进…
-
物理化学实验报告 乙酸乙酯皂化反应
物理化学实验报告乙酸乙酯皂化反应动力学1目的1了解二级反应的特点2用电导法测定乙酸乙酯皂化反应的速率常数3用不同温度下的反应速率常…
-
物化实验报告_乙酸乙酯皂化反应速率
实验9乙酸乙酯皂化反应速率系数测定丛乐20xx011007生51实验日期20xx年12月8日星期六提交报告日期20xx年12月22…
-
乙酸乙酯皂化反应速率常数的测定实验报告
学号20xx14120xx2基础物理化学实验报告实验名称乙酸乙酯皂化反应速率常数的测定应用化学二班班级03组号实验人姓名xx同组人…
-
乙酸乙酯皂化反应速率常数的测定的实验报告
实验七乙酸乙酯皂化反应速率常数的测定日期20xx0618来源作者字体大中小乙酸乙酯皂化反应速率常数的测定一目的及要求1测定皂化反应…
-
化学反应速率与活化能的测定实验报告
化学反应速率与活化能的测定实验报告及数据处理实验目的1了解浓度温度及催化剂对化学反应速率的影响2测定NH42S2O8与KI反应的速…
-
化学反应速率与活化能的测定实验报告
化学反应速率与活化能的测定实验报告姓名班级试验时间第室号位指导教师实验目的1了解浓度温度及催化剂对化学反应速率的影响2测定NH42…
-
化学反应速率及活化能的测定实验报告
化学反应速率及活化能的测定实验报告1概述化学反应速率用符号J或表示其定义为Jddt31为反应进度单位是molt为时间单位是s所以单…
-
实验六 化学反应速率和活化能的测定
实验六化学反应速率和活化能的测定Chemlab软件模拟一实验目的1了解虚拟化学实验室CorelChemlab软件的功能和使用2模拟…
-
实验7 化学反应速率与活化能
实验7化学反应速率与活化能一实验目的1了解实验原理测定过二硫酸铵与碘化钾反应的反应速率计算反应级数反应速率常数及反应的活化能2掌握…
-
乙酸乙酯皂化反应速率常数的测定实验报告
学号20xx14120xx2基础物理化学实验报告实验名称乙酸乙酯皂化反应速率常数的测定应用化学二班班级03组号实验人姓名xx同组人…