金属活动性强弱的比较
同周期同主族元素金属性强弱的比较
一 教学目标::
知识与技能:掌握中学阶段金属元素金属性的判断依据;通过实验探究元素金属性的强弱,思考并总
结元素金属性强弱的比较方法。
过程与方法:理解金属元素金属性强弱判断标准的探究过程,进一步提升分析、比较、归纳的能力。 情感态度、价值观:培养科学兴趣、严谨求实的科学态度、勇于创新的科学精神,增强责任感,增强
协作精神。
二 教学重难点
同周期钠、镁、铝的金属性强弱比较,同主族钠、钾金属性强弱的比较
三 实验用品
试剂:金属钠、金属钾、镁条、铝片、蒸馏水、稀盐酸、氯化镁溶液、氯化铝溶液、氢氧化钠溶液、酚酞试液
仪器:试管、小烧杯、滴管、试管架、镊子、砂纸、酒精灯
四 教学过程
这节课我们就来探究讨论一下究竟从哪几个方面可以来判断金属元素的金属性强弱? 先来进行同主族金属性强弱的比较
由于实验有一定的危险性,教师进行演示实验
(1)金属元素的单质与水反应置换出H2的难易程度
【演示实验】在一盛有约50ml水的烧杯中,然后放入一小块金属钠,待反应停止后,滴入几滴酚酞,观
察。学生小组讨论用水来比较镁和铝金属性强弱的实验方案,并交流实验方案。
实验并记录:金属钠熔成一个闪亮的小球在水面游动,发出“嘶嘶”声,滴入酚酞后溶液变为红色。
【演示实验】在一盛有约50ml水的烧杯中,然后放入一小块金属钾,待反应停止后,滴入几滴酚酞,观
察。学生小组讨论用水来比较镁和铝金属性强弱的实验方案,并交流实验方案。
实验并记录:金属钾熔成一个闪亮的小球在水面游动并燃烧,刚接触水时发生轻微的爆炸,发出“嘶嘶”声,滴入酚酞后溶液变为红色。
【结论】钠与冷水剧烈反应;镁与冷水无明显反应;铝与冷水不反应;钠很容易失去电子变成离子,其失
电子能力强于镁、铝,即金属性强于镁铝。
金属性强弱判断标准一:单质和水反应,置换出氢气越来越容易。即,同主族金属性:钾>钠 再来讨论同周期金属金属性强弱的比较实验。
【引入】给出Na Mg Al三种金属元素,如何比较其金属性强弱呢?
(1)金属元素的单质与水反应置换出H2的难易程度
【演示实验】在一盛有约50ml水的烧杯中,然后放入一小块金属钠,待反应停止后,滴入几滴酚酞,观
察。学生小组讨论用水来比较镁和铝金属性强弱的实验方案,并交流实验方案。
实验并记录:金属钠熔成一个闪亮的小球在水面游动,发出“嘶嘶”声,滴入酚酞后溶液变为红色。
【学生实验】①取一段镁条放入盛约2ml冷水的试管中,观察。
②取一块铝片(大小与镁条差不多),放入盛有2ml冷水的试管中,观察。要求:记录上述实验现象,对比并得出结论。
【实验现象】①镁在冷水中无明显变化。
②铝在冷水中无明显变化。
【结论】钠与冷水剧烈反应;镁与冷水无明显反应;铝与冷水不反应;钠很容易失去电子变成离子,其失
电子能力强于镁、铝,即金属性强于镁铝。
金属性强弱判断标准一:单质和水反应,置换出氢气越来越容易。即,金属性:钠>镁>铝
目的:练习实验基本操作,培养学生的观察能力、记录能力。进一步练习实验基本操作,培养学生的观察
能力、记录能力。
(2)金属元素的单质与非氧化性酸反应置换出H2的难易程度
【过渡】
下面我们通过实验研究镁、铝与酸的反应。【学生实验】
在两支试管中分别加入2ml同浓度的稀盐酸,并分别投入镁条和铝片。
实验要求:观察现象及反应的剧烈程度。
【实验现象】均有无色气泡产生,且反应的程度是镁条更剧烈。请学生描述实验现象,作出实验结论,写
出相应的化学方程式和离子方程式。
【结论】Na、Mg、Al与酸反应失去电子置换出H2的能力依次减弱。即,金属性:钠>镁>铝 金属性强弱判断标准二:单质与非氧化性酸反应越剧烈,金属性越强。
(3)利用它们相应的化合物的性质能否比较它们的金属性强弱?
请同学写出Mg、Al两种元素最高价氧化物对应的水化物的化学式。我们知道NaOH是常见的强碱,Al(OH)3是具有弱酸性和弱碱性的两性。那么Mg(OH)2有没有弱碱性?如何通过设计实验来验证?【回答】比较它们最高价氧化物对应水化物的碱性强弱【学生实验】
(1)用AlCl3溶液和NaOH制备Al(OH)3沉淀,分置两支试管,分别加入稀硫酸和 NaOH溶液。观察现
象。观察到:Al(OH)3 白色沉淀可溶于稀盐酸,也溶于NaOH 溶液。
说明:Al(OH)3既能与酸反应,又能与碱反应,有弱酸性和弱碱性。
(2)用MgCl2溶液和NaOH制备Mg(OH)2沉淀,分置两支试管,分别加入稀硫酸和 NaOH溶液。观察
现象。观察到:Mg(OH)2 白色沉淀可溶于稀盐酸,不溶于NaOH 溶液。
说明:Mg(OH)2只能与酸反应,不能与碱反应,是一种中强碱。
【结论】Mg(OH)2比Al(OH)3碱性强
【结论】Mg(OH)2、Al(OH)3
(中强碱) 两性
【结论】金属性强弱判断标准三:最高价氧化物对应水化物的碱性越强,金属性越强。
对实验进行反复的实验,对自己探索的课题进行深入思考,力求达到最佳效果。进一步的提高实验操作能力,训练语言表达能力。
第二篇:如何比较元素非金属性的强弱
如何比较元素非金属性的相对强弱?
黄明建
一、原子得电子能力的强弱是元素非金属性强弱的本质反映
原子得电子能力的强弱与元素非金属性的强弱正相关,即: ..
元素原子得电子的能力越强,元素的非金属性就越强。
而原子得电子能力的强弱是由原子结构决定的。
对于原子核外电子层数相同的元素来说,核电荷数越大,原子半径越小,核对外层......
电子的吸引力越大,原子得电子的能力就越强,元素的非金属性越强;
对于原子最外层电子数相同(或外围电子层排布相似)的元素来说,核外电子层数........
越多,原子半径越大,核对外层电子的吸引力越小,原子得电子的能力就越弱,元素的非金属性越弱。
据此,“非金属单质与化合物间的置换反应”就常常成为判断元素非金属性强弱的一个重要依据。
二、以置换反应判断元素非金属性强弱需注意的问题
以置换反应作为判断元素非金属强弱的依据,须有一个大前提——非金属单质在反.......应中是作氧化剂,这样才能保证据此判断的结果不与元素非金属性强弱的本质相悖。 .......
例如,下面几个反应:
Cl2 + 2NaBr =2NaCl + Br2 ??????① Cl2 + H2S =2HCl + S↓ ??????② Br2 + 2KI =2NaBr + I2 ??????③ O2 + 2H2S =2H2O + 2S↓ ??????④
反应①②均是Cl2作氧化剂,分别从NaBr溶液和氢硫酸中置换出Br2和S,表现出Cl比Br和S原子得电子能力都要强,所以元素的非金属性强弱次序是:
Cl>Br Cl>S
反应③是以Br2作氧化剂,从KI溶液中置换出I2;反应④是以O2作氧化剂,从氢硫酸中置换出S;表现出Br比I原子得电子能力强、O比S原子得电子能力强,所以元素的非金属性强弱次序是:
Br>I O>S
但是,有些置换反应就不宜用于判断元素非金属性的相对强弱。例如:
I2 + 2KClO3 = Cl2 + 2KIO3 ?????? ⑤
2C + SiO2 === 2CO + Si 高温 ?????? ⑥
显然,我们不能因为反应⑤来判断碘元素比氯元素的非金属性强。因为该反应中,碘单质中的碘原子并没有从KClO3中的氯原子哪里夺得电子,反而是ClO3-中+5价的氯原子得电子被还原为Cl2。所以,不能机械地利用该反应比较碘与氯的非金属性强弱。
反应⑥中置换反应的次序与“碳元素比硅元素的非金属性强”的结论虽然是一致的。但仔细分析就会发现,这个反应与前面的①②③④几个反应有着本质上的差异:碳原子在反应中不仅没有表现出得电子能力比硅原子强的性质,反而是提供出电子使硅还原为硅单质。所以,该反应也不宜用于比较碳与硅的非金属性强弱。为什么反应⑥能够发生?原因应该从自由能变化方面分析。
近年高考命题也常涉及化学变化事实与结论关系的讨论,即前面的提供的实验事实和后面的结论有无因果关系,实际要考查的就是学生的逻辑思维能力,值得关注。
此外,我们通过反应③还可以注意到:原子得电子的能力大小并不是以单个原子得电子数目的多少决定,而是由原子得电子的难易决定。1个Cl原子最多只能得1个电子,1个S原子最多能得到2个电子,可是当-2价S遇到Cl原子时,不得不“缴械”投降。顺便提一下:反应③中,若是与氢硫酸反应的Cl2足够多的话,其产物还有可能是H2SO4。
三、以元素最高价氧化物的水化物酸性比较元素非金属性的相对强弱
可以认为:主族元素最高价氧化物的水化物酸性能够间接地反映原子得电子能力的相对强弱。例如——
酸性强弱次序:HClO4>H2SO4>H3PO4>H2CO3>H2SiO3
元素非金属性: Cl > S> P > C > Si
一般而言,主族元素的原子得电子能力越强,其最高价氧化物的水化物就越容易电...
离出H+,酸性就越强。
不过,在中学化学中的H2SO4、HClO4都属于强酸,在稀的水溶液中几乎都是100%电离。那凭什么说HClO4比H2SO4的酸性强呢?这需要借助酸碱质子理论解释。
酸碱质子理论认为:
凡是能给出质子(H+)的分子或离子都是质子给体,称为酸;凡是能与质子结合的分子或离子都是质子受体,称为碱。
酸碱强弱不仅决定于酸碱本身释放质子和接受质子的能力,同时也取决于溶剂接受
和释放质子的能力。
例如,醋酸(CH3COOH)在水中是一种弱酸,而在液氨中则是一种较强的酸,因为液氨接受质子的能力比水强。如果以液态HF作溶剂,CH3COOH就成弱碱了,因为液态HF比CH3COOH提供质子能力强,不仅能抑制CH3COOH的电离,还能使CH3COOH分子接受质子,迫使CH3COOH进入碱的行列。
在中学比较酸碱强弱,都是以水为溶剂的分散系来讨论的,而H2O是一种接受质子能力较强的物质,能使HClO4和H2SO4完全电离,所以无法区分它们酸性的相对强弱,这种现象被称作“拉平效应”。就好像一台称重范围在100g~1g之间的天平,对大于100g的不同质量物质就只能都“拉平”为100g了。要想区分大于100g的不同质量物质只有换一台天平。在化学上,要想区分HClO4和H2SO4的相对强弱,可用醋酸为溶剂,因为HClO4、H2SO4在醋酸中均不能完全电离。如HClO4在醋酸中的电离方程式:
HClO4 + CH3COOH ? [CH3C(OH)2]+ + ClO4-
其酸性强弱次序是:HClO4>H2SO4,它们在醋酸中摩尔电导率的比值为:
HClO4∶H2SO4=40∶3
由此可以说明HClO4比H2SO4酸性强的原因。
四、以单质与H2反应形成气态氢化物的难易比较元素非金属性的相对强弱 卤素单质与H2反应生成气态氢化物的难易主要决定于卤素原子得电子能力强弱,能很好地说明元素非金属性强弱与原子结构的对应关系。
同时,卤化氢的热稳定性也与元素的非金属性正相关。因此,气态氢化物的稳定性常常也被作为比较元素非金属性的一种判断依据。
但是,气态氢化物的稳定性与分子内原子间的成键方式和键焓(或键能)大小等因素有着密切关系。例如:常见化学键的键焓中,C-H的键焓为415kJ·molˉ1,N-H的键焓为389kJ·molˉ1。CH4需在1000℃开始分解,约1500℃才基本分解完全。NH3在700℃时就会明显分解。20xx年某地高考题认为“氢化物的稳定性顺序为:CH4<NH3”,应当是一种惯性思维的错觉所致。
五、以元素在周期表中的位置判断元素非金属性的相对强弱
用元素周期表反映元素周期律有多种形式,目前在各类教科书中最常用的是长式周期表(如上图所示)。在同周期中,从碱金属到卤素,随着原子核电荷数的递增,元素的非金属性逐渐增强,金属性逐渐减弱;在同主族元素中,从上到下,随着原子核外电子层数的递增,元素的金属性逐渐增强,非金属性逐渐减弱。
分析元素在周期表中的排列位置和性质的关系,还会发现一个有趣的现象:
各主族元素性质的变化在周期表中呈现两极——越往左下角的元素,其金属性越强,非金属性逐渐减弱;越往右上角排的元素,其非金属性越强,金属性越弱。犹如一幅奇妙的太极图,而F和Cs如同两极的中心。

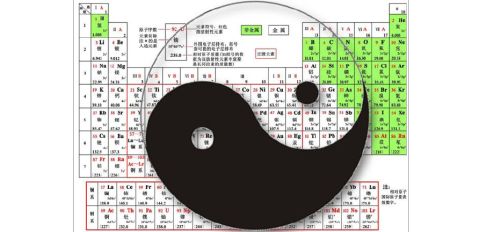
参考书目:
宋心琦 王晶 《化学2》(必修),人民教育出版社,2007,15-18
王磊 《化学2》(必修),山东科学技术出版社,2004,19-23
华彤文 陈景祖等《普通化学原理》(第3版),北京大学出版社,2005,158-162,93 大连理工大学无机化学教研室 《无机化学》(第5版),2006,100-111
唐宗薰 《中级无机化学》,高等教育出版社,2003,89-90
周公度 《化学辞典》(第二版),化学工业出版社,317
-
大学生活动总结范文
一、活动背景为了明确作为大一新生的我们,应该怎样才能让自己的大学生活过得更加充实。在辅导员提出以我的大学生活为主题,举办一次班会活…
-
活动策划书总结格式及范文[2]
活动策划书、总结格式及范文策划书格式一、活动主题二、活动背景三、活动目的四、活动时间、地点五、活动对象六、活动流程七、活动经费总结…
-
促销活动总结范文
xxxx年x月x日--25日开展了七周年大型促销活动,由于占了一定的天时和人和,再加上有吸引力的季节性商品和促销活动,总体效果较好…
-
活动策划活动总结格式及范例
活动策划活动总结格式及范例第一部分活动策划一活动策划的定义活动策划是针对某一活动的展开为活动进行具体的活动计划安排经费预算等一系列…
-
活动总结范文
活动总结范文一活动背景为了明确作为大一新生的我们应该怎样才能让自己的大学生活过得更加充实在辅导员提出以我的大学生活为主题举办一次班…
-
射线工作总结
无损检测工作技术总结总结人:苗德山淄博鲁创化工机械有限公司无损检测工作技术总结我于20xx年从沈阳工业学院焊接工艺及设备专业毕业,…
-
廉政风险防控工作总结
根据《中江县教育系统开展廉政风险防控管理工作实施细则》精神和局纪委的指导意见,双龙镇中心学校目标明确,重点突出,有方案、有宣传、有…
-
国培工作总结
国培计划——湖北省农村中小学骨干教师远程培训(20xx)风正一帆悬——师生心理健康教育班辅导教师工作总结20xx年翩然而至,我们一…
-
阳光团日活动总结报告
阳光之行团日活动总结报告书一、活动背景:继我院举办了一系列的创先争优活动后。我院团委、学生会将举行有我们,你还会冷吗?”的爱心活动…
-
信访工作总结
天桥街道信访工作总结今年以来,天桥街道信访工作在召陵区委、区政府的正确领导下,在上级信访部门的具体指导下,认真宣传贯彻《信访条例》…