环己酮的制备
实 验
学
专
班
姓
指 导
日 机 化 学 实 验 报 告

名 称: 环己酮的制备 院: 化学工程学院 业: 化学工程与工艺 级: 化工12-4班 名: 王佳琦 学 号 12402010411 教 师: 张老师 杨老师 期:
有
一、 实验目的
1. 学习次氯酸氧化法制环己酮的原理和方法。
2. 进一步了解醇和酮之间的联系和区别。
二、 实验原理
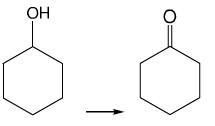
1. 用次氯酸钠作氧化剂,将环己醇氧化成环己酮。
2. 反应式:
三、 主要试剂及仪器
1. 主要试剂:环己醇,冰醋酸,次氯酸钠溶液,饱和亚硫酸氢钠溶液,氯化铝,碘化钾
淀粉试纸,无水碳酸钠,氯化钠,无水硫酸镁。
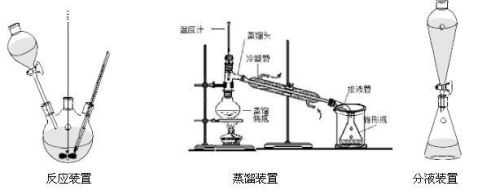
2. 仪器:250ml三颈烧瓶,搅拌器,滴液漏斗,温度计,冷凝管,接受器,分液漏斗,锥形瓶,
分液漏斗,三角漏斗。
3. 实验装置:
四、 实验步骤及现象

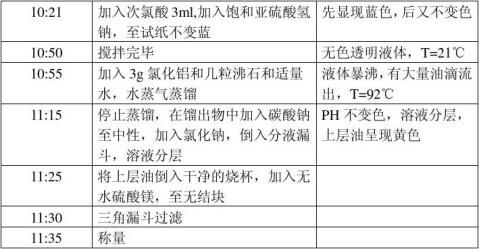
五、 实验数据
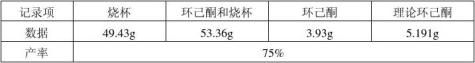
六、 注意事项
1. 蒸馏时温度不宜升的过快,将导致产品损失。 2. 盐析时氯化钠不宜加入太多,应该慢慢加入。
3. 加入精盐可以降低环己酮的溶解度并且有利于环己酮的分层。 4. 加氯化铝可预防蒸馏时发泡。
5. 水蒸气蒸馏时,加入的水只需在透明管中看到即可,中间的细皮管口不可对着人,以
防被水蒸气烫伤。
6. 停止通蒸汽时,要先将管口夹子取下,再关闭电源。
七、 实验讨论
1. 实验操作对实验结果的影响:
① 操作过程不够精细。
② 反应温度尽量控制在30℃左右,反应温度过低则不反应,温度过高则易挥发。 ③ 加入次氯酸不宜过多,否则中和时加入较多的亚硫酸氢钠,从而造成蒸馏时间过长。
④ 分液静止时间不够长,导致环己酮的损失。
⑤ 加热蒸馏要充分,蒸馏粗产品过程中,由于检验时油状液体较难判断,可以根据气味或蒸馏温度的变化判断蒸馏是否完全,而判断反应的终点。
2. 加入次氯酸充分反应后,溶液呈乳白色的原因分析:
因为加入次氯酸钠过多。次氯酸钠在有机试剂中溶解度比较低,当次氯酸钠过多时,容易析出,从而使溶液呈乳白色。
第二篇:环己酮肟的制备
环己酮肟的制备(cyclohexanone oxime)
一、实验目的:
学习用酮和羟胺的缩合反应制备肟的方法
二、实验原理: O
+NH2OHHClN+ HCl
三、主要试剂:
盐酸羟胺 2.5 g (35 mmol), 环己酮 2.5 g (2.7 ml, 25 mmol).
四、实验步骤:
在50 mlde 烧杯内将2.5 g盐酸羟胺溶解于7.5 ml 水中(可以微微加热)。然后慢慢用 6 mol/L NaOH 水溶液中和(pH = 8左右)并冷却至室温。
将2.7 ml环己酮 加入 50 ml 的圆底烧瓶中,加入4.0 ml 乙醇,在不断搅拌下,滴加上述羟胺溶液。加毕,回流20 min, 回流后如溶液中有不溶性固体杂质,则趁热减压过滤。将滤液冷却,析出晶体,过滤,干燥,称重,计算产率(一般85%)。测定产品熔点,(产品的熔点 88-89 ?C)。
乙醚的制备
思考题及注意事项
204. 204. 实验室使用或蒸馏乙醚时应注意哪些问题?
答:在实验室使用或蒸馏乙醚时,实验台附近严禁有明火。因为乙醚容易挥发,且易燃烧,与空气混和到一定比例时即发生爆炸。所以蒸馏乙醚时,只能用热水浴加热,蒸馏装置要严密不漏气,接收器支管上接的橡皮管要引入水槽或室外,且接收器外要用冰水冷却。
另外,蒸馏保存时间较久的乙醚时,应事先检验是否含过氧化合物。因为乙醚在保存期间与空气接触和受光照射的影响可能产生二乙基过氧化物(C2H5OOC2H5),过氧化物受热容易发生爆炸。
检验方法:取少量乙醚,加等体积的2% KI 溶液,再加几滴稀盐酸振摇,振摇后的溶液若能使淀粉显蓝色,则表明有过氧化合物存在。
除去过氧化合物的方法:在分液漏斗中加入乙醚(含过氧化物),加入相当乙醚体积1/5的新配制的硫酸亚铁溶液(55 ml水中加3 ml浓硫酸,再加30g 硫酸亚铁),剧烈振动后分去水层即可。
205. 205. 在制备乙醚时,滴液漏斗的下端若不浸入反应液液面以下会有什么影响?如果滴液漏斗的下端较短不能浸入反应液液面下应怎么办?
答:滴液漏斗的下端应浸入反应液液面以下,若在液面上面,则滴入的乙醇易受热被蒸出,无法参与反应,造成产率低、杂质多。如果滴液漏斗下端较短而不能浸入反应液液面以下,应在其下端用一小段橡皮管接一段玻璃上去。但要注意,橡皮管不要接触到反应液,以免反应液中的浓硫酸腐蚀橡皮管。
206. 206. 在制备乙醚和蒸馏乙醚时,温度计被装的位置是否相同?为什么?
答:不同。在制备乙醚时,温度计的水银球必须插入反应液的液面以下。因为此时温度计的作用是测量反应温度;而蒸馏时,温度计的位置是在液面上即水银球的上部与蒸馏烧瓶的支管下沿平齐,因为此时温度计的作用是测量乙醚蒸气的温度。
207. 207. 在制备乙醚时,反应温度已高于乙醇的沸点,为何乙醇不易被蒸出?
答:因为此时,乙醇已与浓硫酸作用形成了盐。
CH3CH2OH + H2SO4 [CH3CH2O+H2]HSO4-
该盐是离子型化合物,沸点较高,不易被蒸出。
208. 208. 制备乙醚时,为何要控制滴加乙醇的速度?怎样的滴加速度才
比较合适?
答:制乙醚时,反应液加热到130-140 oC 时,产生乙醚。此时再滴加乙醇,乙醇将继续与硫酸氢乙酯作用生成乙醚。若此时滴加乙醇的速度过快,不仅会降低反应液的温度,而且,滴加的部分乙醇因来不及作用就会被蒸出。若滴加乙醇的速度过慢,则反应时间会太长,瓶内的乙醇易被热的浓硫酸氧化或碳化。因此,滴加乙醇的速度应控制到能保持与馏出乙醚的速度相等为宜(1滴/秒)。
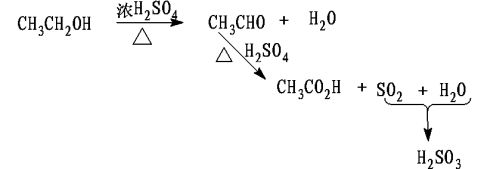
209. 209. 在粗制乙醚中有哪些杂质?它们是怎样形成的?实验中采用了哪些措施将它们一一除去的?
答:在粗制乙醚中尚含有水、醋酸、亚硫酸以及未反应的乙醇。因为在制备乙醚的同时,有下列副反应发生:
主反应:
2CH3CH2OH
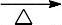
CH3CH2OCH
2CH3+ H2O
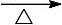
副反应:
2CH3
CH2OHH2CCH2+ H2O
实验中用NaOH溶液除去酸性物质:醋酸和亚硫酸;用饱和氯化钙除去乙醇;用无水氯化钙干燥除去所剩的少量水和乙醇。
210. 210. 在用NaOH溶液洗涤乙醚粗产物之后,用饱和氯化钙水溶液洗涤之前,为何要用饱和氯化钠水溶液洗涤产品?
答:因为在用NaOH水溶液洗涤粗产物之后,必然有少量碱残留在产品乙醚里,若此时直接用饱和氯化钙水溶液洗,则将有氢氧化钙沉淀产生,影响洗涤和分离。因此用氢氧化钠水溶液洗涤产品之后应用饱和氯化钠水溶液洗涤。这样,既可以洗去残留在乙醚中的碱,又可以减少乙醚在水中的溶解度。
211. 211. 若精制后的乙醚沸程仍较长,估计可能是什么杂质未除尽?如何将其完全除去?
答:若精制后的乙醚沸程仍较长,则说明此乙醚中还含有较少量的
乙醇和水未除干净。它们能与乙醚形成共沸物。为了得到绝对乙醇,可将此乙醚先用无水氯化钙干燥处理,然后,用金属钠干燥。
212. 212. 用乙醇和浓硫酸制乙醚时,反应温度过高或过低对反应有何影响?怎样控制好反应温度?
答:若反应温度过高(大于140oC)时,则分子内脱水成乙烯的副反应加快,从而减少了乙醚的得率。同时浓硫酸氧化乙醇的副反应也加剧,对乙醚的生成不利。温度过低,乙醚难以形成,而部分乙醇因受热而被蒸出,也将减少乙醚的产量。同时,乙醚中的乙醇量过多,给后处理将带来麻烦。
正确的控制温度方法是:迅速使反应液温度上升至140 0C,控制滴加乙醇的速度与乙醚蒸馏出的速度大致相等,以维持反应温度在1400C左右。
-
环己酮的制备实验报告
20xx年11月19日姓名系年级20xx级应用化学系组别30同组者科目有机化学题目环己酮的制备仪器编号一实验目的1学习铬酸氧化法制…
-
环己酮的制备实验报告(4)沈杰
实验学专班姓指导日机化学实验报告名称院化学工程学院业化学工程与工艺级化工114班名沈杰学号114020xx417教师肖勋文何炎军期…
-
有机化学实验报告:环己酮的制备
环己酮的制备华南师范cai前言环己酮无色透明液体分子量9814密度09478gmL熔点164C沸点15565C在水中微溶在乙醇中混…
-
有机化学环己酮的制备实验报告
实验学专班姓指导日机化学实验报告名称环己酮的制备院化学工程学院业化学工程与工艺级化工112班名赵应松学号114020xx242教师…
-
环己酮的制备实验报告
实验学专班姓指导日机化学实验报告名称环己酮的制备院化学工程学院业化学工程与工艺级化工124班名王伟杰学号124020xx414教师…
-
浙江大学远程教育自我总结
我于20xx年进入浙江大学远程教育学院温州分院乐清教学点,进行工商管理专业的本科学习。光阴似箭,三年的学习时光转瞬即逝,我在各方面…
-
六年级班主任工作总结
20xx—20xx学年度第一学期六年级班主任工作总结运河小学袁雪二〇一三年二月(20xx—20xx学年度第一学期)运河小学袁雪本学…
-
总结美容行业常见的六种营销模式
1、教育营销核心理念:以教育带动产品销售。操作要点:以营销、技术专家、讲师、潜训师组成讲师团,通过演示会等形式,培育并引导消费,提…
-
四年级语文期中考试总结
时间过得真快,转眼期中考试结束了,看看这两个月的教学工作,有得也有失。看着学生的成绩,让我感到自己和学生的付出有了一些回报!半个学…
-
大一上学期班长期末班级工作总结
班级工作总结林花谢了春红,太匆匆。时光如白驹过隙,昨日光景还时时浮现在眼前。“少壮不努力,老大徒伤悲”已是老生常谈,,可在这已逝的…