食醋中总酸含量的测定
食醋中总酸含量的测定
黄岩中学 周元勇
一.《实验化学》教学指导意见

二.基本的操作要求:
食醋总酸含量的测定实验操作要求基本上等同于老教材的中和滴定实验。中和滴定实验的过程可分为五个步骤,每一步骤中都有几个应注意的问题,现归纳如下,供同行们参考。
一查。即对中和滴定的仪器进行检查。①检查滴定管是否漏水,其方法是注水至全容量,垂直静置15分钟,所渗漏的水不超过最小分度值。②酸式滴定管的活塞是否转动灵活。③检查碱式滴定管乳胶管中的玻璃小球大小是否适宜。
二盛。①标准溶液在滴定管中,一是注意先用少量标准液把滴定管润洗2~3次,否则会使标准液浓度变稀。二是注意调节到滴定管尖嘴部分充满溶液,避免空气“冒充”溶液。三是使液面处在刻度“0”的位置。②锥形瓶中盛待测液,一是注意取用待测液的移液管或者滴定管应先用待测液润洗2~3次;二是注意锥形瓶不能用待测液润洗,否则会使待测物物质的量增多,测定结果偏高。三是向锥形瓶中加入指示剂的量应注意控制为2~3滴,以避免指示剂消耗酸或碱,产生误差。
三滴。滴定操作应注意:①左手通过酸式滴定管的活塞或碱式滴定管中的玻璃小球控制滴定速度(不要成流水线),注意先快后慢。②锥形瓶:右手三指拿住瓶颈,瓶底离台约2~3cm,滴定管下端深入瓶口约1cm,同一方向作圆周运动,边滴边摇。③眼睛注视锥形瓶中溶液颜色的变化。
四判。即滴定终点的判断。①碱滴定酸,一般选择酚酞作指示剂,终点时,溶液由无色转变为浅红色。②终点时,溶液的颜色应注意不立即褪去而保持30秒钟。(时间过长也不行:因为吸收了空气中的CO2后溶液可能又变为无色)。
五算。即滴定结果的求算。①读数时,滴定管必须保持垂直。读数者的视线应与管内凹液面的最低点处于同一水平线上。②准确读数。滴定管可精确读到0.1ml,估读到0.01ml,都是有效读数。③取三次较接近的测定数值的平均值。
三.具体做实验时的几个注意事项和想法
1、因为用NaOH的标准溶液滴定醋酸的反应式为;NaOH + CH3COOH = CH3COONa + H2O反应产物是CH3COONa ,突变范围偏碱性(pH值在8.6左右)可选用酚酞做指示剂。CO2对该测定有影响,为消除CO2对实验的影响,减少实验误差,配制NaOH溶液和稀释食醋的蒸馏水在实验前应加热煮沸2~3分钟,以尽可能除去溶解的CO2,并快速冷却至室温。
2、注意食醋取后应立即将试剂瓶盖盖好,防止挥发。我用一瓶非名牌白醋且已放置两年半之久来做食醋中总酸含量的测定,测得其值为 2.789 g/100mL,说明近一半酸挥发。
3.用移液管吸取溶液时,移液管下端至少伸入液面1cm,不要伸入太多,以免管口外壁沾附溶液过多,也不要伸入太少,以免液面下降后吸空。注意,不要把残留在管尖的液体吹出(除非移液管注明“吹”字),因为在校准移液管容积时没有把这部分液体包括在内。
4、碱标准溶液常用NaOH来配制,KOH一般并不优于NaOH,而且价格较高,由于NaOH固体易吸收空气中的CO2和水分,不能直接配制碱标准溶液,而必须用标定法。
5、振荡中,锥形瓶内壁上可能沾有食醋或NaOH溶液,没有完全反应,(方法:用洗瓶蒸馏水冲洗)。观察上时若颜色辨别不清(红色与浅红色),(方法:垫白纸)。近终点时,半滴操作---洗瓶冲洗,滴定完成后,应及时排除滴定管中废液,用水洗净,倒夹在滴定管架上.
6、关于食醋的选择:①一般的食醋由于颜色较深不利于滴定终点的判断,可稀释后用中性活性炭脱色后再行滴定,脱色时,在稀释后的试样中加入少量的活性炭,振荡约4~5分钟后过滤。如果试样颜色仍然较深,需重复上述操作2~3次,脱色比较麻烦且效果也不甚理想,加上师生近视比例高更不利于滴定终点的判断,如我用的黄岩产陈醋经过三次脱色后,颜色仍然较深。若一定要做,是否可不用指示剂作终点判断的依据,改用测pH的方法。最好用pH计来测pH ?②白醋可以直接滴定,我用江苏镇江产金山寺牌白醋做食醋中总酸含量的测定,滴定终点的判断较明显(可见ppt文件的照片)
最后具体数据见下表:
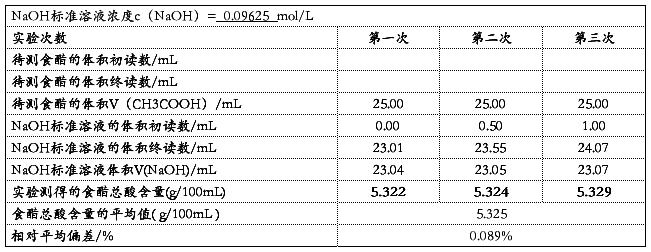
金山寺牌白醋外包装上写着总酸≥5.00g/100mL,所以为合格品且是优级醋
7、如碱式滴定管一次都不润洗,我试做的结果是耗NaOH标准溶液体积大约多了0.10 mL
四.关于酿造食醋与配制食醋
①食醋GB 18187-2000《酿造食醋》中规定:酿造食醋是以单独或混合使用各种含有淀粉、糖的物料或酒精,经微生物发酵酿制而成的液体调味品。②SB 10337-2000《SG配制食醋》中规定:配制食醋是以酿造食醋为主体,与冰乙酸、食品添加剂等混合配制而成的调味食醋。但配制食醋中酿造食醋的比例(以乙酸计)不得少于50%。我国目前生产的酿造食醋与配制食醋都属于调味品,消费者可根据日常饮食习惯选择。③GB 7718-2004《预包装食品标签通则》中规定食醋产品标签中要标明“酿造食醋”或“配制食醋”。 ④每100mL醋中的醋酸含量,普通醋为3.5g以上,优级醋为5g以上。
鉴别酿造食醋和配制食醋可从食醋的感官品评、理化指标和检测经验等几个方面进行分析,以下着重从感官方面阐述其鉴别方法。(1)看外观。酿制醋是用大米或糯米为原料,经发酵酿制成醋后,再经压滤、消毒而成。外观液体浓稠,色泽清澈,无沉淀。配制醋是用食用的冰酸醋加水配成的,液体稀薄,有透明感,色泽暗红或无色,易浑浊。(2)闻气味。酿制醋含有乙酸乙脂、乳酸乙脂等14种发酵香味成分,营养丰富,醋香浓郁,气味柔和。配制醋掺有香精,故香精味较浓,酸气严重,刺激性较强。(3)尝酸味。酿制醋酸中有鲜有甜,口味醇和,酸味在舌尖能滞留较长时间。配制醋酸度较高,酸味浓烈呛人,回味有点苦涩。
第二篇:食醋中HAc浓度的测定
实验五 食醋中HAc浓度的测定
实验类型: 验证 要求:必修 学时:4
教学重点和难点:强碱滴定弱酸及合适指示剂的选择
一、实验目的
1. 了解基准物质KHC8H4O4的性质及其应用;
2.掌握NaOH标准溶液的配制,标定及保存要点;
3. 掌握强碱滴定弱酸的滴定过程;突跃范围及指示剂的选择原理。
二、实验原理
食醋的主要成分是醋酸,此外还含有少量其它弱酸如乳酸等。醋酸为有机弱酸(Ka=1.8×10-5),与NaOH反应,反应方程式为:

反应产物为强碱弱酸盐,突跃范围在pH7.74~9.70之间,选用酚酞作指示剂。用NaOH标准溶液滴定食醋,测得的是总酸度,以醋酸的含量(g·mL-1)来表示。
三、主要试剂与仪器
1. 0.1mol/LNaOH溶液
2. 酚酞 : 0.2%乙醇溶液;
3. 基准物质KHC8H4O4
4. 电子天平
5. 25mL碱式滴定管
6. 100mL锥形瓶
四、实验步骤
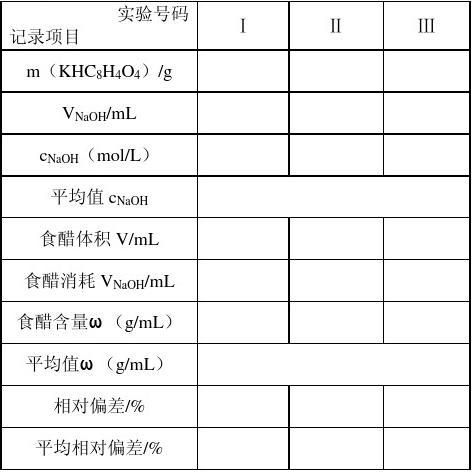
1.0.1mol·L-1NaOH标准溶液浓度的标定
称取固体NaOH 0.4g左右,置于50mL烧杯中,马上加入蒸馏水使之溶解,稍冷却后转入容量瓶中,加水稀释至100mL,盖塞后摇匀;转入试剂瓶中,用橡皮塞塞好瓶口,充分摇匀。
用差减法称取KHC8H4O43份,每份0.2~0.3g,分别倒入100mL锥形瓶中,加20mL蒸馏水溶解后,加入酚酞指示剂2~3滴,用待标定的NaOH溶液滴定至呈微红色并保持30秒不褪色即为终点。
2.食醋中总酸度的测定
准确移取食用白醋10mL 至100mL容量瓶中,加水定容、摇匀;用10mL移
液管移取新配制的溶液三份,于100mL锥形瓶中,加入酚酞指示剂2~3滴,用NaOH标准溶液滴定至呈微红色并保持30分钟不褪色即为终点。平行测定3份。计算每100mL食用白醋中醋酸的质量。
六、注意事项:
1. KHC8H4O4是基准物质,要用递减法称量。
2.注意标定NaOH和测定醋酸要使用同一试剂瓶中试剂,以减少误差。 3. 本次实验的重点是掌握滴定管、容量瓶、移液管的使用方法和没定操作技术。本实验的结果以醋酸的质量浓度(g·mL-1)来表示。
七、思考题:
1.标定NaOH标准溶液的基准物质常用的有哪几种?本实验选用的基准物质是什么?与其他基准物质比较,它有什么显著的优点?
2.称取NaOH和KHC8H4O4各用什么天平?为什么?
3.已标定NaOH标准溶液在保存时吸收了空气中CO2,以它测定HCl溶液的浓度,若用酚酞为指示剂,对测定结果产生何种影响?改用甲基橙为指示剂,结果如何?
若NaOH溶液因贮存不当吸收了CO2,而形成Na2CO3,使NaOH溶液浓度降低,在滴
定过程中虽然其中的Na2CO3按一定量的关系与HCl定量反应,但终点酚酞变色时还有一部分NaHCO3末反应,所以使测定结果偏高。
4.测定食用白醋含量时,为什么选用酚酞为指示剂?能否选用甲基橙或甲基红为指示剂?
5.酚酞指示剂由无色变为微红色时,溶液pH为多少?变红的溶液在空气中放置后又会变为无色的原因是什么?
-
食用醋中醋酸含量的测定
食用醋中醋酸含量的测定一实验目的1了解实样分析的方法2掌握碱标准溶液的标定方法3掌握食醋总酸度的测定原理方法和操作技术二实验原理食…
-
食醋中总酸量的测定实验报告
食醋中总酸量的测定梁建林4100711820xx级化学3班1号实验小组电话187xxxxxxxx一实验目标1初步学会用传感器技术测…
-
食醋中醋酸含量的测定
食醋中醋酸含量的测定摘要食醋不仅是人们日常生活中必不可少的调味品也是现代食疗的常用食品之一食醋具有帮助消化的作用还有预防衰老增强肠…
-
分析化学实验指导实验六 食用白醋中醋酸含量的测定
分析化学实验现场指导书刘晓庚20xx实验六食用白醋中醋酸含量的测定一实验目的1掌握NaOH标准溶液的标定方法2了解基准物质邻苯二甲…
-
食醋中总酸量的测定实验报告
实验六食醋中总酸量的测定20xx级化学1班1223实验室一实验目的1初步学会用传感器技术测定食醋中的总酸量2会组织中学生用传感器技…
-
食醋中总酸量的测定实验报告 (1)
食醋中总酸量的测定孟娟20xx级化学3班14小组4120xx49一实验目标1初步学会用传感器技术测定食醋中的总酸量2会组织中学生用…
-
食醋中总酸量实验报告1
食醋中总酸量的测定一实验目的1学习食醋中总酸度的测定方法2了解传感器技术在中学实验中的应用二实验原理待测的食醋中醋酸及其他有机酸可…
-
食醋中总酸量的测定实验报告
食醋中总酸量的测定梁建林4100711820xx级化学3班1号实验小组电话187xxxxxxxx一实验目标1初步学会用传感器技术测…
-
食醋中总酸量的测定实验报告
实验六食醋中总酸量的测定20xx级化学1班1223实验室一实验目的1初步学会用传感器技术测定食醋中的总酸量2会组织中学生用传感器技…
-
实验三 食醋中总酸度的测定
实验三食醋中总酸度的测定总学时2学时一实验目的1熟练掌握滴定管容量瓶移液管的使用方法和滴定操作技术2掌握氢氧化钠标准溶液的配制和标…
-
实验三 食醋中总酸度的测定
实验三食醋中总酸度的测定总学时2学时一实验目的1熟练掌握滴定管容量瓶移液管的使用方法和滴定操作技术2掌握氢氧化钠标准溶液的配制和标…