实验六 电导法测定乙酸电离平衡 常数
实验六 电导法测定乙酸电离平衡常数
一、 实验目的
1、 掌握电导、电导率、摩尔电导率的概念以及他们之间的联系。
2、 掌握由电导法测定弱电解质电离平衡常熟的原理。
二.实验原理:
1.电离平衡常数Kc的测定原理
在弱电解质溶液中,只有已经电离的部分才能承担传递电量的任务。在无限稀释的溶液中可以认为弱电解质已全部电离,此时溶液的摩尔电导率为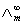 ,可以用离子的极限摩尔电导率相加而得。而一定浓度下电解质的摩尔电导率∧m与无限稀释的溶液的摩尔电导率
,可以用离子的极限摩尔电导率相加而得。而一定浓度下电解质的摩尔电导率∧m与无限稀释的溶液的摩尔电导率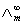 是有区别的,这由两个因素造成,一是电解质的不完全离解,二是离子间存在相互作用力。二者之间有如下近似关系:
是有区别的,这由两个因素造成,一是电解质的不完全离解,二是离子间存在相互作用力。二者之间有如下近似关系:
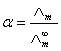 (1)
(1)
式中为弱电解质的电离度。
对AB型弱电解质,如乙酸(即醋酸),在溶液中电离达到平衡时,其电离平衡常数Kc与浓度c和电离度α的关系推导如下:
CH3COOH →CH3COO- + H+
起始浓度 c 0 0
平衡浓度 c(1-α) ca ca
则
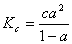 (2)
(2)
以式(1)代入上式得: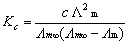 (3)
(3)
因此,只要知道∧m∞和∧m就可以算得该浓度下醋酸的电离常数Kc。
将式(2)整理后还可得:
 (4)
(4)
由上式可知,测定系列浓度下溶液的摩尔电导率∧m,将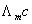 对1/Λm作图可得一条直线,由直线斜率可测出在一定浓度范围内
对1/Λm作图可得一条直线,由直线斜率可测出在一定浓度范围内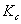 的平均值。
的平均值。
2.摩尔电导率∧m的测定原理
电导是电阻的倒数,用G表示,单位S(西门子)。电导率则为电阻率的倒数,用k表示,单位为G·m-1。
摩尔电导率的定义为:含有一摩尔电解质的溶液,全部置于相距为1m的两个电极之间,这时所具有的电导称为摩尔电导率。摩尔电导率与电导率之间有如下的关系。
∧m= κ/c (5)
式中c为溶液中物质的量浓度,单位为mol·m-3。
在电导池中,电导的大小与两极之间的距离l成反比,与电极的面积A成正比。
G = κA/ l (6)
由(6)式可得
κ=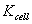 G (7)
G (7)
对于固定的电导池,l和A 是定值,故比值l/A为一常数,以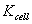 表示,称为电导池常数,单位为m-1。为了防止极化,通常将铂电极镀上一层铂黑,因此真实面积A无法直接测量,通常将已知电导率κ的电解质溶液(一般用的是标准的0.01000mol·L-1KCl溶液)注入电导池中,然后测定其电导G即可由(7)式算得电导池常数
表示,称为电导池常数,单位为m-1。为了防止极化,通常将铂电极镀上一层铂黑,因此真实面积A无法直接测量,通常将已知电导率κ的电解质溶液(一般用的是标准的0.01000mol·L-1KCl溶液)注入电导池中,然后测定其电导G即可由(7)式算得电导池常数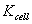 。
。
当电导池常数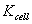 确定后,就可用该电导池测定某一浓度c的醋酸溶液的电导,再用(7)式算出κ,将c、κ值代入(5)式,可算得该浓度下醋酸溶液的摩尔电导率。
确定后,就可用该电导池测定某一浓度c的醋酸溶液的电导,再用(7)式算出κ,将c、κ值代入(5)式,可算得该浓度下醋酸溶液的摩尔电导率。
在这里的求测是一个重要问题,对于强电解质溶液可测定其在不同浓度下摩尔电导率再外推而求得,但对弱电解质溶液则不能用外推法,通常是将该弱电解质正、负两种离子的无限稀释摩尔电导率加和计算而得,即:
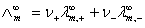 (8)
(8)
不同温度下醋酸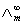 的值见表1。
的值见表1。
表2.5 不同温度下醋酸的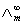 (S·m2·mol-1)
(S·m2·mol-1)

二、 实验器材
DDBJ-350便携式电导率仪,电导电极,恒温槽,烧杯、锥型瓶,移液管(25mL);
0.0200 mol·L-1  标准溶液,0.1779 mol·L-1
标准溶液,0.1779 mol·L-1 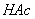 标准溶液
标准溶液
四、实验步骤
1、 调节恒温水槽水浴温度为25°C,将实验中要测定的溶液和一定量的蒸馏水恒温。
2、 校准便携式电导率仪的电导常数:量取一定量0.2mol/L的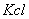 溶液于小烧杯中,并放置于恒温水槽中恒温至25°C。用滤纸将两电极擦拭干净并测出
溶液于小烧杯中,并放置于恒温水槽中恒温至25°C。用滤纸将两电极擦拭干净并测出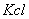 溶液的电导率;并与0.276s/m相比,若差很多,重新调节。
溶液的电导率;并与0.276s/m相比,若差很多,重新调节。
3、 测量醋酸溶液的电导率:
(1)、取50ml0.1779mol/L的醋酸溶液于小锥形瓶中并置于恒温水槽中至温度升到25°C,两电极洗净擦干,用电导率仪测出其电导率,每隔一两分钟测一次,测三次。
(2)、用移液管吸取锥形瓶中醋酸25ml,再加入25ml水稀释醋酸,并测其电导率。重复该操作,依次稀释四次。
(3)记录实验数据。
(4)将电导电极、温度传感器洗净,依然将电导电极泡在蒸馏水中。收拾好实验桌。
五、数据处理
实验温度: 25℃
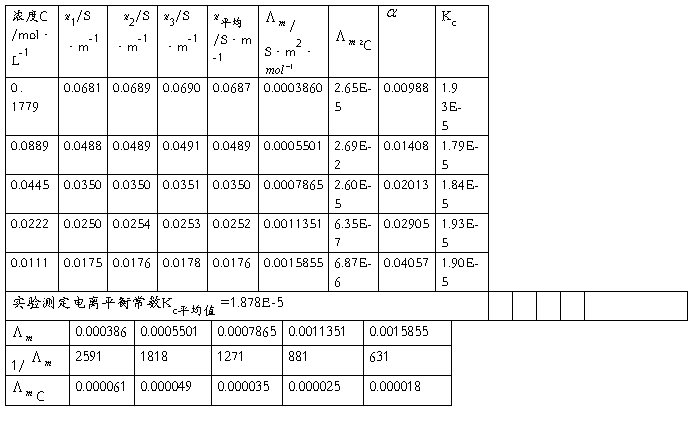
用 对1/∧m作图或进行线性回归,求出相应的斜率和截距,求出平均电离常数Kc
对1/∧m作图或进行线性回归,求出相应的斜率和截距,求出平均电离常数Kc
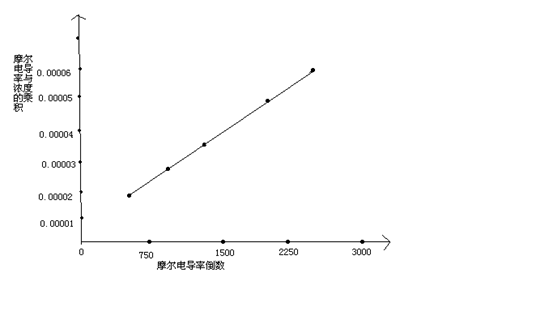
直线斜率为2.9×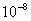 ,又因为斜率表示为
,又因为斜率表示为 所以可得:
所以可得: =2.9×
=2.9×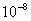 ,得
,得 =1.87×
=1.87×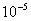
六、思考题:
1.电导池常数是否可用测量几何尺寸的方法确定?
答:不能。测定电导池常数可以用标准溶液测定法,用氯化钾为标准物质;还可以用与标准电极比较法测定。
2.实际过程中,若电导池常数发生改变,对平衡常数测定有何影响?
答:溶液电导一经测定,则?正比于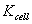 。即电导池常数测值偏大,则算得的溶液的溶解度、电离常数都偏大,反之,电导池常数测值偏小,则电离常数偏小。
。即电导池常数测值偏大,则算得的溶液的溶解度、电离常数都偏大,反之,电导池常数测值偏小,则电离常数偏小。
七、误差分析
1、所取溶液浓度的准确性。
2、读数过程中,温度是否达到25℃;读数间隔时间是否够。
3、稀释过程的准确性。
4、电导仪校准时也可能未达要求。
第二篇:实验八 电导法测量弱电解质的电离常数
电导法测量弱电解质的电离常数试验报告
试验人: 闯 学 号:
班 级: 实验日期:2012/3/17
一、实验目的
1.学会电导(率)仪的使用方法。
2.掌握溶液电导的测定。
二、实验原理
AB弱电解质电离达到平衡时,电离平衡常数KC与原始浓度C和电离度α有(1):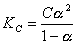 ,在一定温度下KC是常数,可通过测定AB弱电解质在不同浓度时的α代入式(1)求出KC。醋酸溶液的电离度可用电导法来测定,将电解质溶液放入电导池内,溶液电导(G)的大小与距离(l)成反比,与面积(A)成正比即式(2):
,在一定温度下KC是常数,可通过测定AB弱电解质在不同浓度时的α代入式(1)求出KC。醋酸溶液的电离度可用电导法来测定,将电解质溶液放入电导池内,溶液电导(G)的大小与距离(l)成反比,与面积(A)成正比即式(2):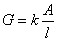 ,式中
,式中 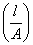 为电导池常数,以Kcell表示;κ弱电解质HAc的
为电导池常数,以Kcell表示;κ弱电解质HAc的 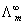 可由强电解质HCl、NaAc和NaCl的
可由强电解质HCl、NaAc和NaCl的 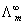 的代数和求得:
的代数和求得: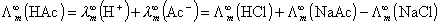 为电导率。故
为电导率。故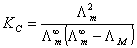
三、仪器药品
电导率仪1台; 恒温槽1套; 电导池1只; 电导电极1只; 容量瓶(100mL)5只;移液管(25mL、50mL)各1只; 洗瓶1只; 洗耳球1只。各种不同浓度的醋酸溶液。
四、实验步骤
(1)将恒温槽温度调至(25.0±0.1)℃;
(2)测定电导池常数Kcell
倾去电导池中蒸馏水,将电导池和铂电极用少量的10.00mol·m-3KCl溶液洗涤2~3次后,装入10.00mol·m-3KCl溶液,恒温后,用电导仪测其电导。
(3)测定电导水的电导(率)
倾去电导池中的KCl溶液,用电导水洗净电导池和铂电极,然后注入电导水,恒温后测其电导(率)值,重复测定三次。
(4)测定HAc溶液的电导(率)
五、数据处理
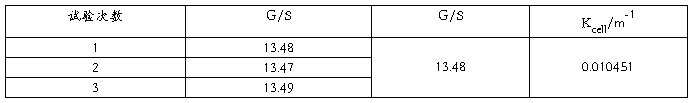
1.电导池常数Kcell
25℃时,10.00mol·m-3KCl溶液电导率: 0.140877S/m 。
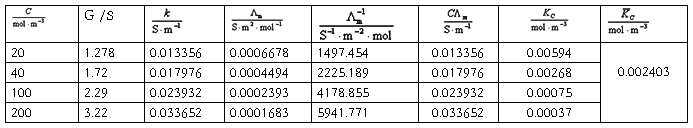
2.醋酸溶液的电离常数 HAc原始浓度: 0.1mol/l 。
3.按公式(6)以CΛm对 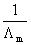 作图应得一直线,直线的斜率为
作图应得一直线,直线的斜率为 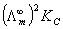 ,由此求得KC,并与上述结果进行比较。
,由此求得KC,并与上述结果进行比较。

利用斜率求得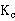 =0.0026,与上述计算接近。
=0.0026,与上述计算接近。
【思考问题】
1. 为什么要测电导池常数?如何得到该常数?
答:醋酸溶液的电离度可用电导法来测定 用一种已知电导率值的溶液先求出电导池常数Kcell
2.测电导时为什么要恒温?实验中测电导池常数和溶液电导,温度是否要一致?
答:减少误差,控制变量 不需要
-
实验四 醋酸解离常数的测定
实验四醋酸解离常数的测定一pH法一实验目的1学习溶液的配制方法及有关仪器的使用2学习醋酸解离常数的测定方法3学习酸度计的使用方法二…
-
无机化学实验六 醋酸电离度和电离常数的测定1
实验六醋酸电离度和电离常数的测定pH法一实验目的1测定醋酸的电离度和电离常数2学习pH计的使用教学重点醋酸的电离度电离常数的测定教…
-
电导法测定乙酸电离平衡常数 实验报告
物理化学实验报告姓名何思思班级工艺五班学号教师李慎新学院材料化学与工程学院10031010526电导法测定乙酸电离平衡常数一实验目…
-
醋酸电离度和电离常数的测定
实验题目醋酸电离度和电离常数的测定教材p5759一实验目的1测定醋酸的电离度和电离常数2掌握滴定原理滴定操作及正确判断滴定终点3练…
-
四川理工实验报告电导法测定乙酸电离平衡常数 (2)
实验六电导法测定乙酸电离平衡常数报告人曾辉实验时间20xx年03月07日一实验目的1掌握电导电导率摩尔电导率的概念以及它们之间的相…
-
第四版无机化学实验报告实验十三:醋酸解离度和解离常数的测定——pH计的使用
实验名称醋酸解离和解离常数的测定pH计的使用实验日期温度气压一实验目的1测定醋酸的解离度和解离常数2掌握滴定原理滴定操作及正确判断…
-
实验四 醋酸解离常数的测定
实验四醋酸解离常数的测定一pH法一实验目的1学习溶液的配制方法及有关仪器的使用2学习醋酸解离常数的测定方法3学习酸度计的使用方法二…
-
采用分光光度法测定弱电解质的电离常数实验报告
采用分光光度法测定弱电解质的电离常数实验报告一实验目的1了解一种测定弱电解质电离常数的方法2掌握分光光度计的测试原理和使用方法3进…
-
电导法测定乙酸电离平衡常数 实验报告
物理化学实验报告姓名何思思班级工艺五班学号教师李慎新学院材料化学与工程学院10031010526电导法测定乙酸电离平衡常数一实验目…
-
四川理工实验报告电导法测定乙酸电离平衡常数 (2)
实验六电导法测定乙酸电离平衡常数报告人曾辉实验时间20xx年03月07日一实验目的1掌握电导电导率摩尔电导率的概念以及它们之间的相…
-
食醋中总酸量的测定实验报告 (1)
食醋中总酸量的测定孟娟20xx级化学3班14小组4120xx49一实验目标1初步学会用传感器技术测定食醋中的总酸量2会组织中学生用…