实验二 考马斯亮蓝法测定蛋白质含量
实验二 考马斯亮蓝法(Bradford法)测定蛋白质含量
一、目的与要求
1. 掌握考马斯亮蓝染色法定量测定蛋白质含量的原理与方法
2. 熟练分光光度计的使用和操作方法。
二、实验原理
考马斯亮蓝G250测定蛋白质含量属于染料结合法的一种,它与蛋白质的疏水微区相结合,这种结合具有高敏感性。它在酸性溶液中呈棕红色,最大光吸收峰在465nm,当它与蛋白质结合形成复合物时,其最大吸收峰改变为595nm。考马斯亮蓝G-250—蛋白质复合物呈蓝色,在一定范围内,595nm下光密度与蛋白质含量呈线性关系,故可以用于蛋白质含量的测定。
考马斯亮蓝结合法是近年来发展起来的蛋白质定量测定法,本方法具有操作方便、快速、干扰因素少的特点。
附:
(一)、分光光度法原理:
光的吸收定律(朗伯-比尔定律):一束单色光(强度为I0)通过某吸光物质的溶液时,其光能量的被吸收与该物质浓度的关系符合朗伯—比尔定律即当入射光波长、温度和溶液的厚度一定时,吸光度与溶液的浓度成正比。
用公式表示为:T = I/I0 则 A = lg(1/T) =Kbc
式中 T — 透光率 I — 透过光强度 I0 — 入射光强度 A — 吸光度 K — 比例常数 b — 溶液的厚度 c — 溶液的浓度
(二)、离心机的使用说明:
1.要离心的离心管和管套要称重,重量不等时将水加在管套里。
2.离心管的放置是对角线放置,要求必须对称。
3. 先将离心机转速旋钮恢复到零刻度后,再定时间,定好时间后缓慢旋转转速旋钮,使离心机均匀的提速到预定转速。
(三)、分光光度计的使用说明:
1.接通电源开关,预热20min后,再选择须用的单色光波长。
2.放入已加入溶液的比色皿,盖上样品室盖,推动试样架拉手,使对照比色皿(溶液装入4/5高度,置第一格)置于光路上,调节100%透射比按钮,使吸光度值A=0.00。
3.推动试样架拉手,使样品比色皿置于光路上,读出吸光度值。
4.测量完毕,取出比色皿,洗净后置于乙醇溶液中浸泡脱色。
5.电源开关置于“关”,拔下电源插头。
三、试剂与器材
试剂:
1、0.9%NaCl 9g NaCl溶解在1L的容量瓶中。
2、标准蛋白质:称取50mg结晶牛血清蛋白定溶于50ml容量瓶里。
3、染液:考马斯亮蓝G-250 0.5g,溶于250mL95%乙醇,再加入500mL85%(W/V)磷酸,保存于棕色瓶中,称为母液。取150 mL然后加蒸馏水定容到1000mL,保存于棕色瓶中,备用。
器材:
试管;吸管10mL、l5mL、lmL、0.1mL;721分光光度计 四、操作方法
标准比较法测定样品提取液中蛋白质的含量
1.待测样品制备:称取新鲜豆芽2根,取其下胚轴,称重后放入研钵中,加5mL蒸馏水研磨成匀浆,转移到离心管中,再用5mL蒸馏水分两次次洗涤研钵,洗涤液收集于同一离心管中,然后在2000r/min离心5min,弃去沉淀,上清液转入10mL离心管中,并以蒸馏水定容至刻度,即得待测样品提取液。
2.取三只试管按照下表操作:
样品提取液(mL) 标准蛋白质(mL) 0.9%生理盐水(mL) 考马斯亮蓝(mL)
A595 3.结果计算
U待测管 0.1 0 0 3 放置5min
S 标准管
0 0.1 0 3 放置5min
B对照管
0 0 0.1 3 放置5min 调零
样品蛋白质含量(μg/g)= AU×结晶牛血清蛋白的含量(μg/ml)×提取液总体积(ml)
/AS×测定所须提取液体积(ml)×样品鲜重(g)
要点提示:
1.Bradford法由于染色方法简单迅速,干扰物质少,灵敏度高,现已广泛应用于蛋白质含量的测定。
2.有些阳离子,如K+ 、Na+ 、Mg2+ 、(NH4)2SO4、乙醇等物质不干扰测定,但大量的去污剂如TritonX-100、SDS等严重干扰测定。
3.蛋白质与考马斯亮蓝G-250结合的反应十分迅速,在2min左右反应达到平衡;其结合物在室温下1h内保持稳定。因此测定时,不可放置太长时间,否则将使测定结果偏低。
第二篇:实验七 考马斯亮蓝G250法测定的蛋白质含量
实验七 考马斯亮蓝G250法测定的蛋白质含量
一、试验目的
1. 学习分光光度计的原理及操作
- 学习利用染色方法提高蛋白质消光系数,以提高分光光度法检测灵敏度
二、基本原理
1. 根据物质的吸收光谱进行定性或定量分析的方法称为吸收光谱法或分光光度法 。该法所用的仪器称为分光光度计或吸收光谱仪。该法所使用的光谱范围包括可见光和紫外光,即包括波长在200 - 800 nm之间的光。
- 分光光度计灵敏度高,测定速度快,应用范围广,其中的紫外/可见分光光度技术更是生物化学研究工作中必不可少的基本手段之一。
3.紫外区可分为紫外(近紫外)和真空紫外(远紫外)。由于吸收池(又称样品池、比色杯等)和光学元件以及氧气能吸收小于190nm波长的光,因此常规紫外测定集中在近紫外区,即 200nm-400nm。可见光区为400nm -800nm。
4.考马斯亮蓝G250法
原理:考马斯亮蓝G250与蛋白质结合后,其最大吸收波长从465nm改变为595nm,该蛋白-染料复合物吸光系数很高,所以检测灵敏度很高,可以测定1μg /mL的蛋白质,染料和蛋白结合只需要2分钟,颜色在1小时内稳定。操作简便,快速,是常用的蛋白含量测定方法之一。去污剂,粘多糖等严重干扰该方法的测定
三、试剂
1. 标准蛋白质溶液:0.5mg/ml牛血清白蛋白溶液
2. 考马斯亮蓝G250蛋白染色剂:
四、操作步骤
1.标准曲线的绘制:
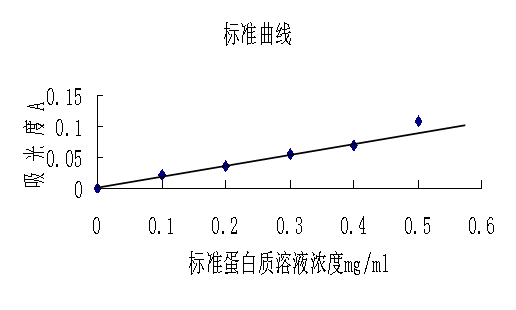
取6只试管,分别加入浓度为0,0.1,0.2,0.3,0.4,0.5mg/ml的标准蛋白质溶液0.1ml,然后加入5ml考马斯亮蓝试剂,震荡混匀,2分钟后于595nm测定吸光值,以蛋白质浓度为横坐标,光吸收值为纵坐标绘制标准曲线。
2.样品测定:
样品液0.1mL , 然后加入5ml考马斯亮蓝试剂,震荡混匀,2分钟后于595nm测定吸光值。从标准曲线中查出相应的浓度。
五、试验结果
1.数据记录

2.标准曲线的绘制
3.样品的测定
根据标准曲线可以找出样品对应的点(0.085,0.017),所以样品的浓度为0.085mg/ml。
六.结果讨论
注意事项:
1.分光光度计必须放置在固定而且不受震动的仪器台上,不能随意搬动。严防震动、潮湿和强光直射。
2.盛待测液时,必须达到比色杯2/3左右,不宜过多。若不慎使溶液流出比色杯外面,必须先用滤纸吸干,再用擦镜纸或绸布擦净才能放入比色杯槽内。移动比色杯槽要轻,以防溶液溅出,腐蚀机件。
3.千万不可用手、滤纸、毛刷等物摩擦比色杯光滑面。
4.用完比色杯后应立即用自来水冲洗,再用蒸馏水洗净。
5.每套分光光度计上的比色杯及比色槽不能随意更换。
-
实验考马斯亮蓝测蛋白质含量
实验7考马斯亮蓝考G250染色法测定蛋白质含量一目的1学习一种蛋白质染色测定的方法2掌握考马斯亮蓝法测定蛋白质含量的基本原理和方法…
-
蛋白质的定量测定---考马斯亮蓝法测定蛋白质浓度
实验名称蛋白质的定量测定考马斯亮蓝法测定蛋白质浓度实验原理考马斯亮蓝法测定蛋白质浓度是利用蛋白质燃料结合的原理考马斯亮蓝G250染…
-
蛋白质含量测定法考马斯亮蓝法
生物化学实验技术课程作业蛋白质含量测定法考马斯亮蓝法实验目的学习掌握考马斯亮蓝法Bradford法测定蛋白质含量的方法实验原理考马…
-
蛋白质浓度测定——考马斯亮蓝染色法(实验报告)
生物化学实验报告蛋白质浓度测定考马斯亮蓝染色法蛋白质浓度测定考马斯亮蓝染色法实验报告实验日期年月日实验温度室温实验地点生物化学与遗…
-
考马斯亮蓝法测定(实验报告)
考马斯亮蓝法测定苹果组织微量可溶性蛋白含量摘要本实验以苹果果肉为研究对象采取考马斯亮蓝比色法测定蛋白质的吸光度值通过对果实可溶性蛋…
-
生化综合实验报告--测定蛋白质含量的三种方法及其比较
本科学生综合性实验报告学号姓名学院专业班级实验课程名称测定蛋白质含量的三种方法及其比较教师及职称开课学期月云南师范大学教务处编印一…
-
考马斯亮蓝法测定(实验报告)
考马斯亮蓝法测定苹果组织微量可溶性蛋白含量摘要本实验以苹果果肉为研究对象采取考马斯亮蓝比色法测定蛋白质的吸光度值通过对果实可溶性蛋…
-
蛋白质浓度测定——考马斯亮蓝染色法(实验报告)
生物化学实验报告蛋白质浓度测定考马斯亮蓝染色法蛋白质浓度测定考马斯亮蓝染色法实验报告实验日期年月日实验温度室温实验地点生物化学与遗…
-
实验考马斯亮蓝测蛋白质含量
实验7考马斯亮蓝考G250染色法测定蛋白质含量一目的1学习一种蛋白质染色测定的方法2掌握考马斯亮蓝法测定蛋白质含量的基本原理和方法…
-
实验七 考马斯亮蓝G250法测定的蛋白质含量
实验七考马斯亮蓝G250法测定的蛋白质含量一试验目的1学习分光光度计的原理及操作2学习利用染色方法提高蛋白质消光系数以提高分光光度…
-
实验7 考马斯亮蓝G-250染色法
实验7考马斯亮蓝G250染色法测定蛋白质含量一目的1学习一种蛋白质染色测定的方法2掌握考马斯亮蓝法测定蛋白质含量的基本原理和方法二…