四大化学平衡的关系
关于四大化学平衡的关系的讨论报告
2010/12/11
崔怡凡 杨越 徐伟
北京大学生命科学学院
一、摘要
在化学学习中我们常常接触到四大化学平衡:酸碱平衡、氧化还原平衡、沉淀溶解平衡、配位平衡,四种化学平衡相互影响,相互作用,在分析一个化学反应时很有必要从四个平衡的相互影响讨论,从而得到更接近实验事实的结论。另外,从四种化学平衡相互影响的角度分析实验现象亦有助于对实验的理解。
二、引言
四种化学平衡广泛存在于各种化学反应中,相互影响,相互作用。本讨论报告拟结合本实验的现象及有关理论,主要分析说明酸碱平衡、氧化还原平衡、沉淀溶解平衡等三大平衡对配位平衡的影响。
三、内容
1. 酸碱平衡和配位平衡的关系
以实验2-1为例,取1mL0.2mol/LCuSO4溶液于试管中,逐滴加入2ml/L氨水
直到沉淀溶解为止,再逐滴加入2mol/LH2SO4。
?向CuSO4中加入氨水生成Cu(NH3)24:
Cu(NH3)42??2????Cu+4NH3 在水溶液中存在配位平衡Cu(NH3)24
???NH4?OH 氨水存在电离平衡NH3?H2O??
加入H2SO4后,H?与氨水电离出的OH?反应,使氨水的电离平衡向右移动,从
2?)Cu(NH)而增大(NH?,使(形成434的配位平衡向左移动,从而形成沉淀析出。
的沉淀会在酸中溶解,此处略去不提)相应地,氨根离子的水解平衡、氨水的电离平衡等酸碱平衡也会受到影响。
故配位平衡会受到酸碱平衡的影响。当配离子或中心离子可以和H?或OH?结合时,配位平衡就会受到酸碱平衡的影响。如果这些H?或OH?是由弱酸弱碱电离或是盐类水解而产生的,那么相应的平衡也会受到配位平衡的影响。
2.氧化还原平衡和配位平衡的关系
以实验4为例,往5滴0.1mol/LKI中加入5滴0.1mol/LFeCl3溶液,再加入CCl4观察,再加入10%饱和NH4F溶液,观察。
KI中加入FeCl3溶液,存在氧化还原平衡:Fe3??I???Fe?2??I2
3?加入NH4F溶液后,存在配位平衡:Fe3??6F????FeF6
随着NH4F的加入,(F?)逐渐增大,(Fe3?)会相应减少,氧化还原平衡向左移动,
使溶液颜色褪色并最终达到平衡。
故配位平衡和氧化还原平衡相互影响。当配位平衡中某成分同时在氧化还原平衡中时,它便会充当两种平衡联系的桥梁,促使其相互影响。
3.沉淀溶解平衡和配位平衡的关系
?以实验3-1为例,在新制Cu(NH3)2溶液中逐滴加入0.1mol/LNa2S溶液,观察4
是否有沉淀产生。
Cu(NH3)42??2?溶液中存在配位平衡Cu(NH3)2???Cu+4NH3 4
?CuS 加入Na2S后存在沉淀溶解平衡:Cu2??S2???
随着Na2S的加入,配位平衡中的Cu2?与S2?反应生成沉淀,(Cu2?)逐渐减少,
配位平衡向右移动直至再次平衡。
故配位平衡和沉淀溶解平衡相互影响。当配位平衡中某种物质可与沉淀剂形成沉淀时两种平衡便会相互作用,最后达到新的平衡。
一个反应体系中往往不止存在一种平衡,在两个甚至两个以上平衡的反应体系中,这些平衡会相互影响,达到新的平衡。研究一个化学反应时应充分考虑几
种平衡间的影响,判断反应的限度时可通过各平衡的平衡常数求出K总进行判断。
四、结论
四大平衡相互影响,在比较复杂的反应重要考虑多种平衡对反应的影响,在判断反应限度时可通过总反应的K值判断。
五、参考文献
华彤文,陈景祖.普通化学原理[M].北京:北京大学出版社.2005.
六、小组分工表

第二篇:化学选修四第三章水溶液中的离子平衡检测题
必修四第三章检测题
一、选择题(单选)
1.下列物质在水溶液中,存在电离平衡的是 ( )
A.Ca(OH)2 B.CH3COOH C.BaSO4 D.CH3COONa
2.下列关于强、弱电解质的叙述,有错误的是 ( )
A.强电解质在溶液中完全电离,不存在电离平衡
B.在溶液中,导电能力强的电解质是强电解质,导电能力弱的电解质是弱电解质
C.同一弱电解质的溶液,当温度、浓度不同时,其导电能力也不同
D.纯净的强电解质在液态时,有的导电,有的不导电
3.在0.1mol/L的CH3COOH溶液中存在如下电离平衡 ( )
CH3COOH CH3COO-+H+ 对于该平衡,下列叙述正确的是
CH3COO-+H+ 对于该平衡,下列叙述正确的是
A.加入少量NaOH固体,平衡向正反应方向移动
B.加水,反应速率增大,平衡向逆反应方向移动
C.滴加少量0.1mol/LHCl溶液,溶液中C(H+)减少
D.加入少量CH3COONa固体,平衡向正反应方向移动
4.下列说法中,正确的是 ( )
A.强电解质的水溶液一定比弱电解质溶液的导电能力强
B.强电解质都是离子化合物,弱电解质都是共价化合物
C.强电解质的水溶液中不存在溶质分子
D.不溶性盐都是弱电解质,可溶性酸和具有极性键的化合物都是强电解质。
5.水的电离过程为H2O H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,
H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,
K(35℃)=2.1×10-14。则下列叙述正确的是 ( )
A.C(H+)随着温度升高而降低 B.35℃时,c(H+)>c(OH-)
C.水的电离度 >
>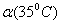 D.水的电离是吸热的
D.水的电离是吸热的
6.室温时,下列混合溶液的pH一定小于7的是
A.pH=3的盐酸和pH=11的氨水等体积混合
B.pH=3的盐故和 pH=11的氢氧化钡溶液等体积混合
C.pH=3的醋酸和 pH=11 的氢氧化钡溶液等体积混合
D.pH=3的硫酸和 pH=11的氨水等体积混合
7.现有强酸甲溶液的pH=1,强酸乙溶液的pH=2,则酸甲与酸乙的物质的量浓度之比不可能的是 ( )
A.2∶1 B.5∶1 C.10∶1 D.20∶1
8.常温下,将0.1mol/L盐酸和0.06mol/LBa(OH)2等体积混合,混合溶液的pH是( )
A.1.7 B.12.3 C.12 D.2
9.25℃时,向V mL pH = a的盐酸中,滴加10V mL pH = b的NaOH溶液,所得溶液中Cl-的物质的量恰好等于Na+的物质的量,则a + b的值是 ( )
A. 15 B. 14 C. 13 D. 不能确定
10.用标准NaOH溶液滴定未知浓度的盐酸,用酚酞作指示剂,下列操作中会导致实验结果偏低的是 ①碱式滴定管用蒸馏水洗净后没有用标准液润洗
②用酸式滴定管加待测液时,刚用蒸馏水洗净后的滴定管未用待测液润洗
③锥形瓶用蒸馏水洗净后没有用待测液润洗
④滴定前滴定管尖端有气泡,滴定后气泡消失
⑤终点读数时俯视,其他读数方法正确 ( )
A.④⑤ B.①④ C.②③⑤ D.②⑤
11.在25℃时将pH=11 的NaOH 溶液与pH=3 的CH3COOH溶掖等体积混合后,下列关系式中正确的是 ( )
A.c (Na+)==c(CH3COO-)+c(CH3COOH)
B.c(H+)==c(CH3COO-)+c(OH一)
C.c (Na+) > c (CH3COO-)>c(OH-)>c(H+)
D.c (CH3COO-)>c(Na+)>c(H+)>c(OH-)
12.25℃时,在浓度为1 mol·L-1的(NH4)2SO4、(NH4)2 CO3、(NH4)2Fe(SO4)2的溶液中,测得c(NH4+)分别为a、b、c(单位为mol·L-1)。下列判断正确的是 ( )
A.a=b=c B.a>b>c C.a>c>b D.c>a>b
13.在由水电离产生的H+浓度为1×10-13mol/L的溶液中,一定能大量共存的离子组( )
① K+、Cl-、NO3-、S2- ② K+、Fe2+、I-、SO42- ③ Na+、Cl-、NO3-、SO42-
④Na+、Ca2+、Cl-、HCO3- ⑤ K+、Ba2+、Cl-、NO3-
A.①③ B.③⑤ C.③④ D.②⑤
14.常温下pH=3的二元弱酸H2R溶液与a L pH=11的NaOH溶液混合后,混合液的pH刚好等于7(假设反应前后体积不变),则对反应后混合液的叙述正确的是
A.c(R2-)+ c(OH-)=c(Na+)+c(H+) B.c(R2-)>c(Na+)>c(H+)=c(OH-)
C.2c(R2-)+ c(HR-)=c(Na+) D.混合后溶液的体积为2aL
15.有关AgCl沉淀的溶解平衡说法正确的是 ( )
A.AgCl沉淀生成和沉淀溶解不断进行,但速率相等
B.AgCl难溶于水,溶液中没有Ag+和Cl- C.升高温度,AgCl沉淀的溶解度增大
D.向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度不变
16.在100ml0.01mol/LKCl溶液中,加入1ml0.01mol/LAgNO3溶液,下列说法正确的是(AgCl的Ksp=1.8×10-10) ( )
A.有AgCl沉淀析出 B.无AgCl沉淀 C.有沉淀,但不是 AgCl D.无法确定
17.将足量BaCO3分别加入:① 30mL 水 ②10mL 0.2mol/LNa2CO3溶液 ③50mL 0.01mol/L 氯化钡溶液 ④100mL 0.01mol/L盐酸中溶解至溶液饱和。请确定各溶液中Ba2+的浓度由大到小的顺序为 ( )
A.①②③④ B..③④①② C.④③①② D.②①④③
18.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa固体
⑤NaNO3固体 ⑥KCl溶液
A.②④⑥ B.①② C.②③⑤ D.②④⑤⑥
19.25℃时,在某物质的溶液中,由水电离出的c(H+)=1×10-a mol/L,下列说法正确的是
A.a<7时,水的电离受到抑制 B.a>7时,水的电离受到抑制
C.a<7时,溶液的pH一定为a D.a>7时,溶液的pH一定为14-a
20.下列事实,可以证明氨水是弱碱的是
A.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁 B.铵盐受热易分解
C.0.1mol/L的氨水可以使酚酞试液变红 D.0.1mol/L的NH4Cl溶液的pH约为5
21.下列说法正确的是
A 在Na2CO3、NaHCO3两溶液中,离子种类不相同
B 在等体积、等物质的量浓度的Na2CO3、NaHCO3两溶液中,阳离子总数相等
C NaHCO3和Na2CO3混合液中一定有
c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-)
D 在NaHCO3和Na2CO3混合液中一定有
2c(Na+)=3[c(HCO3-)+c(CO32-)+c(H2CO3)]
22.已知25 ℃ 时,AgCl 的溶度积Ksp=1.8×10-10,则下列说法正确的是
A.向饱和AgCl水溶液中加入盐酸,Ksp值变大
B.AgNO3溶液与NaCl溶液混合后的溶液中,;一定有c(Ag+)=c(Cl-)
C.温度一定时,当溶液中c(Ag+)×c(Cl-)=Ksp时,此溶液为AgCl的饱和溶液
D.将固体AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,AgCl溶解度小于AgI
23.已知NaHSO4在水中的电离方程式为:NaHSO4=Na++H++SO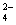 。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列不正确的是
。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列不正确的是
A.该温度高于25℃ B.由水电离出来的H+的浓度是1.0×10-10mol·L-1
C.NaHSO4晶体的加入抑制了水的电离
D.该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性
24. 某学生的实验报告所列出的下列数据中合理的是
A.用10mL量筒量取7.13mL稀盐酸 B.用酸度计测得某稀盐酸的pH为1.54
C.用广泛pH试纸测得某溶液的pH为2.3 D.用精密pH试纸测得某烧碱溶液的pH为13.15
25.将pH=3的盐酸溶液和pH=11的氨水等体积混合后,溶液中离子浓度关系正确的是
A.C(NH4+)>C(Cl–)>C(H+)>C(OH–) B.C(NH4+)>C(Cl–)>C(OH–)>C(H+)
C.C(Cl–)>C(NH4+)>C(H+)>C(OH–) D.C(Cl–)>C(NH4+)>C(OH–)>C(H+)
选择题答题卡
二、填空题
26.今有①CH3COOH;②HCl;③H2SO4三种溶液,选择填空:
A.①>②>③ B.①<②<③ C.①=②=③ E.①>②=③
D.①=③>② F.①<②=③ G.①=②<③ H.①=②>③
(1)当它们pH相同时,其物质的量浓度关系是 。
(2)当它们的物质的量浓度相同时,其pH的关系是 。
(3)中和等体积、等物质的量浓度的烧碱溶液,需同物质的量浓度的三种酸溶液的体积关系为 。
(4)体积和物质的量浓度相同的①、②、③三溶液,分别与同浓度的烧碱溶液反应,要使反应后的溶液呈中性,所需烧碱溶液的体积关系为 。
(5)当它们pH相同、体积相同时,分别加入足量锌,相同状况下产生气体体积关系为 。
(6)当它们pH相同、体积相同时,同时加入锌,则开始时反应速率 ,若产生相同体积的气体(相同状况),所需时间 。
(7)将pH相同的三种酸均稀释10倍后,pH关系为 。
27.用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
(1)准确称取4.1g烧碱样品,所用主要仪器是 。
(2)将样品配成250mL待测液,需要的仪器有 。
(3)取10.00mL待测液,用 量取。
(4)用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,滴定时 手旋转 式滴定管的玻璃活塞, 手不停地摇动锥形瓶,两眼注视 ,直到滴定终点。
(5)根据下列数据,计算待测烧碱溶液的浓度: 。

28.25℃时,将0.01 mol CH3COONa 和0.002 mol HCl溶于水,形成1L混合溶液:
(1)该溶液中存在三个平衡体系,用电离方程式或离子方程式表示:
① ②
③ 。
(2)溶液中共有 种不同的粒子(指分子和离子)。
(3)在这些粒子中,浓度为0.01 mol/L的是 ,浓度为0.002 mol/L的是 。
(4)在上述溶液中,存在的两个守恒关系是:质量守恒 ,
电荷守恒 。
29.在25℃时,PH=4的HCl溶液和PH=4的NH4Cl溶液中OH-浓度各为多少?在上述两溶液中,NH4Cl溶液中由水电离出的的浓度是HCl溶液中由水电离出的OH-浓度的多少倍?
-
化学平衡公开课教学反思
化学平衡公开课教学反思教学反思化学平衡是中学化学的重要理论知识在中学化学理论中占重要地位它的大部分知识内容抽象理论性很强学生学起来…
-
高中化学化学平衡教学反思
高中化学化学平衡教学反思化学平衡是中学化学的重要理论知识但它大部分知识较抽象理论性强化学平衡这一知识点可以说是高中化学是最难的一个…
-
化学平衡教学反思
化学平衡反思1可逆反应两特点学生掌握得好火箭班可以少的练习正逆两个反应是同一条件下同时进行的正逆反应中反应物生成物共存反应物转化率…
-
高二化学平衡教学反思
高二化学平衡教学反思曾宪基对化学平衡这节课从教学目标的达成来看我觉得基本完成了教学任务而且网络资源的辅助性和必要性在这节课上得到了…
-
化学平衡教学反思
高二化学平衡教学反思都昌一中汪会忠对化学平衡这节课从教学目标的达成来看我觉得基本完成了教学任务而且网络资源的辅助性和必要性在这节课…
-
校际交流活动总结
姜志勇我校自建校以来,为加强学校之间的交流和合作,提高我校教师课堂教学水平,在学校领导的带领下和丹寨民高举行了校际交流活动。现将本…
-
20xx-20xx第一学期生化教研组工作总结
20xx~20xx学年度第一学期生化教研组工作总结为了深化教育改革、全面推进素质教育,以实施新课程标准,新课程教育改革活动的开展为…
-
小学五年级信息技术教学工作总结
信息技术教学工作总结教师:张尚伶这学期我担任五年级2个班的信息技术课,每周每班一课时,是小学阶段的必修课程,该课程的开设对于学生信…
-
初一英语教育实习工作总结
实习学校:海南省海口市第十中学实习时间:20xx.10.9—20xx.12.08指导教师:黄沈指导班主任:梁老师实习导师:韩刚实习…
-
生活委员月工作总结
生活委员工作报告斗转星移,时间飞逝,不觉中大二上学期的第二个月已经结束了。作为10级工业设计一班的生活委员,我在上个月的工作中感触…