高一化学专题 氧化还原反应练习题(精品免费)
专题训练氧化还原反应
[1].以油类为溶剂的防锈漆称为油基防锈漆,由于环保方面的原因,目前要推广使用水基防锈漆,但水基漆较易溶解O2,在干燥之前易导致金属表面产生锈斑,为此要在水基漆中加入缓蚀剂,以下可作为缓蚀剂添加的是( )
A.KMnO4 B.NaNO2 C.FeCl3 D.HNO3
[2].下列物质转化需要加入还原剂才能实现的是( )
A.SO32-→SO2 B.HCl→Cl2 C.Na→Na+ D.SO2→S
[3].下列反应所生成的气体中,含有被还原的元素是( )
A.炭粉和二氧化硅均匀混和后强热 B.石英和纯碱均匀混和后强热
C.铜片放入浓硫酸中加热 D.铝粉放入氢氧化钾溶液中振荡
[4].已知:2Fe+3Br2=2FeBr3 2Fe3++2I—=2Fe2++I2,现将Fe(NO3)2溶液分别滴入到以下溶液中:①H2SO4 ②HNO3 ③溴水 ④碘水,其中能使Fe2+转变成Fe3+的是( )
A.只有②③ B.①②③ C.②③④ D.全部
[5].下列反应中有一种物质既是氧化剂又是还原剂的是( )
A.2KI+Br2=2KBr+I2 B.2AgNO3 2Ag+2NO2↑+O2↑
2Ag+2NO2↑+O2↑
C.Cu2(OH)2CO3 2CuO+CO2↑+H2O D.2Na2O2+2H2O=4NaOH+O2↑
2CuO+CO2↑+H2O D.2Na2O2+2H2O=4NaOH+O2↑
[6].下列反应中,水既不是氧化剂,也不是还原剂,但反应是氧化还原反应的是( )
A.2Na2O2+2H2O=4NaOH+O2↑ B.C+H2O CO+H2
CO+H2
C.Cl2+H2O=HCl+HClO D.2F2+2H2O=4HF+O2
[7].有甲、乙、丙、丁四种金属,仅甲在自然界主要以游离态存在;丙盐的水溶液不能用丁制的容器盛放;丁与乙盐的水溶液不反应。则这四种金属的活动性由强到弱的顺序可能是( )
A.甲乙丙丁 B.丁乙丙甲 C.丙乙丁甲 D.乙丁丙甲
[8].在反应3BrF3+5H2O=HBrO3+Br2+9HF+O2中,若有5mol水发生氧化反应,则被还原的BrF3物质的量为( )
A.2mol B.5mol C.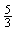 mol D.
mol D.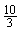 mol
mol
[9].单质A能从盐溶液中置换出单质B,则下列说法不正确的是( )
A.A、B都是金属时,A一定比B的金属活动性强
B.当A、B都是非金属时,A一定比B的非金属活动性强
C.当A是金属时,B可能是金属,也可能是非金属
D.当A是非金属时,B可能是非金属,也可能是金属
[10].下列叙述中正确的是( )
A.阳离子只有氧化性,阴离子只有还原性
B.含氧酸可作氧化剂而无氧酸则不能
C.失电子难的原子获得电子的能力就强
D.氯气分子可作氧化剂,但也可被其他氧化剂所氧化
[11].下列说法中正确的是( )
A.强氧化剂和弱还原剂易发生氧化还原反应
B.实验室制氯气的反应中,氯离子通过还原反应生成氯气
C.由HgCl2生成Hg2Cl2时,汞元素被还原了
D.I-、Br-、Cl-的还原性依次减弱,氧化性依次增强
[12].C1SO3H称为氯磺酸,是一种强酸。对于反应:ClSO3H+HCOOH=CO+HCl+H2SO4有如下判断,其中较合理的是( )
A.此反应属于氧化还原反应 B.此反应不属于氧化还原反应
C.反应后溶液的pH值变小 D.反应后溶液的pH值增大
[13].在一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则与1mol Cr3+反应所需PbO2的物质的量为( )
A.3.0mol B.1.5mol C.1.0mol D.0.75mol
[14].R2O8n-离子在一定条件下可以把Mn2+离子氧化为MnO4-,若反应后R2O8n-离子变为RO42-离子,又知反应中氧化剂与还原剂的物质的量之比为5:2,则n值是( )
A.4 B.3 C.2 D.1
[15].已知A2O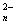 可将B2-氧化为B单质,A2O
可将B2-氧化为B单质,A2O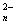 则被还原为A3+,又知100mL的0.3mol/L的A2O
则被还原为A3+,又知100mL的0.3mol/L的A2O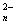 与150mL的0.6mol/L B2-恰好完全反应,则A2O
与150mL的0.6mol/L B2-恰好完全反应,则A2O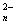 中的n值为( )
中的n值为( )
A.4 B.5 C.6 D.7
[16].已知Cu2S与某浓度的硝酸反应时,生成硝酸铜和硫酸,若反应中Cu2S与HNO3的物质的量之比为2:13,则该反应的还原产物为( )
A.N2O B.NO C.NO2 D.N2O3
[17].在KI和KIO3混合溶液中通入H2S发生反应后,生成碘、硫酸钾和水,在此反应中被氧化的碘元素与被还原的碘元素的物质的量之比为( )
A.5:1 B.1:1 C.1:3 D.1:5
[18].臭氧可以使湿润的淀粉碘化钾试纸变蓝,化学方程式为:KI+O3+H2O→KOH+I2 +O2(未配平),下列叙述正确的是( )
A.O3在反应中被还原为O2 B.该反应的还原产物为I2
C.1mol O3在反应中得到2mol电子 D.反应中氧化产物与还原产物物质的量之比为1:3
[19].实验室可通过以下反应来制取碘:2NO+O2=2NO2;2H++2I-+NO2=NO+I2+H2O。在这一过程中,每制取1mol I2时,所消耗氧化剂的质量是( )
A.16g B.28g C.32g D.46g
[20].根据下表下列叙述中正确的是( )
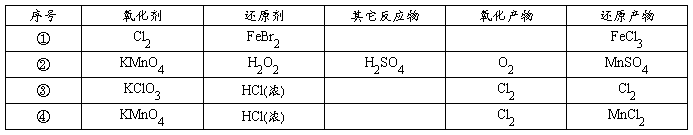
A.表中第①组反应的氧化产物一定只有FeCl3(实为Fe3+)
B.氧化性比较:KMnO4>Cl2>Fe3+>Br2>Fe2+
C.还原性比较:H2O2>Mn2+>Cl-
D.④的离子方程式配平后,H+的化学计量数为16
[21].在铁与铜的混和物中,加入不足量的稀硝酸,充分反应后剩余金属m1g,再向其中加入一定量的稀硫酸,充分振荡后,剩余金属m2g,m1与m2的关系是
A.m1一定大于m2 B.m1可能等于m2
C.m1一定等于m2 D.m1可能大于m2
[22].有A、B、C、D四种金属,将A、B用导线连接后浸入稀H2SO4中,A上放出氢气,B逐渐溶解生成B2+;电解含A2+和C2+的混合溶液时,阴极上先析出C;将D放入含B2+的硝酸溶液中,D表面有B析出,同时生成D2+。则这四种金属阳离子的氧化性由强到弱的顺序是:
。
[23].KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,其变化可表述为
____KClO3+____HCl(浓)=____KCl+____ClO2↑+____Cl2↑+____H2O
(1) 请配平上述化学方程式。
(2) 浓盐酸在反应中显示出来的性质是________(填编号)
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3) 产生0.1mol Cl2,则转移的电子的物质的量为________mol。
(4) 氧化剂是________,还原剂是________;氧化产物是________,还原产物是________。
[24].某化学反应的反应物和产物为:KMnO4 + KI + H2SO4 → MnSO4 + I2 + KIO3 + K2SO4 + H2O
(1) 该反应的氧化剂是
(2) 如果该反应方程式中I2和KIO3的系数都是5
①KMnO4的系数是
②在给出的化学式上标出电子转移的方向和数目: KMnO4 + KI + H2SO4 →
(3) 如果没有对该方程式中的某些系数作限定,可能的配平系数有许多组。原因是_____________
 ____________________________________________________________。
____________________________________________________________。
[25].A、B、C、D、E是中学化学中常见的五种化合物,它们分别由两种元素组成。甲、乙、丙、丁是单质,甲、丙、A、C、D常温下均为气体,B是液体,E是黑色固体,这些单质和化合物之间存在如下关系(反应条件均无注明):
(1) 写出下列物质的分子式:甲 、B 。
(2) 在以上有关转化的反应中充当还原剂的物质有 (填写化学式)。
(3) 写出化合物A的电子式 。
(4) 写出单质丁跟化合物B反应生成化合物E的化学方程式:______________________________。
[26].当140g铁粉跟213g氯气充分反应后,加入适量的水,完全溶解后无残余固体,加入稀释至2L。
(1) 求溶液中氯化铁的物质的量浓度。
(2) 若要求溶液中只含溶质氯化铁,还需在此溶液通入标准状况下的氯气多少升?
[27].黄铜矿(主要成分CuFeS2)是提取铜的主要原料
(1) 取12.5g黄铜矿样品,经测定含3.60g硫(杂质不含硫),矿样中CuFeS2含量为_______。
(2) 已知:2CuFeS2+4O2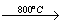 Cu2S+3SO2+2FeO(炉渣)
Cu2S+3SO2+2FeO(炉渣)
产物Cu2S在1200℃高温下继续反应:2Cu2S+3O2→2Cu2O+2SO2 2Cu2O+Cu2S→6Cu+SO2
假定各步反应都完全,完成下列计算:
①由6mol CuFeS2生成6mol Cu,求消耗O2的物质的量。
②6mol CuFeS2和14.25mol O2反应,理论上可得到多少摩尔铜?
③6mol CuFeS2和15.75 mol O2反应,理论上可得到多少摩尔铜?
[1] B
[2] D
[3] CD
[4] B
[5] BD
[6] AC
[7] D
[8] B
[9] D
[10] D
[11] C
[12] BC
[13] B
[14] C R ↓(8- -6)×2×5 Mn ↑5×2
-6)×2×5 Mn ↑5×2
[15] D A ↓(n-1-3)×2×1 B ↑2×3
[16] A Cu ↑1×2×2 S ↑8×2 N ↓(5-x)×(13-2×2×2) 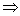 x=1
x=1
[17] D S ↑8x I ↑y I ↓5z 8x+y=5z、y+z=2x(K守恒)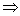 y:z=1:5
y:z=1:5
[18] C
[19] A
[20] D
[21] A 原溶液中有NO3-存在,当加入稀硫酸时,酸性增加,剩余的金属将继续与溶液反应而使最后剩余的金属质量减小
[22] C2+>A2+>B2+>D2+
[23] (1)2,4=2,2,1,2; (2)②; (3)0.2 (4)KClO3 ;HCl;Cl2;ClO2
[24] (1)KMnO4
(2)① 8 【配平后系数依次为8、15、17、8、5、5、9、17】 ②
(3)该反应式含两种氧化产物,两者的比例和氧化剂的用量都可以发生变化
【有两种氧化产物,分别对应两个不同的系数,比例不同时,两者的量就不同,所以有无数组】
[25] (1)O2、H2O (2)CO、H2、Fe、H2S、C (3)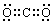
(4)3Fe+4H2O Fe3O4+4H2
Fe3O4+4H2
[26] (1)2Fe+3Cl2=2FeCl3 Fe+2FeCl3=3FeCl2
2 3 2 0.5 1 1.5 C(FeCl3)=0.50mol/L
(2)只含FeCl3 Cl―共7.5mol还需1.5molCl― 即0.75mol Cl2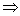 16.8L
16.8L
[27] (1)12.5×x× =3.6 x=82.8%
=3.6 x=82.8%
(2)①2CuFeS2~4O2~Cu2S Cu2S+O2→2Cu+SO2
6 12 3 3 3 n(O2)=15mol
②O2不足量 2Cu2S+3O2→2Cu2O+2SO2 2Cu2O+Cu2S→6Cu+SO2
1.5 2.25 1.5 1.5 过量 4.5 n(Cu)=4.5mol
③O2过量 2Cu2S+3O2→2Cu2O+2SO2 2Cu2O+Cu2S→6Cu+SO2
2.5 3.75 2.5 过量 0.5 3 n(Cu)=3mol
第二篇:高一化学专题复习_氧化还原反应练习题
专题训练氧化还原反应
[1].以油类为溶剂的防锈漆称为油基防锈漆,由于环保方面的原因,目前要推广使用水基防锈漆,但水基漆较易溶解O2,在干燥之前易导致金属表面产生锈斑,为此要在水基漆中加入缓蚀剂,以下可作为缓蚀剂添加的是( )
A.KMnO4 B.NaNO2 C.FeCl3 D.HNO3
[2].下列物质转化需要加入还原剂才能实现的是( )
A.SO32-→SO2 B.HCl→Cl2 C.Na→Na+ D.SO2→S
[3].下列反应所生成的气体中,含有被还原的元素是( )
A.炭粉和二氧化硅均匀混和后强热 B.石英和纯碱均匀混和后强热
C.铜片放入浓硫酸中加热 D.铝粉放入氢氧化钾溶液中振荡
[4].已知:2Fe+3Br2=2FeBr3 2Fe3++2I—=2Fe2++I2,现将Fe(NO3)2溶液分别滴入到以下溶液中:①H2SO4 ②HNO3 ③溴水 ④碘水,其中能使Fe2+转变成Fe3+的是( )
A.只有②③ B.①②③ C.②③④ D.全部
[5].下列反应中有一种物质既是氧化剂又是还原剂的是( )
A.2KI+Br2=2KBr+I2 B.2AgNO3 2Ag+2NO2↑+O2↑
2Ag+2NO2↑+O2↑
C.Cu2(OH)2CO3 2CuO+CO2↑+H2O D.2Na2O2+2H2O=4NaOH+O2↑
2CuO+CO2↑+H2O D.2Na2O2+2H2O=4NaOH+O2↑
[6].下列反应中,水既不是氧化剂,也不是还原剂,但反应是氧化还原反应的是( )
A.2Na2O2+2H2O=4NaOH+O2↑ B.C+H2O CO+H2
CO+H2
C.Cl2+H2O=HCl+HClO D.2F2+2H2O=4HF+O2
[7].有甲、乙、丙、丁四种金属,仅甲在自然界主要以游离态存在;丙盐的水溶液不能用丁制的容器盛放;丁与乙盐的水溶液不反应。则这四种金属的活动性由强到弱的顺序可能是( )
A.甲乙丙丁 B.丁乙丙甲 C.丙乙丁甲 D.乙丁丙甲
[8].在反应3BrF3+5H2O=HBrO3+Br2+9HF+O2中,若有5mol水发生氧化反应,则被还原的BrF3物质的量为( )
A.2mol B.5mol C.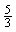 mol D.
mol D.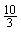 mol
mol
[9].单质A能从盐溶液中置换出单质B,则下列说法不正确的是( )
A.A、B都是金属时,A一定比B的金属活动性强
B.当A、B都是非金属时,A一定比B的非金属活动性强
C.当A是金属时,B可能是金属,也可能是非金属
D.当A是非金属时,B可能是非金属,也可能是金属
[10].下列叙述中正确的是( )
A.阳离子只有氧化性,阴离子只有还原性
B.含氧酸可作氧化剂而无氧酸则不能
C.失电子难的原子获得电子的能力就强
D.氯气分子可作氧化剂,但也可被其他氧化剂所氧化
[11].下列说法中正确的是( )
A.强氧化剂和弱还原剂易发生氧化还原反应
B.实验室制氯气的反应中,氯离子通过还原反应生成氯气
C.由HgCl2生成Hg2Cl2时,汞元素被还原了
D.I-、Br-、Cl-的还原性依次减弱,氧化性依次增强
[12].C1SO3H称为氯磺酸,是一种强酸。对于反应:ClSO3H+HCOOH=CO+HCl+H2SO4有如下判断,其中较合理的是( )
A.此反应属于氧化还原反应 B.此反应不属于氧化还原反应
C.反应后溶液的pH值变小 D.反应后溶液的pH值增大
[13].在一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则与1mol Cr3+反应所需PbO2的物质的量为( )
A.3.0mol B.1.5mol C.1.0mol D.0.75mol
[14].R2O8n-离子在一定条件下可以把Mn2+离子氧化为MnO4-,若反应后R2O8n-离子变为RO42-离子,又知反应中氧化剂与还原剂的物质的量之比为5:2,则n值是( )
A.4 B.3 C.2 D.1
[15].已知A2O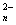 可将B2-氧化为B单质,A2O
可将B2-氧化为B单质,A2O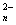 则被还原为A3+,又知100mL的0.3mol/L的A2O
则被还原为A3+,又知100mL的0.3mol/L的A2O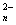 与150mL的0.6mol/L B2-恰好完全反应,则A2O
与150mL的0.6mol/L B2-恰好完全反应,则A2O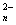 中的n值为( )
中的n值为( )
A.4 B.5 C.6 D.7
[16].已知Cu2S与某浓度的硝酸反应时,生成硝酸铜和硫酸,若反应中Cu2S与HNO3的物质的量之比为2:13,则该反应的还原产物为( )
A.N2O B.NO C.NO2 D.N2O3
[17].在KI和KIO3混合溶液中通入H2S发生反应后,生成碘、硫酸钾和水,在此反应中被氧化的碘元素与被还原的碘元素的物质的量之比为( )
A.5:1 B.1:1 C.1:3 D.1:5
[18].臭氧可以使湿润的淀粉碘化钾试纸变蓝,化学方程式为:KI+O3+H2O→KOH+I2 +O2(未配平),下列叙述正确的是( )
A.O3在反应中被还原为O2 B.该反应的还原产物为I2
C.1mol O3在反应中得到2mol电子 D.反应中氧化产物与还原产物物质的量之比为1:3
[19].实验室可通过以下反应来制取碘:2NO+O2=2NO2;2H++2I-+NO2=NO+I2+H2O。在这一过程中,每制取1mol I2时,所消耗氧化剂的质量是( )
A.16g B.28g C.32g D.46g
[20].根据下表下列叙述中正确的是( )
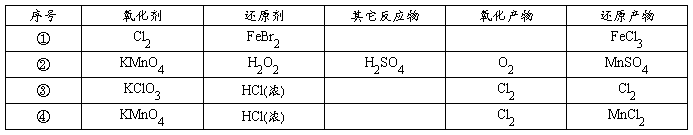
A.表中第①组反应的氧化产物一定只有FeCl3(实为Fe3+)
B.氧化性比较:KMnO4>Cl2>Fe3+>Br2>Fe2+
C.还原性比较:H2O2>Mn2+>Cl-
D.④的离子方程式配平后,H+的化学计量数为16
[21].在铁与铜的混和物中,加入不足量的稀硝酸,充分反应后剩余金属m1g,再向其中加入一定量的稀硫酸,充分振荡后,剩余金属m2g,m1与m2的关系是
A.m1一定大于m2 B.m1可能等于m2
C.m1一定等于m2 D.m1可能大于m2
[22].有A、B、C、D四种金属,将A、B用导线连接后浸入稀H2SO4中,A上放出氢气,B逐渐溶解生成B2+;电解含A2+和C2+的混合溶液时,阴极上先析出C;将D放入含B2+的硝酸溶液中,D表面有B析出,同时生成D2+。则这四种金属阳离子的氧化性由强到弱的顺序是:
。
[23].KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,其变化可表述为
____KClO3+____HCl(浓)=____KCl+____ClO2↑+____Cl2↑+____H2O
(1) 请配平上述化学方程式。
(2) 浓盐酸在反应中显示出来的性质是________(填编号)
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3) 产生0.1mol Cl2,则转移的电子的物质的量为________mol。
(4) 氧化剂是________,还原剂是________;氧化产物是________,还原产物是________。
[24].某化学反应的反应物和产物为:KMnO4 + KI + H2SO4 → MnSO4 + I2 + KIO3 + K2SO4 + H2O
(1) 该反应的氧化剂是
(2) 如果该反应方程式中I2和KIO3的系数都是5
①KMnO4的系数是
②在给出的化学式上标出电子转移的方向和数目: KMnO4 + KI + H2SO4 →
(3) 如果没有对该方程式中的某些系数作限定,可能的配平系数有许多组。原因是_____________
 ____________________________________________________________。
____________________________________________________________。
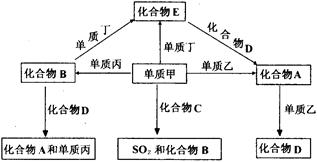
[25].A、B、C、D、E是中学化学中常见的五种化合物,它们分别由两种元素组成。甲、乙、丙、丁是单质,甲、丙、A、C、D常温下均为气体,B是液体,E是黑色固体,这些单质和化合物之间存在如下关系(反应条件均无注明):
(1) 写出下列物质的分子式:甲 、B 。
(2) 在以上有关转化的反应中充当还原剂的物质有 (填写化学式)。
(3) 写出化合物A的电子式 。
(4) 写出单质丁跟化合物B反应生成化合物E的化学方程式:______________________________。
[26].当140g铁粉跟213g氯气充分反应后,加入适量的水,完全溶解后无残余固体,加入稀释至2L。
(1) 求溶液中氯化铁的物质的量浓度。
(2) 若要求溶液中只含溶质氯化铁,还需在此溶液通入标准状况下的氯气多少升?
[27].黄铜矿(主要成分CuFeS2)是提取铜的主要原料
(1) 取12.5g黄铜矿样品,经测定含3.60g硫(杂质不含硫),矿样中CuFeS2含量为_______。
(2) 已知:2CuFeS2+4O2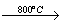 Cu2S+3SO2+2FeO(炉渣)
Cu2S+3SO2+2FeO(炉渣)
产物Cu2S在1200℃高温下继续反应:2Cu2S+3O2→2Cu2O+2SO2 2Cu2O+Cu2S→6Cu+SO2
假定各步反应都完全,完成下列计算:
①由6mol CuFeS2生成6mol Cu,求消耗O2的物质的量。
②6mol CuFeS2和14.25mol O2反应,理论上可得到多少摩尔铜?
③6mol CuFeS2和15.75 mol O2反应,理论上可得到多少摩尔铜?
[1] B
[2] D
[3] CD
[4] B
[5] BD
[6] AC
[7] D
[8] B
[9] D
[10] D
[11] C
[12] BC
[13] B
[14] C R ↓(8-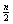 -6)×2×5 Mn ↑5×2
-6)×2×5 Mn ↑5×2
[15] D A ↓(n-1-3)×2×1 B ↑2×3
[16] A Cu ↑1×2×2 S ↑8×2 N ↓(5-x)×(13-2×2×2) 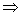 x=1
x=1
[17] D S ↑8x I ↑y I ↓5z 8x+y=5z、y+z=2x(K守恒)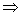 y:z=1:5
y:z=1:5
[18] C
[19] A
[20] D
[21] A 原溶液中有NO3-存在,当加入稀硫酸时,酸性增加,剩余的金属将继续与溶液反应而使最后剩余的金属质量减小
[22] C2+>A2+>B2+>D2+
[23] (1)2,4=2,2,1,2; (2)②; (3)0.2 (4)KClO3 ;HCl;Cl2;ClO2
[24] (1)KMnO4
(2)① 8 【配平后系数依次为8、15、17、8、5、5、9、17】 ②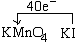
(3)该反应式含两种氧化产物,两者的比例和氧化剂的用量都可以发生变化
【有两种氧化产物,分别对应两个不同的系数,比例不同时,两者的量就不同,所以有无数组】
[25] (1)O2、H2O (2)CO、H2、Fe、H2S、C (3)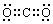
(4)3Fe+4H2O Fe3O4+4H2
Fe3O4+4H2
[26] (1)2Fe+3Cl2=2FeCl3 Fe+2FeCl3=3FeCl2
2 3 2 0.5 1 1.5 C(FeCl3)=0.50mol/L
(2)只含FeCl3 Cl―共7.5mol还需1.5molCl― 即0.75mol Cl2 16.8L
16.8L
[27] (1)12.5×x×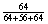 =3.6 x=82.8%
=3.6 x=82.8%
(2)①2CuFeS2~4O2~Cu2S Cu2S+O2→2Cu+SO2
6 12 3 3 3 n(O2)=15mol
②O2不足量 2Cu2S+3O2→2Cu2O+2SO2 2Cu2O+Cu2S→6Cu+SO2
1.5 2.25 1.5 1.5 过量 4.5 n(Cu)=4.5mol
③O2过量 2Cu2S+3O2→2Cu2O+2SO2 2Cu2O+Cu2S→6Cu+SO2
2.5 3.75 2.5 过量 0.5 3 n(Cu)=3mol
氧化还原反应练习题
(20##-08-24 22:00:09)
 转载
转载

氧化还原反应练习题
班级_________ 姓名___________ 学号___________
一、选择题
1.下列反应一定属于氧化还原反应的是( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
2.下列叙述正确的是( )
A.氧化还原反应的本质是化合价发生变化
B.有单质产生的分解反应一定是氧化还原反应
C.氧化剂在同一反应中既可以是反应物,也可以是生成物
D.还原剂在反应中发生还原反应
3.某元素在化学反应中由化合态变为游离态,则该元素( )
A.一定被氧化 B.一定被还原 C.既可能被氧化,也可能被还原 D.以上都不是
4.下列叙述中,正确的是( )
A、含金属元素的离子一定是阳离子
B、在氧化还原反应中,非金属单质一定是还原剂
C、某元素从化合态变为游离态时,该元素一定被还原
D、金属阳离子被还原不一定得到金属单质
5.下列关于氧化还原反应说法正确的是( )
A.肯定一种元素被氧化,另一种元素被还原
B.某元素从化合态变成游离态,该元素一定被还原
C.在反应中不一定所有元素的化合价都发生变化
D.在氧化还原反应中非金属单质一定是氧化剂
6.下列变化过程属于还原反应的是( )
A.HCl→MgCl2 B.Na→Na+ C.CO→CO2 D. Fe3+→Fe
7.下列反应属于氧化还原反应的是( )
8.下列变化需要加入氧化剂的是( )
A S2-→HS- B.HCO3-→CO2 C.2 Cl-→Cl2 D. Cu2+→Cu
9.下列物质不能做还原剂的是( )
A. H2S B. Fe2+ C .Fe3+ D. SO2
10.下列各反应中,水只做氧化剂的是( )
A. C+ H2O = CO+ H2 B.2 H2O = 2 H2↑+ O2↑
C. Na2O + H2O =2NaOH D.CuO+ H2 = Cu+ H2O
11.下列反应中,水作为还原剂的是( )
A、Cl2 + H2O = HCl + HClO B、2Na2O2 + 2H2O = 4NaOH + O2?
C、2F2 + 2H2O = 4HF + O2? D、2Na + 4H2O = 2NaOH + H2?
12.P单质在下列反应中4P+3KOH+3H2O=3KH2PO2+PH3的变化是( )
A.被氧化 B.被还原 C.既被氧化又被还原 D.既未被氧化又未被还原
13.在H2SO3+2 H2S=3 H2O+3S反应中,被氧化与被还原元素的质量比为( )
A.1:1 B.2:1 C.1:2 D.3:2
14.实现下列变化需要加入氧化剂的是( )
15.下列粒子中,既具有氧化性,又具有还原性的是( )
A.Mg B. Zn2+ C. Fe2+ D.HCl
16.在反应中,还原产物是( )
17.下列变化中,需要加入氧化剂的是( )
18.为了治理废水中Cr2O72-的污染,常先加入试剂使之变为Cr3+,该试剂为( )
A、NaOH溶液 B、FeCl3溶液 C、明矾 D、Na2SO3和H2SO4
19.离子M2O7X-与S2-能在酸性溶液中发生如下反应:aM2O7X- +3S2- +cH+==2M3+ +eS? +fH2O,则M2O7X-中M的化合价为( )
A、+4 B、+5 C、+6 D、+7
20.对反应H-+NH3==H2+NH2-的不正确说法( )
A、是置换反应 B、H-是还原剂
C、NH3是氧化剂 D、氧化产物和还原产物都是H2
21、黑火药爆炸反应为:S+2KNO3+3C=K2S+3CO2? +N2?。在该反应中,氧化剂是( )
①C ②S ③K2S ④KNO3 ⑤N2
A、①③⑤ B、②④ C、②④⑤ D、③④⑤
22.已知:Ni+CuSO4=NiSO4+Cu
Cu+2AgNO3=Cu(NO3)2+2Ag
则下列判断正确的是( )
A.还原性:Ni>Cu>Ag B.氧化性:Ni2+ >Cu2+ >Ag+
C.还原性:Ni<Cu<Ag D.氧化性:Ni2+ <Cu2+ <Ag+
23.已知X2、Y2、Z2、W2四种物质的氧化能力为:W2>Z2>X2>Y2,下列氧化还原反应能发生的是( )
A、2W- + Z2 = 2Z- +W2 B、2X- + Z2 = 2Z- + X2
C、2Y- + W2 = 2W- + Y2 D、2Z- + X2 = 2X- + Z2
24.硫化亚铁能与浓硫酸发生化学反应,下列方程式配平正确的是( )
A、2FeS+6H2SO4=Fe2(SO4)3+3SO2? +2S+6H2O
B、4FeS+18H2SO4=2Fe2(SO4)3+9SO2? +7S+18H2O
C、6FeS+16H2SO4=3Fe2(SO4)3+6SO2? +7S+16H2O
D、8FeS+18H2SO4=4Fe2(SO4)3+3SO2? +11S+18H2O
25.请把符合要求的化学反应方程式的编号填入括号内:
(1)既属于分解反应又是氧化还原反应的是( )
(2)属于化合反应,但不是氧化还原反应的是( )
(3)既属于化合反应,又是氧化还原反应的是( )
(4)属于分解反应,但不是氧化还原反应的是( )
(5)不属于四种基本反应类型的氧化还原反应的是( )
A. 2NaHCO3 = Na2CO3+ CO2 + CO2↑
B.2Na+ Cl2 = 2NaCl
C.Zn+CuSO4=ZnSO4+Cu
D.
E.CaO+ CO2= CaCO3
F. 4FeS2+11O2 = 2Fe 2O3+8SO2
二、填空题
26.配平下列氧化还原反应方程式,回答有关问题.
(1) Cl2 + KOH → KCl + KClO3 + H2O
氧化剂 ,还原剂是 ;
(2) KClO3 + HCl → Cl2 + H2O + KCl
HCl的作用是 ,被还原的元素是 .
27.油画的白色颜料含有PbSO4,久置后会变成PbS使油画变黑,如果用双氧水擦拭则可恢复原貌.试写出反应的方程式:_________ _______________________
28.臭氧(O3)是一种有鱼腥气味的淡蓝色气体.它具有比O2更强的氧化性.已知臭氧能使湿的碘化钾淀粉试纸变蓝,反应中有氧气产生.则反应的方程式是 ,反应中氧化产物是 ,还原产物是 .
29.在反应中,______元素的化合价升高,该元素的原子______电子,被________;______元素的化合价降低,该元素的原子______电子,被_________;该反应中,___________是氧化剂,___________是氧化产物。
30.分析下列变化过程,是氧化还是还原,再按要求填空:
(1)Fe→FeCl2,需加入______剂,如_______
(2)CuO→Cu,需加入_______剂,如_______
(3)HCl→H2,是______反应,HCl是_____剂
31.现有微粒:①S,②S2-,③Na+ ④Fe2+ ⑤H+ ⑥Cu ⑦O2 ⑧HCl ⑨H2O,其中在反应中只能作还原剂的是__________,既可作还原剂又可作氧化剂的是_______________,只能作氧化剂的是_____________
32一些酸在反应中可以表现出多种性质,如:MnO2+4HCl(浓) == MnCl2+Cl2↑+2H2O中的HCl既表现出酸性又表现出还原性,分析下列反应中酸的作用.
(1) NaOH+HCl==NaCl+H2O
____________________
(2)C+2 H2SO4 == CO2↑+2 SO2↑+2H2O
_____________________
(3)Cu+4HNO3 (浓)==Cu(NO3)2+2 NO2↑+2H2O
______________________
33有反应:RO3n-+6I -+6H+=R -+3 I2+3 H2O .则RO3 n-中R化合价是______
三 写出符合下列条件的化学反应方程式,是氧化还原反应的标出电子转移的方向和数目,指出还原剂.
1.有H2O生成的化合反应 2.有H2O生成的分解反应
3.把Cu片插入硝酸银溶液中 4.有O2生成的分解反应
5.有水H2O生成的置换反应 6.不是四种基本反应类型的氧原反应
7.是化合反应,也是氧化还原反应. 8.是分解反应,也是氧化还原反应.
参考答案
1、C 2、B 3、C 4、D 5、C6、D7、BD8、C9、C0、C1、C 12、C
13、B 14、D15、C 16、B17、A 18、D19、A20、C 21、B22、AD23、BC24、C25、DEBAF
26(1)Cl2 Cl2 (2)还原性和酸性,Cl
27. PbS+4 H2O2 =PbSO4+4H2O
28. O3+2KI+ H2O= O2+2KOH+I2
29.Al,失6e- 被氧化,Fe得6e-被还原,Al,Al 2O3
30.(1) 氧化,HCl(2) 还原, H2(3) 还原, 氧化
31. ②S2-⑥Cu; ①S④Fe2+⑧HCl⑨H2O, ③Na+⑤H+⑦O2
32.(1) 酸性;(2) 氧化性(3)氧化性和酸性
33.+5
三.略
-
高中化学氧化还原反应归纳
氧化还原反应考情直播例120xx茂名一模金属钛Ti性能优越被称为继铁铝制后的第三金属工业上以金红石为原料制取Ti的反应为aTiO2…
-
高中化学知识点总结氧化还原反应
燕园教育教师培训手册三氧化还原反应1准确理解氧化还原反应的概念11氧化还原反应各概念之间的关系1反应类型氧化反应物质所含元素化合价…
-
高一化学之三 氧化还原反应知识点总结
714氧化还原反应知识点一概念氧化还原反应的实质电子的转移电子的得失或共用电子对的偏移口诀失电子化合价升高被氧化氧化反应还原剂得电…
-
高中化学氧化还原反应
第一节氧化还原反应一氧化还原反应的本质实质电子的转移得失或偏移特征反应前后元素的化合价发生了变化二氧化还原反应与四种基本反应类型的…
-
高一化学氧化还原反应经典总结
氧化还原反应1从得失氧的角度认识氧化还原反应根据反应物中物质是否得到氧或者失去氧将化学反应分为氧化反应和还原反应注氧化反应和还原反…
-
女工工作总结
幼儿园女工工作总结20xx年我园女工工作围绕学校和工会的中心工作,在维护妇女合法权益,提高女教职工教育教学工作水平,提高女教职工的…
-
20xx年一季度妇科门诊护理工作总结Microsoft Office Word 文档
20xx年一季度妇科门诊护理工作总结新的一年为持续改进护理服务质量,不断提高护理服务内涵,一季度重点工作总结如下:一、制定本年度工…
-
歌咏比赛总结
张湾中心小学歌咏比赛活动总结为了推动我校素质教育的实施,丰富孩子们的校园生活,激励孩子们具有积极向上、乐观进取的精神,在活动中对孩…
-
20xx年柏社中学创建平安校园工作总结
柏社中学创建平安校园工作总结为了确保学校师生生命安全和学校财产安全,更好地贯彻上级安全工作指示精神,加强学校安全管理,维护正常的教…
-
学习部干事期末工作总结
时光如逝,从去年十月份进入学习部到现在已经快一年了,在这一年里,我们经历过成功也体验过失败,我们从未放弃梦想,我们用自己的勤奋与努…