高中化学氧化还原反应
第一节 氧化还原反应
一、氧化还原反应的本质
㈠实质:电子的转移(得失或偏移)。
㈡特征:反应前后元素的化合价发生了变化。
二、氧化还原反应与四种基本反应类型的关系
三、氧化还原反应的表示方法
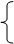 a.用两条线由反应物指向生成物,且对准同种元素。
a.用两条线由反应物指向生成物,且对准同种元素。
㈠双线桥法 b.要标明“得”、“失”电子,且得失电子数相等。
c.箭头不代表电子转移的方向。
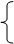 a.用一条线表示不同元素原子得失电子的情况。
a.用一条线表示不同元素原子得失电子的情况。
㈡单线桥法 b.由失电子的元素指向得电子的元素,并标明电子转移的总数。
c.箭头表示电子转移的方向
 Fe2O3+3CO高温 2Fe+3CO2 3Cu+8HNO3==3Cu(NO3)2+NO +4H2O
Fe2O3+3CO高温 2Fe+3CO2 3Cu+8HNO3==3Cu(NO3)2+NO +4H2O
四、有关氧化还原反应的总结
㈠从化合价升降角度认识氧化还原反应
㈡从电子转移角度理解氧化还原反应
1、在离子化合物的形成过程中,金属元素原子失去电子使化合价升高,发生氧化反应;非金属元素原子得到电子使化合价降低,发生还原反应。
2、在共价化合物的形式过程中,公用电子对偏向哪一方,该元素的化合价降低,发生还原反应,共用电子对偏离哪一方,该元素化合价升高,发生氧化反应。
3、元素化合价的升降既与氧化还原反应有着密切的关系,又与元素原子之间的电子转移有着密切的关系。
五、氧化还原反应的基本规律
㈠守恒律:化合价升高总数与降低总数相等,失电子总数与得电子总数相等,反应前后电离总数相等(离子反应)
㈡价态律:元素处于最好价态,只有氧化性;元素处于最低价态,只有还原性。
㈢强弱律:强氧化性的氧化剂跟强还原性的还原剂反应,生成弱还原性的还原产物和弱氧化性的氧化产物。
㈣转化律:以元素相邻价态之间的转化最容易;同种元素不同价态之间发生反应,元素的化合价只靠近不交叉(有可能生成同一价态的物质);同种元素相邻价态之间不发生氧化还原反应。
㈤难易律:越易失电子的物质,失去后就越难得电子;越易得电子的物质,得到后就越难失去电子。
㈥跳位律
在特殊情况下,氧化剂遇到强还原剂时,或还原剂遇到强氧化剂时,元素的价态变化不是临位变化而是跳位变化的。
㈦有效律
㈧分部律:分部反应覆盖了某些氧化还原反应的本质
当一个氧化剂(还原剂)遇到还原剂(氧化剂)时,自身氧化还原能力较强的优先。
六、氧化还原反应的类型
㈠还原剂+氧化剂===氧化产物+还原产物
㈡部分氧化还原反应
㈢自身氧化还原反应
七、常见的氧化剂和还原剂
㈠具有最高价元素的物质,在氧化还原反应中只能得到电子,一般是较强的氧化剂,具有较强的氧化性。
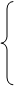 a.高价或较高价含氧化合物:MnO2 KClO3 KMnO4 K2Cr2O7 HNO3 H2SO4(浓)
a.高价或较高价含氧化合物:MnO2 KClO3 KMnO4 K2Cr2O7 HNO3 H2SO4(浓)
常见的氧化剂 b.高价金属阳离子:Cu2+ Fe3+ Ag+ Pb4+
c.非金属单质:Cl2 Br2 I2 O2 S
d.过氧化物:Na2O2 H2O2
㈡具有最低价元素的物质,在氧化还原反应中只能失去电子,一般是较强的还原剂,具有较强的还原性。
 a.活泼或较活泼的金属:K Ca Na Mg Al Zn Fe
a.活泼或较活泼的金属:K Ca Na Mg Al Zn Fe
b.低价金属阳离子:Fe2+ Cu+
常见的还原剂 c.非金属离子及低价态化合物:S2- H2S I- SO2 H2SO3 Na2SO3
d.较低价的化合物:CO NH3 H2
e.少数金属化合物:NaH CaH2 CaC2
八、氧化性、还原性的强弱判断方法
㈠由氧化还原反应方向比较
 还原剂A+氧化剂B 氧化产物a+还原产物b,则:氧化性B>a,还原性A>b。
还原剂A+氧化剂B 氧化产物a+还原产物b,则:氧化性B>a,还原性A>b。
如:由2 Fe2++ Br2===2 Fe3++2Br-可知:氧化性Br2>Fe3+,还原性Fe2+>Br-
㈡根据物质活动性顺序比较判断:
1、金属活动性顺序(常见元素)
K Ca Na…Fe…Cu Hg Ag
 原子还原性逐渐减弱,对应阳离子氧化性逐渐增强
原子还原性逐渐减弱,对应阳离子氧化性逐渐增强
2、非金属活动性顺序(常见元素)
F Cl Br I S
 原子(或单质)氧化性逐渐减弱,对应阴离子还原性逐渐增强
原子(或单质)氧化性逐渐减弱,对应阴离子还原性逐渐增强
3、由反应条件的难易比较
a. 不同氧化剂与同一还原剂反应,反应条件约易,氧化性越强。
如:F2和H2混合在暗处就能剧烈化合而爆炸,而I2与H2需在不断加热的情况下才能缓慢化合,因而F2的氧化性比I2强。
b. 不同还原剂与同一氧化剂反应,反应条件越易,还原性越强。
如有两种金属M和N均能与水反应,M在常温下能与水反应产生氢气,而N需在高温下才能与水蒸气反应,由此判断M的还原性比N强。
4、 条件相同,与同一物质反应,能使这一物质化合价变化大的 ,氧化(还原)性强。
如:2 Fe+3 Cl2=== 2 Fe Cl3 Fe+S=== FeS
可以判断氧化性:Cl2>S
5、对于同种元素:化合价高的氧化能力强,化合价低的还原能力强
如:氧化性:H2SO4(浓)>SO2>S 还原性:H2S>S>SO2
九、氧化还原反应方程式的配平技巧
㈠逆向配平法
 K2Cr2O7 + HCl(浓)=== KCl+ CrCl3+ Cl2 + H2O
K2Cr2O7 + HCl(浓)=== KCl+ CrCl3+ Cl2 + H2O
㈡设“1”配平法
P4O+ Cl2=== POCl3+ P2Cl6
㈢零价配平法
 Fe3+ HNO3== Fe(NO3)3+ NO2 + CO2 + H2O
Fe3+ HNO3== Fe(NO3)3+ NO2 + CO2 + H2O
㈣整体标价法
S+ Ca(OH)2== CaSx+ CaS2O3+ H2O
㈤缺项配平法
 MnO4-+Cl-+ ==Mn2++Cl2+H2O
MnO4-+Cl-+ ==Mn2++Cl2+H2O
㈥有机氧化还原反应方程式的配平
 KMnO4+ H2SO4+ H2C2O4== CO2 + MnSO4+ K2SO4+ H2O
KMnO4+ H2SO4+ H2C2O4== CO2 + MnSO4+ K2SO4+ H2O
第二节 离子反应
一、电解质和非电解质
1、 电解质:水溶液或融化状态、能导电、化合物
2、 非电解质:水溶液和融化状态、不能导电、化合物
3、 电解质溶液的导电能力:离子浓度越大,离子的电荷数越多,导电能力越强。
注:⑴单质与混合物不属于电解质,也不属于非电解质。
⑵金属氧化物是电解质。
⑶能导电的物质不一定是电解质,如石墨等;电解质本身不一定能导电,如食盐晶体。
⑷有些化合物的水溶液能导电,但因为这些化合物在水中或融化状态下本身不能电离,也不是电解质。如SO2、SO3、NH3、CO2等,它们的水溶液都能导电,是因为跟水反应生成了电解质,它们本身都不是电解质。
⑸有些电解质不溶于水。如:硫酸钡、碳酸钙都是电解质。
二、电解质的电离
㈠电离:酸、碱、盐等在溶解与水或受热融化时,理解成能够自由移动的离子的过程。
※ 注意:1、电离的条件:溶解于水或受热融化。
2、电离不需要通电。
3、电离一般是吸热过程。
㈡强电解质与弱电解质
强电解质与弱电解质的比较
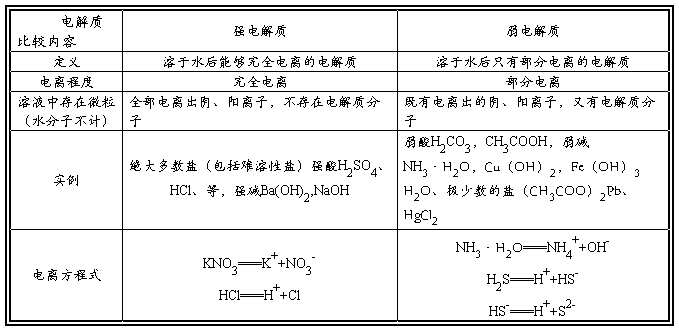
※ 注意:1、电解质的强弱与物质内部结构有关,与外界因素无关。
2、电解质的强弱与溶解性无关,BaSO4等一些难溶电解质,在水中的溶解度极小、但溶解的部分全部电离成离子,只是离子浓度太小、它不仅是电解质、而且是强电解质。
3、电解质的强弱与溶液的导电性没有必然联系,其导电能力强弱由溶液中自由离子的浓度决定,也与离子所带电荷多少有关。
㈢电离方程式
1、 离子反应是在溶液中或融化状态时进行的反应,凡非溶液中进行的反应,一般不能写成离子方程式。
如:NH4Cl固体和Ca(OH)2固体混合加热,只能写成化学方程式
2、 单质、氧化物、气体、水在离子方程式中一律写化学式;弱酸、弱碱等难电离的物质必须写化学式;难溶于水的物质等必须写化学式。
3、 ①弱酸的酸式盐:第一步完全电离,其余部分电离,如:NaHCO3== Na++ HCO3-
②强酸的酸式盐在溶液中一步完全电离,如:NaHSO4== Na++H++SO42-,但在熔融状态下,只电离出离子和酸根离子,NaHSO4(熔融)== Na++ HSO42-
③ 元弱酸的酸式酸根离子在离子方程式中不能拆开写,如NaHSO3溶液和稀硫酸反应:
 HSO3-+H+===SO2 +H2O
HSO3-+H+===SO2 +H2O
4、活泼金属的氧化物在熔融状态下也可以电离,如:Na2O融化2Na++O2-
5、微溶物的处理有三种情况:
⑴在生成物中有微溶物析出时,微溶物用化学式表示
⑵当反应物里有微溶物处于浊液状态(稀溶液)、应写成离子的形式,如CO2气体通入澄清石灰水中
⑶当反应物里有微溶物处于浊液或固态时,应写成化学式,如石灰乳中加入Na2CO3
6、操作顺序或反应物相对量不同时离子方程式不同,例如少量烧碱滴入Ca(HCO3)2溶液(此时Ca(HCO3)2过量)有:
 Ca2++ HCO3-+OH-===CaCO3 + H2O
Ca2++ HCO3-+OH-===CaCO3 + H2O
少量Ca(HCO3)2溶液滴入烧碱溶液(此时NaOH过量)有:
 Ca2++2HCO3-+2OH-=== CaCO3 +CO32-+2 H2O
Ca2++2HCO3-+2OH-=== CaCO3 +CO32-+2 H2O
7、离子方程式中浓硫酸的处理
浓硫酸跟固体反应,一律不写成离子方程式,只用化学方程式但若是浓硫酸与某溶液反应,则一律写为“2H+ SO42-”形式
8、氨在离子方程式中的书写形式
⑴有关氨气跟某溶液反应的写成“NH3”或 “NH3·H2O”
⑵有关氨气跟某物质反应的写成“NH3·H2O”
⑶在冷的稀溶液中生成氨气的写成“NH3·H2O”
 ⑷在热的溶液或冷的浓溶液中生成氨气的写成:“NH3 ”
⑷在热的溶液或冷的浓溶液中生成氨气的写成:“NH3 ”
三、常见离子的检验方法
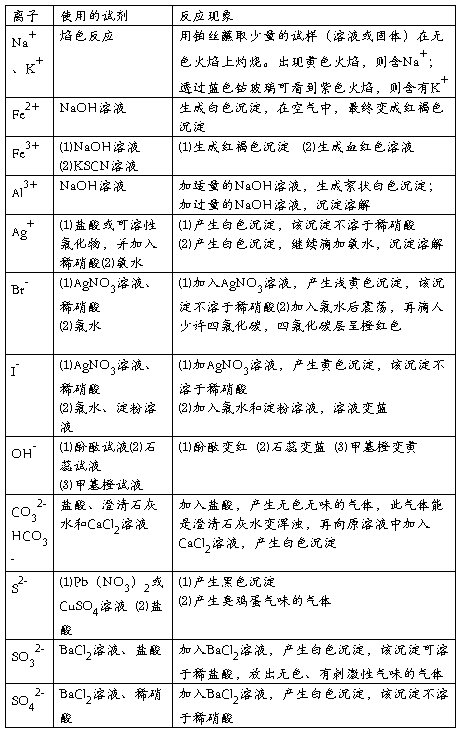
四、离子共存
常见的离子在溶液中不能大量共存的情况主要有以下几种:
1、 离子之间相互反应有沉淀析出
2、 离子之间相互反应有气体逸出
3、 离子之间相互反应生成弱电解质
4、 离子之间因相互促进水解
5、 离子之间因发生氧化还原反应
6、 离子之间因发生反应生成络离子
7、 因题目的附加条件而不能大量共存
⑴ 无色溶液中Cu2+、Fe2+、MnO4-等有色离子不能大量共存。
⑵ 看是否符合题设条件及要求,如“过量”“少量”“等物质的量”“适量”“任意量”。
⑶ 滴加顺序
⑷ 注意溶液隐含的酸碱性,如PH=1;水电离的H+浓度为1×10-12,则隐含着溶液具有很强酸性或强碱性。
⑸ 注意溶液中隐含的氧化性离子与还原性离子不能共存。
如:在PH=1的溶液中含有大量NO3-,由于酸性溶液中NO3-有强氧化性,则不能再有Fe2+、S2-等还原性离子。
第二篇:高中化学_氧化还原反应方程式的配平
高中化学专题讲座三
氧化还原反应方程式的配平
[知识网络]
配平氧化还原反应方程式的基本方法
原则:氧化剂得到的电子数==还原剂失去的电子数
步骤:⑴写出反应物和生成物的化学式 。
⑵分别标出化合价升高和降低的元素的价态 。
⑶求出化合价升高数和降低数的最小公倍数,确定氧化剂、还原剂及其产物的化学计量数。 ⑷配平未参加氧化还原的原子或离子的化学计量数。
[整理归纳]
氧化还原反应方程式的常见类型及其配平方法
1.关于某物质发生部分氧化还原反应时的配平:例
FeO+HNO3——Fe(NO3)3+NO+H2O
2.关于歧化和归中反应的配平:例
Cl2+KOH——KClO3+KCl+H2O
P+CuSO 4+H2O——Cu3P+H3PO4+H2SO4
* Cu(IO3)2+KI+H2SO4——CuI+I2+K2SO4+_____
* CuSO4+FeS2+H2O——Cu2S+H2SO4+FeSO4
3.关于离子反应方程式的配平:例
Cr(OH)4-+OH-+ClO-——CrO42-+Cl-+H2O
4.关于有缺项的方程式的配平:例
Fe(OH)3+Br2——K2FeO4+KBr+H2O
NaBiO3(微溶)+Mn2++H+——Na++Bi3++MnO4-
Cr(OH)4-+ClO-+ ——CrO4-+Cl-+H2O
5.必须应用分数进行配平的情况:例
FeCl2+O2+H2O——Fe(OH)3+FeCl3
K2Cr2O7+KI+H3PO4——K3PO4+CrPO4+I2+H2O
6.关于字母型方程式的配平:例
Clm+OH-——Cl -+ClOn-+H2O
NaSx+NaClO+NaOH——Na2SO4+NaCl+H2O
7.关于有机反应程式的配平:例
H2C2O4+KMnO4+H2SO4——CO2+MnSO4+K2SO4+H2O
C6H5-CH3+KMnO4+H2SO4——C6H5-COOH+MnSO4+K2SO4+H2O
8.关于分解反应方程式的配平:例
KMnO4——K2MnO4+MnO2+O2
NH4NO3——N2+N2O3+H2O
[问题讨论]
1.什么是电子得失配平法?它有什么用途?
2.能否任意设定元素的化合价来配平方程式?怎样设定为好?
[典型例题]
例1.配平 Al+Fe3O4——Al2O3+Fe
例2.配平 Fe3C+HNO3——Fe(NO3)3+CO2+NO2+H2O
例3.配平 P4O+Cl2——POCl3+P2Cl5
例4.*配平
第 1 页 共 2 页 mail: jinlihui@21cn.com
高中化学专题讲座三
C6H5-CH2CH3 +KMnO4+H2SO4— C6H5-COOH+CO2+K2SO4+MnSO4+H2O 例5.配平 AgF+Cl2 +H2O――AgClO3 +AgCl+O2 +HF
HClO4+Cl2+O2+H2O
第 2 页 共 2 页 mail: jinlihui@21cn.com 例6.配平 HClO3――
-
高中化学氧化还原反应归纳
氧化还原反应考情直播例120xx茂名一模金属钛Ti性能优越被称为继铁铝制后的第三金属工业上以金红石为原料制取Ti的反应为aTiO2…
-
高中化学知识点总结氧化还原反应
燕园教育教师培训手册三氧化还原反应1准确理解氧化还原反应的概念11氧化还原反应各概念之间的关系1反应类型氧化反应物质所含元素化合价…
-
高一化学之三 氧化还原反应知识点总结
714氧化还原反应知识点一概念氧化还原反应的实质电子的转移电子的得失或共用电子对的偏移口诀失电子化合价升高被氧化氧化反应还原剂得电…
-
高中化学氧化还原反应
第一节氧化还原反应一氧化还原反应的本质实质电子的转移得失或偏移特征反应前后元素的化合价发生了变化二氧化还原反应与四种基本反应类型的…
-
高一化学氧化还原反应经典总结
氧化还原反应1从得失氧的角度认识氧化还原反应根据反应物中物质是否得到氧或者失去氧将化学反应分为氧化反应和还原反应注氧化反应和还原反…
-
高中化学知识点总结氧化还原反应
燕园教育教师培训手册三氧化还原反应1准确理解氧化还原反应的概念11氧化还原反应各概念之间的关系1反应类型氧化反应物质所含元素化合价…
-
高一化学氧化还原反应经典总结
氧化还原反应1从得失氧的角度认识氧化还原反应根据反应物中物质是否得到氧或者失去氧将化学反应分为氧化反应和还原反应注氧化反应和还原反…
-
高一化学之三 氧化还原反应知识点总结
714氧化还原反应知识点一概念氧化还原反应的实质电子的转移电子的得失或共用电子对的偏移口诀失电子化合价升高被氧化氧化反应还原剂得电…
-
北京四中高中化学 2.3氧化还原反应(2)教案 新人教版必修1
氧化还原反应121有单质参加的化合反应和有单质生成的分解反应一定是氯化还原反应2没有单质参加的化合反应和没有单质生成的分解反应一定…
-
第二章 《化学物质及其变化》:2.3《氧化还原反应》教案+随堂练习(新人教版必修1)
第三节氧化还原反应第一课时教学目标1初步学会根据化合价变化分析判断理解氧化还原反应2通过氧化还原反应概念的学习培养学生准确描述概念…