硫代硫酸钠的制备
题目:硫代硫酸钠的制备
赵泽锋
摘要:以Na2SO3和S粉为原料,制备10g Na2S2O3·5H2O,计算原料Na2SO3和S粉的用量。
关键词:硫代硫酸钠
前言:硫代硫酸钠有较强的还原性和配位能力,可用于照相行业定影剂,洗染业,造纸业的脱氯剂定量分析中的还原剂。制备的主要方法是亚硫酸钠法
实验仪器:滤纸、表面皿、烧杯、滴定管、电热套、试管、蒸发皿、布氏漏斗、真空泵、石棉网,电子天平
实验试剂:固体Na2SO3、硫粉、活性炭,乙醇,硫酸,碘水,0.5%淀粉溶液,0.1mol/L AgNO3 溶液
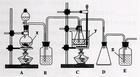
实验装置图:
实验原理:Na2S2O3·5H2O的制备方法有多种,其中实验室的主要制取方法是: Na2SO3+S+5H2O
后可得
实验步骤:(1)取6.0g NaSO3于烧杯中,加水溶解
(2)取2.0g硫粉与3ml乙醇于烧杯溶解,加入NaSO3溶液,搅拌均匀,隔石
棉网小火加热并不断搅拌至硫粉完全溶解
(3)停止加热后,待溶液稍冷后加入适量的活性炭,加热煮沸2分钟
(4)趁热过滤,小火蒸发浓缩至溶液呈微黄色浑浊
(5)冷却,结晶;减压过滤并称量其质量
产品检验:取适量产品配制成溶液备用
(1)S2O32-的定性检验
取几滴AgNO3于试管中,加入几滴硫代硫酸钠溶液,有白色沉淀生成,且白色沉淀由白 黄再变棕最后变成黑色 2Ag+S2O3=Ag2S2O3↓ Ag2S2O3+H2O=AgS↓+2H++SO42-
(2)S2O32-的不稳定性
取少量待测液于试管中,逐滴加入10滴6mol/L的HCl
溶液,有黄色沉淀生+2-Na2S2O3·5H2O,反应后所得溶液经脱色,过滤,浓缩结晶,过滤,干燥
成S2O32- + 2 H+ = SO2↑+S↓ + H2O
(3)S2O32-的还原性
取1ml碘水,加入2滴淀粉溶液,溶液变为蓝色,后逐滴加入Na2SO3溶液, 溶液由蓝色变为无色S2O32-+ H2O+I2=2 SO42-+10H++8I-
(4)S2O3的配位性
在点滴板中滴加10滴0.1mol/L AgNO3 溶液,加入10滴0.1mol/L的KBr溶液,有黄色沉淀生成;再逐滴加入Na2S2O3溶液,沉淀消失,溶液呈无色 Ag++Br-=AgBr↓AgBr +2S2O32-=[Ag(S2O3)2]3-+Br-
产率计算:
理论Na2SO3的产量为m=11.81g
实际产量m产品=3.68g
产率=(m/m理论)×100﹪=31.16﹪
实验误差来源:抽滤不够完全,有少量水分,存在实验操作失误 参考文献:基础化学实验教程(三) 2-
第二篇:硫代硫酸钠标准溶液的配制和标定
实验九 硫代硫酸钠标准溶液的配制和标定
一、目的
1.掌握Na2S2O3溶液的配制方法和保存条件
2.了解标定Na2S2O3溶液浓度的原理和方法
二、原理
结晶Na2S2O3×5H2O一般都含有少量的杂质,如S、Na2SO3、Na2SO4、Na2CO3及NaCl等。同时还容易风化和潮解。因此,不能用直接法配制标准溶液。
Na2SO3溶液易受空气和微生物等的作用而分解,其分解原因是:
1.与溶解于溶液中的CO2 的作用 硫代硫酸钠在中性或碱性溶液中较稳定,当 pH<4.6 时极不稳定,溶液中含有CO2时会促进Na2S2O3分解:
Na2S2O3+ H2O + CO2 →NaHCO3 + NaHSO3
此分解作用一般都在制成溶液后的最初10天内进行,分解后一分子的Na2S2O3变成了一分子的NaHSO3 。一分子Na2S2O3 只能和一个碘原子作用,而一分子的NaHSO3 且能和2个碘原子作用。因而使溶液浓度(对碘的作用)有所增加,以后由于空气的氧化作用浓度又慢慢的减小。
在pH9~10间Na2S2O3 溶液最为稳定,在Na2S2O3溶液中加入少量Na2CO3 (使其在溶液中的浓度为0.02% )可防止Na2S2O3的分解。
2.空气氧化作用
2Na2S2O3+O2 →2Na2SO4+ 2S¯
3.微生物作用 这是使Na2S2O3 分解的主要原因。
Na2S2O3 ®Na2SO3 + S
为避免微生物的分解作用,可加入少量HgI2(10mg/L) 。
为减少溶解在水中的CO2 和杀死水中微生物,应用新煮沸冷却后的蒸馏水配置溶液。
日光能促进Na2S2O3 溶液的分解,所以Na2S2O3 溶液应贮存于棕色试剂瓶中,放置于暗处。经8—14天后再进行标定,长期使用的溶液应定期标定。
标定Na2S2O3 溶液的基准物有K2Cr2O7 、KIO3 、KBrO3 和纯铜等,通常使用K2Cr2O7 基准物标定溶液的浓度,K2Cr2O7 先与KI反应析出I2:
Cr2O72- + 6I- +14H+ = 2Cr2+ + 3I2 +7H2O
析出I2的再用Na2S2O3标准溶液滴定:
I2 + 2S2O32- = S4O62- +2I-
这个标定方法是间接碘量法的应用实例。
三、试剂
1. Na2S2O3×5H2O(固)
2. Na2CO3(固)
3. KI(固)
4. K2Cr2O7 (固)A ×R或G× R。
5. 2mol/LHCl
6. 5%淀粉溶液 0.5g淀粉,加少量水调成糊状,倒入100ml煮沸的蒸馏水中,煮沸5分钟冷却。
四、操作步骤
1. 0.1mol/LNa2S2O3 溶液的配制
(1)先计算出配制约0.1mol/LNa2S2O3溶液400ml所需要Na2S2O3×5H2O的质量。
(2) 在台秤上称取所需的Na2S2O3×5H2O量, 放入500ml棕色试剂瓶中, 加入100ml新煮沸经冷却的蒸馏水,摇动使之溶解,等溶解完全后加入0.2g Na2CO3, 用新煮沸经冷却的蒸馏水稀释至400ml,摇匀,在暗处放置7天后,标定其浓度。
2. 0.017mol/L K2Cr2O7 配制
准确称取经二次重结晶并在1500C烘干1小时的K2Cr2O71.2~1.3g左右于150ml小烧杯中,加蒸馏水30ml使之溶解(可稍加热加速溶解),冷却后,小心转入250ml容量瓶中, 用蒸馏水淋洗小烧杯三次,每次洗液小心转入250ml容量瓶中,然后用蒸馏水稀释至刻度,摇匀,计算出K2Cr2O7标液的准确浓度。
3. Na2S2O3溶液的标定
用25ml 移液管准确吸取K2Cr2O7标准溶液两份,分别放入250ml锥形瓶中,加固体KI1g和2mol/LHCl15ml,充分摇匀后用表皿盖好,放在暗处5分钟,然后用50ml蒸馏水稀释, 用0.1mol/L Na2S2O3溶液滴定到呈浅黄绿色,然后加入0.5%淀粉溶液5ml,继续滴定到蓝色消失而变为Cr3+的绿色即为终点。根据所取的K2Cr2O7的体积、浓度及滴定中消耗Na2S2O3溶液的体积,计算Na2S2O3溶液准确浓度。
五、思考题
1. Na2S2O3标准溶液如何配制?如何标定?
2. 用K2Cr2O7作基准物标定Na2S2O3溶液浓度时,为什么要加入过量的KI和加入HCl溶液?为什么要放置一定时间后才加水稀释?如果(1)加KI 不加HCl溶液;(2)加酸后不放置暗处;(3)不放置或少放置一定时间即加水稀释会产生什么影响?
3. 写出用K2Cr2O7溶液标定Na2S2O3溶液的反应式和计算浓度的公式。
实验十 硫酸铜中铜含量的测定(碘量法)
一、目的
掌握用碘量法测定铜的原理和方法
二、基本原理
在弱酸性溶液中Cu2+与过量KI作用生成 CuI沉淀,同时析出确定量的I2, 反应如下;
2Cu2+ +4I- =2CuI¯+ I2
析出的I2以淀粉为指示剂, 用Na2S2O3标准溶液滴定:
I2+ 2S2O32- = 2I- + S4O62-
上述反应是可逆的, 为了促使反应能趋于完全, 实际上必须加入过量的KI, 同时由于CuI沉淀强烈地吸附I2,使测定结果偏低。如果加入KSCN可使CuI(Ksp=5.06´10-12)转化为溶解度更小的CuSCN(Ksp=4.8´10-15) 。
CuI+SCN- = CuSCN¯ + I-
这样不但可以释放出被吸附的I2, 而且反应时再生出来的I-与未反应的Cu2+发生作用。在这种情况下, 可以使用较少的KI而使反应进行得更完全。但KSCN只能在接近终点时加入, 否则SCN-可能直接还原Cu2+而使结果偏低:
6Cu2+ +7SCN- +4H2O =6CuSCN¯ + SO42- +HCN +7H+
为防止铜盐水解, 反应必须在酸性溶液中进行,酸度过低,Cu2+氧化I-不完全,结果偏低而且反应速度慢、终点拖长; 酸度过高,则I-被空气氧化为I2,使Cu2+的测定结果偏高。
大量Cl-能与Cu2+络合,I-不能从Cu2+的氯络合物中将Cu2+定量地还原,因此,最好用H2SO4而不用HCl。
矿石或合金中的铜也可用碘量法测定。但必须设法防止其它能氧化I-的物质(如NO3- 、Fe3+等)的干扰。防止的方法是加入掩蔽剂以掩蔽干扰离子(例如使Fe3+生成FeF63-而被掩蔽)或在测定前将它们分离除去。 若有As(V)、Sb(V)存在,应将pH调至4,以免它们氧化I-。
三、试剂
1.KI(固)。
2.1mol/L Na2S2O3标准溶液。
3.KSCN(固)。
4.1mol/L H2SO4.
5.0.5%的淀粉溶液。
四、操作步骤
准确移取硫酸铜试样0.5~0.6g(称准至0.0002g)两份,分别放于两个250ml锥形瓶中。 加1mol/L H2SO4 5ml和100ml蒸馏水溶解, 加KI1g,立即用Na2S2O3标准溶液滴定至浅黄色,然后加入0.5%淀粉溶液3ml,继续滴定到呈浅蓝色,再加入1gKSCN,摇匀后,溶液蓝色转深,继续用Na2S2O3标准溶液滴定至蓝色刚好消失,此时溶液为米色CuSCN悬浮液。根据滴定结果,计算硫酸铜中铜的百分含量。
五、思考题
1.硫酸铜易溶于水, 为什么溶解时要加H2SO4?
2.用碘量法测定铜含量时加入KSCN的目的何在?
3.测定反应为什么一定要在弱酸性溶液中进行?能否用HCl代替H2SO4?为什么?
-
硫代硫酸钠的制备实验报告
硫代硫酸钠的制备班级化工122姓名茆邦宇学号120xx280327摘要实验目的在于提升同学对于硫代硫酸钠制备方法的了解进一步熟悉蒸…
-
实验十八教案 硫代硫酸钠的制备
硫代硫酸钠的制备关键词硫代硫酸钠实验目的1制备Na2S2O35H2O2练习气体的制备和仪器的安装3进一步练习过滤蒸发结晶与干燥等基…
-
硫代硫酸钠的制备
硫代硫酸钠的制备班级姓名学号摘要用亚硫酸纳法制备硫代硫酸纳在制备过程中要注意控制反应过程中的温度以及在减压热过滤冷却结晶过滤过程中…
-
硫代硫酸钠的制备实验报告
硫代硫酸钠的制备摘要实验目的在于提升同学对于硫代硫酸钠制备方法的了解进一步熟悉蒸发浓缩减压过滤结晶等相关基本操作采用亚硫酸钠法用近…
-
硫代硫酸钠的制备(化学设计实验)
摘要采用亚硫酸钠法用近饱和的亚硫酸钠溶液和硫粉共煮来制备硫代硫酸钠由于硫代硫酸钠具有不稳定性较强的还原性和配位能力所以对制好的产品…
-
库仑滴定测定硫代硫酸钠的浓度实验报告
库仑滴定测定硫代硫酸钠的浓度一目的要求1掌握库仑滴定法的原理及化学指示剂指示终点的方法2应用法拉第定律求算未知物的浓度二原理在酸性…
-
硫代硫酸钠的制备实验报告
硫代硫酸钠的制备摘要实验目的在于提升同学对于硫代硫酸钠制备方法的了解进一步熟悉蒸发浓缩减压过滤结晶等相关基本操作采用亚硫酸钠法用近…
-
硫代硫酸钠的制备实验报告
硫代硫酸钠的制备班级化工122姓名茆邦宇学号120xx280327摘要实验目的在于提升同学对于硫代硫酸钠制备方法的了解进一步熟悉蒸…
-
实验十八教案 硫代硫酸钠的制备
硫代硫酸钠的制备关键词硫代硫酸钠实验目的1制备Na2S2O35H2O2练习气体的制备和仪器的安装3进一步练习过滤蒸发结晶与干燥等基…
-
硫代硫酸钠的制备
硫代硫酸钠的制备班级姓名学号摘要用亚硫酸纳法制备硫代硫酸纳在制备过程中要注意控制反应过程中的温度以及在减压热过滤冷却结晶过滤过程中…