实验七:缓冲溶液的配制与性能
实验七:缓冲溶液的配制与性能
一 实验目的
(1)学习缓冲溶液的配制方法,加深对缓冲溶液性质的理解
(2)了解缓冲容量与缓冲剂浓度和缓冲组分的比值关系:
(3)练习吸量管的使用方法。
二 实验原理
能抵抗外来少量强酸、强碱或适当稀释而保持pH值基本不变的溶液叫缓冲溶液。缓冲溶液一般是由弱酸及其盐、弱碱及其盐、多元弱酸的酸式盐及其次级盐组成。缓冲溶液的pH值可用下式计算:
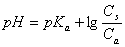 或
或 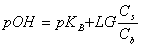
缓冲溶液pH值除主要决定于pKb(pKb)外,还与盐和酸(或碱)的浓度比值有关,若配制缓冲溶液所用的盐和酸(或碱)的原始浓度相同均为C,酸(碱)的体积为Va(Vb),盐的体积为Vs总体积为V,混合后酸(或碱)的浓度为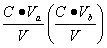 ,盐的浓度为
,盐的浓度为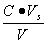 ,则
,则
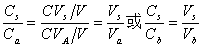
所以缓冲溶液pH值可写为
 或
或 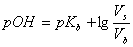
配制缓冲溶液时,只要按计算值量取盐和酸〔或碱)溶液的体积,混合后即可得到一定pH值的缓冲溶液。
缓冲容量是衡量缓冲溶液的缓冲能力大小的尺度。为获得最大的缓冲容量,应控制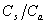 (或
(或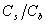 )=1,酸(或碱)、盐浓度大的,缓冲容量亦大。但实践中酸(或碱)、盐浓度不宜过大。
)=1,酸(或碱)、盐浓度大的,缓冲容量亦大。但实践中酸(或碱)、盐浓度不宜过大。
三 仪器与药品
1.仪器。10mL吸量管、烧杯、试管、量筒等。
2.药品。HCl(0.1mol·L-1)、pH=4的HCl溶液、HAc(0.10.1mol·L-1、1mol·L-1)、NaOH(0.1mol·L-1、2mol·L-1);pH=10的NaOH溶液、NH3·H20〔0.1 mol·L-1)、NaAc(0.1 mol·L-1、l mol·L-1)、NaH2P04(0.1 mol·L-1)、Na2 HP04 (0.1 mol·L-1 )、NH4Cl (0.1 mol·L-1)以及甲基红指示剂、广泛pH试纸、精密pH试纸。
四 实验步骤
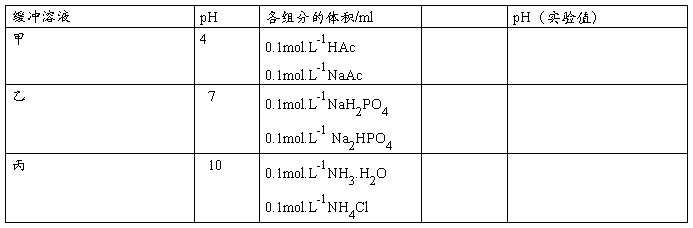
1.缓冲溶液配制。甲、乙、丙三种缓冲溶液的组成如下表。如配制三种缓冲溶液各10mL,计算所需各组分的体积,并填入表中。
按照表3-1中用量,用10mL小量筒(尽可能读准小数点后一位)配制甲、乙、丙三种缓冲溶液于已标号的3支试管中。用广泛PH试纸测定所配制的缓冲溶液的PH值,填入表中。试比较实验值与计算值是否相符(保留溶液,留作下面实验用)。
表3—1 缓冲溶液理论配制与实验测定.
2.缓冲溶液的性能
(1)缓冲溶液对强酸和强碱的缓冲能力。
① 在两支试管中各加入3mL蒸馏水,用pH试纸测定其pH,然后分别加入3滴0.1mol.L-1HCl和0.1 mol.L-1NaOH溶液,再用PH试纸测其pH。
② 将实验1中配制的甲、乙、丙三种溶液依次各取3mL,每种取2份,共取6份,分别加入3滴0.1 mol.L-1HCl和0.1 mol.L-1NaOH溶液,用pH试纸测其pH值并填入表3—2:
表3—2缓冲溶液的性质

测定分别加入酸和碱后,同一缓冲溶液的pH值有无变化?与末加酸、碱的缓冲溶液的pH值比较有无变化?为什么?
(2) 缓冲溶液对稀释的缓冲能力。按表3—3,在3支试管中,依次加入lm比PH=4的缓冲溶液、pH=4的HCl溶液、pH=10的缓冲溶液、pH=l0的NaOH溶液,然后在各试管中加入10rnL蒸馏水,混合后用精密pH试纸测量其pH值。并解释实验现象。
表3---3缓冲溶液的稀释

3.缓冲容量;
(1) 缓冲容量与缓冲剂浓度的关系。
取2支试管,用吸量管在一支试管中加0.1 mol.L-1HAc和0.1mol.L-1NaAc溶液各3mL,另一只试管中加1 mol.L-1HAc和1mol.L-1NaAc溶液各3mL,摇动使之混合均匀。
测两试管内溶液的PH值是否相同?在两试管中分别滴入2滴甲基红指示剂,溶液里何色?然后在两试管中分别滴加2 mol.L-1NaOH溶液(每加一滴均需充分混合),直到溶液的颜色变成黄色。记录各管所加的滴数。解释所得的结果。
(2) 缓冲容量与缓冲组分比值的关系 取2支试管,用吸量管在一支试管中加入0.1 mol.L-1 Na2HPO4和0.1 mol.L-1 NaH2PO4各5mL,另一支试管中加入9mL 0.1 mol.L-1 Na2HPO4和0.1 mol.L-1 NaH2PO4,用精密pH试纸或pH计测定两溶液的pH值。然后在每支试管中加入0.9mL 0.1m01·LNaOH再用精密pH试纸或pH计测定它们的pH值。每一试管加NaoH溶液前后两次的pH值是否相同?两只试管比较情况又如何?解释原因。
(五)思考题
1.缓冲溶液的pH值由哪些因素决定?
2.现有下列几种酸及这些酸的各种对应盐类(包括酸式盐),欲配制pH=2、pH=10、
pH=12的缓冲溶液,应各选用哪种缓冲剂较好?
H3PO4、HAc、H2C204、H2CO3、HF
将10Ml0.1 mol.L-1 HAc溶液和10mL0.1 mol.L-1NaOH溶液混合后,问所得溶液是否具有缓冲能力?使用pH试纸检验溶液的pH时,应注意那些问题
第二篇:分析化学实验-常用缓冲溶液的配制及原理-北理工
分析化学实验-缓冲溶液配制原理&常用缓冲溶液的配制
一、缓冲溶液与缓冲作用原理
(一)缓冲作用与缓冲溶液
纯水在25℃时PH值为7.0,但只要与空气接触一段时间,因为吸收二氧化碳而使PH值降到5.5左右。1滴浓盐酸(约12.4mol·L-1)加入1升纯水中,可使[H+]增加5000倍左右(由1.0×10-7增至5×10-4mol·L-1),若将1滴氢氧化钠溶液(12.4mol·L-1)加到1升纯水中,PH变化也有3个单位。可见纯水的PH值因加入少量的强酸或强碱而发生很大变化。然而,1滴浓盐酸加入到1升HAc-NaOAc混合溶液或NaH2PO4-Na2HPO4混合溶液中,[H+]的增加不到百分之一(从1.00×10-7增至1.01×10-7mol·L-1),PH值没有明显变化.这种能对抗外来少量强酸\强碱或稍加稀释不引起溶液PH值发生明显变化的作用叫做缓冲作用;具有缓冲作用的溶液,叫做缓冲溶液。
(二)缓冲溶液的组成
缓冲溶液由足够浓度的共轭酸碱对组成。其中,能对抗外来强碱的称为共轭酸,能对抗外来强酸的称为共轭碱,这一对共轭酸碱通常称为缓冲对、缓冲剂或缓冲系,常见的缓冲对主要有三种类型。
1.弱酸及其对应的盐 例如,HAc-NaOAc(实际上是Ac-);H2CO3-NaHCO3;H2C8H4O4-KHC8H4O4(邻苯二甲酸-邻苯二甲酸氢钾);H3BO3-Na2B4O7(四硼酸钠水解后产生H2BO-3)。
2.多元弱酸的酸式盐及其对应的次级盐,例如,NaHCO3-Na2CO3;NaH2PO4-Na2HPO4;NaH2C5HO7(柠檬酸二氢钠)-Na2HC6H5O7;KHC8H4O4-K2C8H4O4。
3.弱碱及其对应的盐 例如NH3-NH+4CL-;RNH2-RNH+3A-(伯胺及其盐);Tris-TrisH+A-(三羟甲基烷及其盐)。
(三)缓冲溶液的作用原理
现以HAc-NaOAc缓冲溶液为例,说明缓冲溶液之所以能抵抗少量强酸或强碱使PH稳定的原理。醋酸是弱酸,在溶液中的离解度很小,溶液中主要以HAc分子形式存在,Ac-的浓度很低。醋酸钠是强电解质,在溶液中全部离解成Na+和Ac-,由于同离子效应,加入NaOAc后使HAc离解平衡向左移动,使HAc的离解度减小,[HAc]增大。所以,在HAc-NaOAc混合溶液中,存在着大量的HAc和Ac-。其中HAc主要来自共轭酸HAc,Ac-主要来自NaOAc。这个溶液有一定的[H+],即有一定的PH值。
 在HAc-NaOAc缓冲溶液中,存在着如下的化学平衡:
在HAc-NaOAc缓冲溶液中,存在着如下的化学平衡:
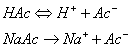
在缓冲溶液中加入少量强酸(如HCL),则增加了溶液的[H+]。假设不发生其他反应,溶液的PH值应该减小。但是由于[H+]增加,抗酸成分即共轭碱Ac-与增加的H+结合成HAc,破坏了HAc原有的离解平衡,使平衡左移即向生成共轭碱HAc分子的方向移动,直至建立新的平衡。因为加入H+较少,溶液中Ac-浓度较大,所以加入的H+绝大部分转变成弱酸HAc,因此溶液的PH值不发生明显的降低。
在缓冲溶液中加入少量强碱(如NaOH),则增加了溶液中OH-的浓度。假设不发生其他反应,溶液的PH值应该增大。但由于溶液中的H+立即加入的OH-结合成更难离解的H2O,这就破坏了HAc原有的离解平衡,促使HAc的离解平衡向右移动,即不断向生成H+和Ac-的方向移动 ,直至加入的OH-绝大部分转变成H2O,建立新的平衡为止。因为加入的OH-少,溶液中抗碱成分即共轭酸HAc的浓度较大,因此溶液的PH值不发生明显升高。
在溶液稍加稀释时,其中[H+]虽然降低了,但[Ac-]同时降低了,同离子效应减弱,促使HAc的离解度增加,所产生的H+可维持溶液的PH值不发生明显的变化。所以,溶液具有抗酸、抗碱和抗稀释作用。
多元酸的酸式盐及其对应的次级盐的作用原理与前面讨论的相似。例如,在NaH2PO4-Na2HPO4溶液中存在着离解平衡:
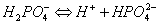
足量共轭酸,主要来自磷酸二氢钠 足量共轭碱,主要来自磷酸氢二钠
HPO2-4是抗酸成分,通过平衡移能对抗外加酸的影响。H2PO2-4是抗碱成分,通过平衡右移能对抗外加碱的影响。
弱碱及其对应盐的缓冲作用原理,例如,NH3-NH4CL(即NH3-NH+4)溶液中,NH3能对抗外加酸的影响是抗酸成分,NH+4能对抗外加碱的影响是抗碱成分。前者通过下述平衡向右移动而抗酸,后者通过平衡向左移动而抗碱,从而使溶液的PH值稳定。
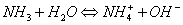
足量共轭酸,主要来自氨气 足量共轭碱,主要来自氯化铵
二、缓冲溶液PH的计算
(一)亨德森方程式
在缓冲溶液例如HAc-NaAc溶液中,有以下的离解平衡:
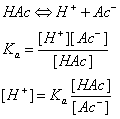
等式两边各取负对数,则
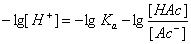
即

HAc的离解度比较小,由于溶液中大量的Ac-对HAc所产生的同离子效应,使HAc的离解度变得更小。因此上式中的[HAc]可以看作等于HAc的总浓度[共轭酸](即缓冲溶液中共轭酸的浓度)。同时,在溶液中NaAc全部离解,可以认为溶液中[Ac-]等于NaAc的总浓度[共轭碱](即配制的缓冲溶液中共轭碱的浓度)。将[共轭酸]和[共轭碱]代入上式,则得
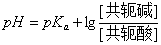 (3-11)
(3-11)
上式称为亨德森-哈塞尔巴赫方程式,简称为亨德森(Henderson)方程式。它表明缓冲溶液的
PH值决定于共轭酸的离解常数Ka和组成缓冲溶液的共轭碱与共轭酸浓度的比值。对于一定的共轭酸,PKa为定值,所以缓冲溶液的PH就决定于两者浓度的比值即缓冲比。当缓冲溶液加水稀释时,由于共轭碱和共轭酸的浓度受到同等程度的稀释,缓冲比是不变的;在一定的稀释度范围内,缓冲溶液的PH值实际上也几乎不变。
式(3-11)中的浓度项指的是混合溶液中共轭酸碱的浓度,而不是混合前的浓度.若混合前共轭酸的量浓度是c酸,体积是V酸,共轭碱的量浓度是c碱,体积是V碱,则式(3-11)可改写成:
 (3-12)
(3-12)
若两种溶液的量浓度相等,则
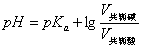 (3-13)
(3-13)
若是等体积的两溶液相混合,则
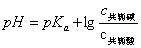 (3-14)
(3-14)
以上几种形式都称为亨德森方程式,可用以计算各种组成类型缓冲溶液的PH近似值。当用于弱酸及其对应的盐组成的缓冲溶液的PH值时,PKa即弱酸的离解常数负对数(见书后附表),[共轭碱]即[弱酸盐]。当用于多元弱酸的酸式盐及其对应的次级盐组成缓冲溶液的PH值时,共轭酸即酸式盐,pKa即该酸式盐负离子的离解常数的负对数,共轭碱即该酸式盐的次级盐。例如,NaHCO3-Na2CO3缓冲溶液的PH值:
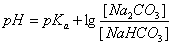 (3-15)
(3-15)
式中PKa即H2CO3的PKa2。
同样,NaH2PO4-Na2HPO4缓冲溶液的PH值:
 (3-16)
(3-16)
式中PKa为H3PO4的PKa2。
弱碱和它的共轭酸缓冲溶液的PH值也可根据式(3-11)计算。
二、常用缓冲溶液的配制
(一)甘氨酸-盐酸缓冲液(0.05 mol/L)
X毫升0.2 mol/L甘氨酸+Y毫升0.2 mol/L HCl,再加水稀释至200毫升。
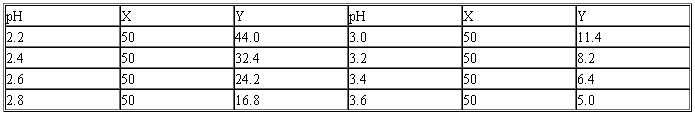
甘氨酸分子量=75.07。
0.2 mol/L甘氨酸溶液含15.01 g/L。
(二)邻苯二甲酸-盐酸缓冲液(0.05 mol/L)
X毫升0.2 mol/L邻苯二甲酸氢钾+Y毫升0.2 mol/L HCl,再加水稀释至20毫升。
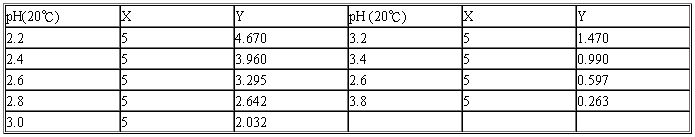
邻苯二甲酸氢钾分子量=204.23。0.2 mol/L邻苯二甲酸氢钾溶液含40.85 g/L。
(三)磷酸氢二钠-柠檬酸缓冲液
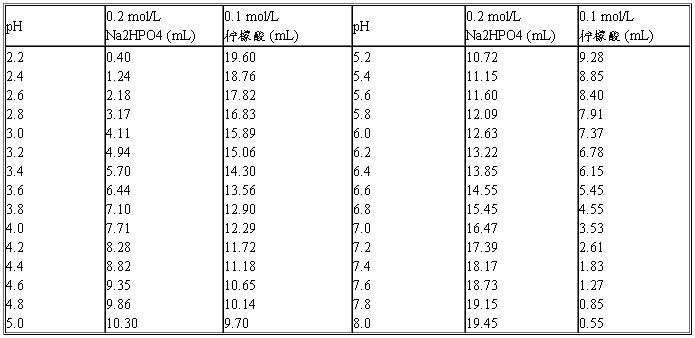
Na2HPO4分子量=141.98;0.2 mol/L溶液为28.40 g/L。
Na2HPO4·2H2O分子量=178.05;0.2 mol/L溶液为35.61 g/L。
Na2HPO4·12H2O分子量=358.22;0.2 mol/L溶液为71.64 g/L。
C6H8O7·H2O分子量=210.14;0.1 mol/L溶液为21.01 g/L。
(四)柠檬酸-氢氧化钠-盐酸缓冲液

① 使用时可以每升中加入1克酚,若最后pH值有变化,再用少量50%氢氧化钠溶液或浓盐酸调节,冰箱保存。
(五)柠檬酸-柠檬酸钠缓冲液(0.1 mol/L)
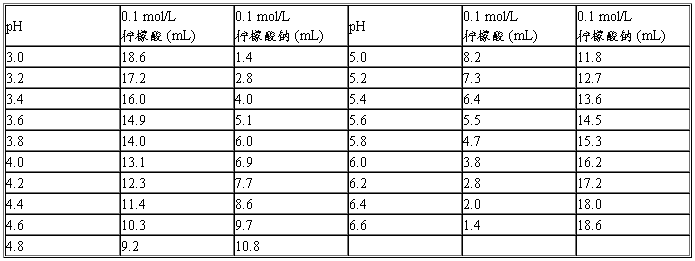
柠檬酸:C6H8O7·H2O分子量=210.14 ;0.1 mol/L溶液为21.01 g/L。
柠檬酸钠:Na3C6H5O7·2H2O分子量=294.12 ;0.1 mol/L溶液为29.41 g/L。
(六)醋酸-醋酸钠缓冲液(0.2 mol/L)

NaAc·3H2O分子量=136.09;0.2 mol/L溶液为27.22 g/L。冰乙酸11.8 mL稀释至1 L(需标定)。
(七)磷酸二氢钾-氢氧化钠缓冲液(0.05 mol/L)
X 毫升 0.2 mol/L KH2PO4+Y毫升0.2 mol/L NaOH 加水稀释至20毫升。

(八)磷酸盐缓冲液 磷酸氢二钠-磷酸二氢钠缓冲液(0.2 mol/L)
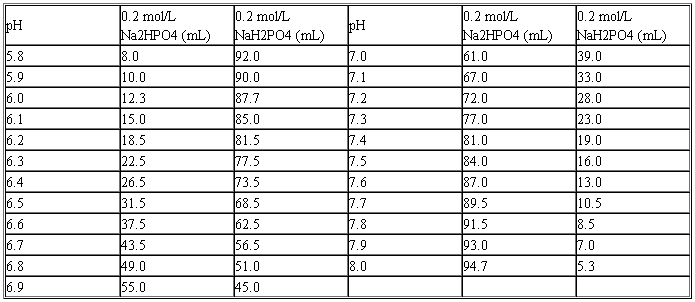
Na2HPO4·2H2O分子量=178.05;0.2 mol/L溶液为35.61 g/L。
Na2HPO4·12H2O分子量=358.22;0.2 mol/L溶液为71.64 g/L。
NaH2PO4·H2O分子量=138.01;0.2 mol/L溶液为27.6 g/L。
NaH2PO4·2H2O分子量=156.03;0.2 mol/L溶液为31.21 g/L。
(九)巴比妥纳-盐酸缓冲液
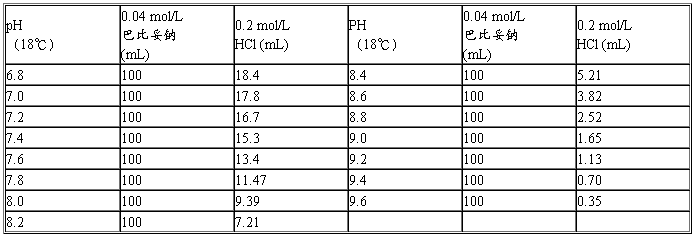
巴比妥钠分子量=206.18;0.04 mol/L溶液为8.25 g/L。
(十)Tris-HCl缓冲液(0.05 mol/L)
50毫升0.1mol/L三羟甲基氨基甲烷(Tris)溶液与X毫升0.1mol/L盐酸混匀并稀释至100毫升。

Tris分子量=121.14 ;0.1 mol/L溶液为12.114 g/L。Tris溶液可从空气中吸收二氧化碳,使用时注意将瓶盖严。
(十一)、硼酸-硼砂缓冲液 (0.2 mol/L硼酸根)
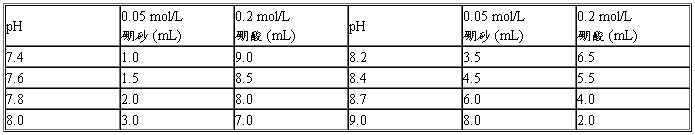
硼砂:Na2B4O7·10H2O分子量=381.43;0.05 mol/L溶液(等于0.2 mol/L硼酸根)含19.07 g/L。
硼酸:H3BO3分子量=61.84;0.2 mol/L的溶液为12.37 g/L。
硼砂易失去结晶水,必须在带塞的瓶中保存。
(十二)甘氨酸-氢氧化钠缓冲液(0.05 mol/L)
X毫升0.2 mol/L甘氨酸+Y毫升0.2 mol/L NaOH加水稀释至200毫升。

甘氨酸分子量=75.07;0.2 mol/L溶液含15.01 g/L
(十三)硼砂-氢氧化纳缓冲液(0.05 mol/L硼酸根)
X毫升0.05 mol/L硼砂+Y毫升0.2 mol/L NaOH加水稀释至200毫升。
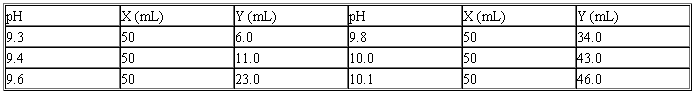
硼砂Na2B4O7·10H2O分子量=381.43;0.05 mol/L硼砂溶液(等于0.2 mol/L硼酸根)为19.07 g/L。
(十四)碳酸钠-碳酸氢钠缓冲液(0.1 mol/L)(此缓冲液在Ca2+、Mg2+存在时不得使用).
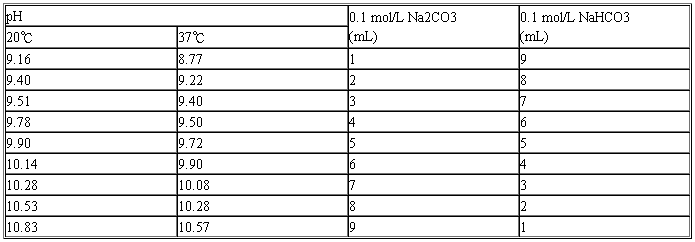
Na2CO3·10H2O分子量=286.2; 0.1 mol/L溶液为28.62 g/L。
NaHCO3分子量=84.0; 0.1 mol/L溶液为8.40 g/L。
========================(20##年6月16日更新)==============================
三、缓冲容量与缓冲范围
(一)缓冲容量
缓冲能力的强弱,可用缓冲容量β表示。缓冲容量也叫缓冲值或缓冲指数。
对任何一种缓冲溶液的每一个PH值,都有其相应的缓冲量。缓冲容量实际上是一个微分比,可定义为:使1升缓冲溶液的PH值增高很小一个数值dPH时,需加入的强碱物质的量为db,则db与dPH之比值叫缓冲容量,用数学式表示为β=db/dPH缓冲mol·L-1·PH-1。如总浓度(即共轭酸与共轭碱浓度之和)为0.100mol·L-1PH4.45的HAc-NaOAc缓冲溶液(即醋酸缓冲溶液)的缓冲容量为0.051(mol·L-1·PH-1)。
在实际工作中,我们可以通过测量加入强碱的增量Δb(或加入强酸,相对于减少强碱量-Δb),同时测量相应的PH值的增量ΔPH(或加入强酸,PH减小,-ΔPH),从两者比值求得β。因此缓冲容量在数值上等于使1毫升缓冲溶液的PH值改变1个单位时所必须加入的强碱或强酸的物质的量(通常单位用毫摩)。
加入碱Δb以后,溶液PH值增大,加入酸以后(相当于减去Δb),溶液PH值减小,所以β总是正值。
(二)影响缓冲容量的因素
缓冲容量的大小与缓冲溶液的缓冲比和总浓度有关。
缓冲溶液的缓冲容量取决于缓冲溶液的总浓度及缓冲比.可得出如下结论:
1.当缓冲溶液的缓冲比一定时,溶液的PH值也一定。缓冲溶液的缓冲容量取决于缓冲溶液的总浓度和缓冲比的比值。
2.当缓冲溶液的PH值一定时,即缓冲比垢比值一定时,缓冲溶液的总浓度越大,则加入少量强酸或强碱所引起缓冲比的比值变化越小,PH改变越小,缓冲容量就越大。图3-1表示两种总浓度都一定的醋酸缓冲溶液的β分别随缓冲比和PH改变的情况。总浓度为0.1mol·L-1和0.05 mol·L-1的醋酸缓冲溶液,当缓冲比为1:1时,PH为4.75,β分别为0.0575和0.0288(mol·L-1·PH-1),总浓度大的溶液缓冲容量较大。从式(3-18)也可见,当缓冲比一定即m和n的数值一定时,β与缓冲溶液的总浓度成正比。总浓度一般在0.05-0.20mol·L-1范围内。
3.当缓冲溶液的总浓度一定时,它的缓冲容量以缓冲比等于1(即[共轭碱]=[共轭酸])时为最大。这时溶液的PH=PKa。当溶液的缓冲比与1偏离愈远,则PH值与PKa的偏差也随着增大,溶液的缓冲容量也随着减小。当溶液的缓冲比大于10/1或小于1/10时,则溶液的缓冲容量极小,一般认为没有缓冲能力。从图3-1看出,对总浓度一定的缓冲溶液来说,当缓冲比愈接近于1:1,缓冲容量愈大;当缓冲比等于1:1,即缓冲溶液的PH值等于PKa时,缓冲容量达极大值(β极大)。当m=n=1,式(3-18)成为
β极大=2.30×1/2×1/2×β极大=0.575β极大 (3-19)
4.由足够浓度的共轭酸碱对组成的溶液,只能在一定的PH值范围内发挥有效的缓冲作用。这个能发挥有效缓冲作用的PH范围,叫缓冲范围。当缓冲比为1/10时,PH=PKa-1;当缓冲比为10/1时,PH=PKa+1。故缓冲范围PH值大致在PKa-1至PKa+1约两个PH单位范围内,即在PH= PKa±1的近似范围内,才能表现出缓冲作用。而且同一溶液在不同的PH值时,缓冲容量也不相同。从图3-1,缓冲超出此范围时,β值很小(<0.01),已无缓冲作用。
5.不同缓冲对所组成的缓冲溶液,由于共轭酸的PKa值不同,因此它们的缓冲范围也各不相同。
四、缓冲溶液的配制
在配制具有一定PH值的缓冲溶液时,为了使所得溶液具有较好的缓冲能力,应注意以下原则:
1.选择适当的缓冲对,使配制溶液的PH值在所选择的缓冲对的缓冲范围内。这个范围大约在PKa±1之内。例如HAc-Ac-缓冲对的范围是3.7-5.6,要配制PH从3.7-5.6之间的缓冲溶液可选用这一缓冲对。
2.缓冲对中作为共轭酸的PKa,应尽量接近于配制溶液的PH值。例如,要配制PH为5.3的缓冲溶液时,可以选用HAc-OAc=或HC8H4O4-C8H4O2-4缓冲对,因为pH5.3恰恰在这两种缓冲对的缓冲范围内。但是,前者的共轭酸的PKa 为4.75;后者共轭酸的PKa 为5.4,所以选用HC8H4O-4-C8H4O2-4配制的缓冲溶液较选用前者有更大的缓冲容量。
3.要有一定的总浓度(通常在0.05-0.20mol·L-1之间)使所配成溶液具有足够的缓冲容量,并采用适当的缓冲比使溶液的pH恰好等于所需要的PH值。
在具体配制时,为了简便起见,常用相同浓度的共轭酸碱溶液。此种情况可用式(3-13)计算所需两种溶液的体积。然后根据体积比,把共轭酸碱两种溶液混合,即得所需的缓冲溶液。
配制缓冲溶液还可采用共轭酸中加氢氧化钠或共轭碱中加盐酸的办法。两种方法都可组成有足够浓度的共轭酸碱对的缓冲溶液。
应用亨德森方程式来配制缓冲溶液,没有考虑溶液的离子强度的影响。
一些缓冲溶液的配制法可查阅参考书或附录克拉克缓冲系列及碱性缓冲系列表,其准确度较高,表中的浓度及体积都要求准确。表中稀释值ΔPH1/2表示缓冲溶液用等体积水稀释后Ph 的变化。Tris缓冲系适合生理学和生物化学要求,比较常用。
同学,北理工的吧?
学长我当时做这个实验的时候没有找到资料,所以,这是特意为你们整理的哟。
好好做哦~
-
《缓冲溶液的配制与性质》
实验一缓冲溶液的配制和性质溶液pH值测定实验目的12345学习缓冲溶液及常用等渗磷酸盐缓冲溶液的配制方法加深对缓冲溶液性质的理解强…
-
实验七:缓冲溶液的配制与性能
实验七缓冲溶液的配制与性能一实验目的1学习缓冲溶液的配制方法加深对缓冲溶液性质的理解2了解缓冲容量与缓冲剂浓度和缓冲组分的比值关系…
-
《缓冲溶液的配制与性质》黄燕军
实验三缓冲溶液的配制和性质溶液pH值测定实验目的12345学习缓冲溶液及常用等渗磷酸盐缓冲溶液的配制方法加深对缓冲溶液性质的理解强…
-
《缓冲溶液的配制与性质》黄燕军
实验三缓冲溶液的配制和性质溶液pH值测定实验目的12345学习缓冲溶液及常用等渗磷酸盐缓冲溶液的配制方法加深对缓冲溶液性质的理解强…
-
实验一:一定物质量浓度溶液的配制实验报告
实验目的1熟练掌握配制一定物质的量浓度的溶液及容量瓶的使用方法2加深对物质的量浓度概念的理解实验内容配制01molL硫酸铜溶液1实…
-
EDTA标准溶液的配制与标定实验报告
EDTA标准溶液的配制与标定EDTA标准溶液的配制与标定一实验目的1掌握EDTA标准溶液的配制与标定方法2掌握铬黑T指示剂的应用条…
-
《缓冲溶液的配制与性质》
实验一缓冲溶液的配制和性质溶液pH值测定实验目的12345学习缓冲溶液及常用等渗磷酸盐缓冲溶液的配制方法加深对缓冲溶液性质的理解强…
-
《缓冲溶液的配制与性质》黄燕军
实验三缓冲溶液的配制和性质溶液pH值测定实验目的12345学习缓冲溶液及常用等渗磷酸盐缓冲溶液的配制方法加深对缓冲溶液性质的理解强…
-
《缓冲溶液的配制与性质》黄燕军
实验三缓冲溶液的配制和性质溶液pH值测定实验目的12345学习缓冲溶液及常用等渗磷酸盐缓冲溶液的配制方法加深对缓冲溶液性质的理解强…
- 一定溶质质量分数的氯化钠溶液的配制实验报告单
-
一定物质量浓度溶液的配制实验报告
配制一定物质的量浓度的溶液考试内容配制100ml01molLNa2CO3溶液实验名称配制100ml01molLNa2CO3溶液实验…