《缓冲溶液的配制与性质》黄燕军
实验三 缓冲溶液的配制和性质、溶液pH值测定
【实验目的】
1. 学习缓冲溶液及常用等渗磷酸盐缓冲溶液的配制方法。
2. 加深对缓冲溶液性质的理解。
3. 强化吸量管的使用方法。
4. 学习使用pHS-2C型酸度计。
5. 培养环境保护意识。
【预习作业】
1. 一般性溶液与缓冲溶液有什么不同?为什么缓冲溶液具有缓冲能力?
2. 缓冲溶液的性质有哪些?缓冲溶液的pH值由哪些因素决定?
3. 如何衡量缓冲溶液的缓冲能力大小?缓冲溶液的缓冲能力与什么因素有关?
4. 实验是如何设计以验证缓冲溶液所具有的性质及缓冲容量的影响因素的,设计时有哪些注意事项?
5. 该如何检测缓冲溶液的pH值是否发生改变?是否均需要用pH计?
6. 本实验属定量测定还是定性测定或半定量测定?
【实验原理】
普通溶液不具备抗酸、抗碱、抗稀释作用。
缓冲溶液通常是由足够浓度的弱酸及其共轭碱、弱碱及其共轭酸或多元酸的酸式盐及其次级盐组成的溶液,具有抵抗外加的少量强酸或强碱、或适当稀释而保持溶液pH值基本不变的作用。
本实验通过将普通溶液和配制成的缓冲溶液对加入酸、碱或适当稀释前后pH数值的变化来探讨缓冲溶液的性质。
根据缓冲溶液中共轭酸碱对所存在的质子转移平衡:
HB? B-+H3O+
缓冲溶液pH值的计算公式为:
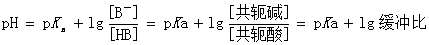
式中pKa为共轭酸解离常数的负对数。此式表明:缓冲溶液的pH值主要取决于弱酸的pKa值,其次决定于其缓冲比。
需注意的是,由上述公式算得的pH值是近似的,准确的计算应该用活度而不应该用浓度。要配制准确pH值的缓冲溶液,可参考有关手册和参考书上的配方,它们的pH值是由精确的实验方法确定的。
缓冲容量(β)是衡量缓冲能力大小的尺度。缓冲容量(β)的大小与缓冲溶液总浓度、缓冲组分的比值有关。
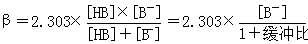
缓冲溶液总浓度越大则β越大;缓冲比越趋向于1,则β越大,当缓冲比为1时,β达极大值。
实验室中最简单的测定缓冲容量的方法是利用酸碱指示剂变色来进行判断的。例如:本实验就使用了甲基红指示剂。
表2-3-1 甲基红指示剂变色范围

医学上常用PBS(等渗磷酸盐缓冲盐水)作为体外细胞缓冲培养液。PBS是与人体血浆渗透压(280~320mOsmol·L-1)等渗,并与人体血液pH值(7.35~7.45)一致的含有NaCl、KCl、Na2HPO4、KH2PO4等物质的磷酸盐缓冲液。根据不同用途,PBS有不同的配制方法,如用于细胞培养的pbs配方为:8g NaCl,0.2g KCl,0.24g KH2PO4,1.44g Na2HPO4,加水至800ml,用HCl调pH至7.4,补水至1L,消毒灭菌既得。
其在水溶液中的质子转移平衡如下:
H2PO4-+H2O? H2PO42-+H3O+ Ka2
由上式可知该缓冲液pH的计算公式为
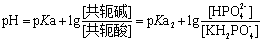
该公式计算出来的数值由于未考虑溶液的活度,所以所得的数值仍为近似值。
【仪器与试剂】
仪器:吸量管(1ml×2,2ml×3,5ml×2,20ml×1),量筒(1ml×2,2ml×1),烧杯(50ml×4,500ml×1),试管(10ml×15),试管架一个,滴管1支,玻棒1支,洗瓶一个,pHS-2C型酸度计等
试剂:1.0mol·L-1 HAc,0.1mol·L-1HAc,1.0mol·L-1 NaAc,0.10mol·L-1 NaAc, 0.15mol·L-1KH2PO4,0.10mol·L-1Na2HPO4,0.15mol·L-1NaCl,0.15mol·L-1KCl,1.0mol·L-1NaOH,1.0mol·L-1HCl,0.15mol·L-1HCl,蒸馏水,甲基红指示剂,广泛pH试纸,自带试样两份
【实验步骤】(方法1)
一、缓冲溶液的配制
用吸量管按照表2-3-2中规定的试剂规格和用量,将各试剂分别加入到已标号的指定容器中混匀,备用。
二、缓冲溶液的性质
1. 缓冲溶液的抗酸、抗碱、抗稀释作用
取7支10ml试管,按表2-3-3要求进行实验,记录实验数据,解释所得结果。
2. 缓冲容量与缓冲溶液总浓度(c)及缓冲比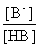 的关系
的关系
取6支10ml试管,按表2-3-4要求进行实验。记录实验数据,解释所得结果。
注意:5,6号试管滴加1.0mol·L-1NaOH溶液时每加一滴NaOH溶液都要使溶液混合均匀,至溶液的颜色刚好变成黄色。记录所加的滴数。
三、PBS溶液及自带试样溶液pH值的测定
先用pH试纸测量PBS溶液及自带试样溶液的pH值。然后用pHS-2C型酸度计分别测定它们的pH值,比较一下所测的pH数值是否与你预想的一致。
【数据记录与结果分析】

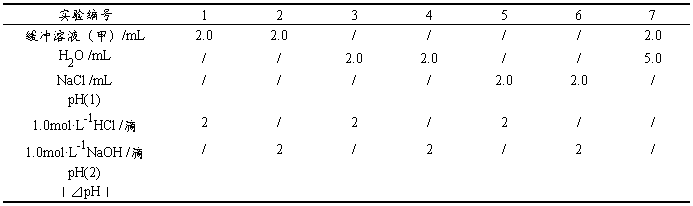
表2-3-2 缓冲溶液的配制
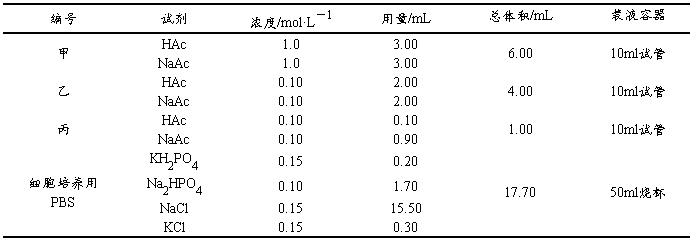
表2-3-3 缓冲溶液的抗酸、抗碱、抗稀释作用
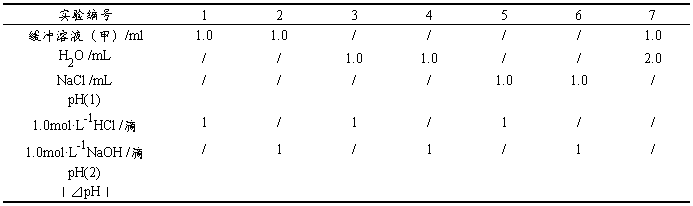
结论:
表2-3-4 缓冲容量β与缓冲比(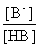 )及缓冲溶液总浓度(c)间的关系
)及缓冲溶液总浓度(c)间的关系
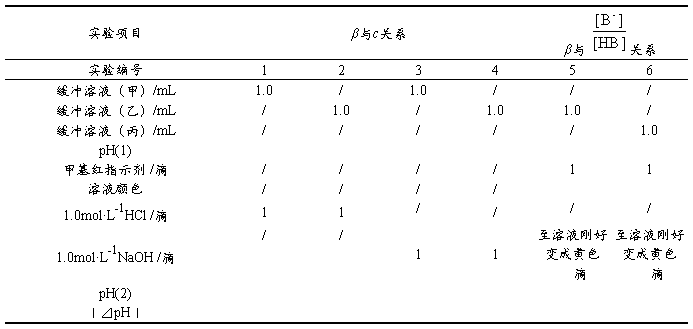
结论:
表2-3-5 PBS溶液及自带试样溶液pH值的测定

结论:
备注:本实验方法配制的细胞培养用PBS溶液,已与人体血浆渗透压等渗,若PBS溶液pH不等于7.4,可直接用0.15mol·L-1HCl调节至7.4。
(方法2)
【仪器与试剂】
仪器:吸量管(1ml×2,2ml×1,20ml×1),量筒(1ml×5),烧杯(50ml×4,500ml×1),试管(10ml×18),试管架一个,滴管1支,玻棒1支,洗瓶一个,pHS-2C型酸度计等
试剂:1.0mol·L-1 HAc,0.1mol·L-1HAc,1.0mol·L-1 NaAc,0.10mol·L-1 NaAc, 0.15mol·L-1KH2PO4,0.10mol·L-1Na2HPO4,0.15mol·L-1NaCl,0.15mol·L-1KCl,1.0mol·L-1NaOH,1.0mol·L-1HCl,0.15mol·L-1HCl,蒸馏水,甲基红指示剂,广泛pH试纸,自带试样两份
【实验步骤】
一、一般溶液的抗酸、抗碱、抗稀释作用
取10支10ml试管,按照表2-3-6中要求进行实验。记录实验数据,解释普通溶液是否具有抗酸、抗碱、抗稀释作用。
二、缓冲溶液的配制及性质
取8支10ml试管,按照表2-3-7中要求进行实验。记录实验数据,解释缓冲溶液的抗酸、抗碱、抗稀释作用及缓冲容量的影响因素。
三、PBS溶液的配制及自带试样溶液pH值的测定
取50ml烧杯3个,其中一个按照表2-3-8中用量配制PBS溶液,然后用pH试纸测量PBS溶液及自带试样溶液的pH值。再用pHS-2C型酸度计分别测定它们的pH值,比较一下所测的pH数值是否与你预想的一致。
【数据记录与结果分析】

表2-3-6 普通溶液否具有抗酸、抗碱、抗稀释作用
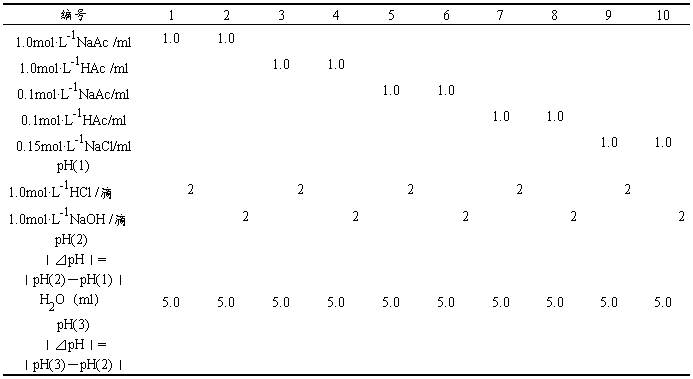
结论:
表2-3-7 缓冲溶液的配制及性质

结论:
表2-3-8 细胞培养用PBS缓冲溶液的配制及自带试样溶液pH值的测定

结论:
【思考题】
1. pH试纸与pHS-2C型酸度计测定溶液的pH值的准确度如何?
2. 为何每测定完一种溶液,复合电极需用蒸馏水洗净并吸干后才能测定另一种溶液?
3. 如果只有HAc和NaOH,HCl和NH3·H2O,KH3PO4和NaOH,能够进行上述实验吗?你将怎样进行设计实验?
第二篇:《缓冲溶液的配制与性质》黄燕军
实验三 缓冲溶液的配制和性质、溶液pH值测定
【实验目的】
1. 学习缓冲溶液及常用等渗磷酸盐缓冲溶液的配制方法。
2. 加深对缓冲溶液性质的理解。
3. 强化吸量管的使用方法。
4. 学习使用pHS-2C型酸度计。
5. 培养环境保护意识。
【预习作业】
1. 一般性溶液与缓冲溶液有什么不同?
2. 缓冲溶液的性质有哪些?
3. 如何衡量缓冲溶液的缓冲能力大小?缓冲溶液的缓冲能力与什么因素有关?
4. 实验是如何设计以验证缓冲溶液所具有的性质及缓冲容量的影响因素的,设计时有哪些注意事项?
5. 该如何检测缓冲溶液的pH值是否发生改变?是否均需要用pH计?
6. 本实验属定量测定还是定性测定或半定量测定?
【实验原理】
普通溶液不具备抗酸、抗碱、抗稀释作用。
缓冲溶液通常是由足够浓度的弱酸及其共轭碱、弱碱及其共轭酸或多元酸的酸式盐及其次级盐组成的,具有抵抗外加的少量强酸或强碱、或适当稀释而保持溶液pH值基本不变的作用。
本实验通过将普通溶液和配制成的缓冲溶液对加入酸、碱或适当稀释前后pH数值的变化来探讨缓冲溶液的性质。
根据缓冲溶液中共轭酸碱对所存在的质子转移平衡:
HB? B-+H3O+
缓冲溶液pH值的计算公式为:
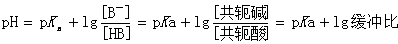
式中pKa为共轭酸解离常数的负对数。此式表明:缓冲溶液的pH值主要取决于弱酸的pKa值,其次决定于其缓冲比。
需注意的是,由上述公式算得的pH值是近似的,准确的计算应该用活度而不应该用浓度。要配制准确pH值的缓冲溶液,可参考有关手册和参考书上的配方,它们的pH值是由精确的实验方法确定的。
缓冲容量(β)是衡量缓冲能力大小的尺度。缓冲容量(β)的大小与缓冲溶液总浓度、缓冲组分的比值有关。
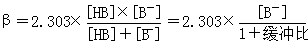
缓冲溶液总浓度越大则β越大;缓冲比越趋向于1,则β越大,当缓冲比为1时,β达极大值。
实验室中最简单的测定缓冲容量的方法是利用酸碱指示剂变色来进行判断的。例如:本实验就使用了甲基红指示剂。
表2-3-1 甲基红指示剂变色范围

医学上常用PBS(等渗磷酸盐缓冲盐水)作为体外细胞缓冲培养液。PBS是与人体血浆渗透压(280~320mOsmol·L-1)等渗,并与人体血液pH值(7.35~7.45)一致的含有NaCl、KCl、Na2HPO4、KH2PO4等物质的磷酸盐缓冲液。根据不同用途,PBS有不同的配制方法,如用于细胞培养的pbs配方为:8g NaCl,0.2g KCl,0.24g KH2PO4,1.44g Na2HPO4,加水至800ml,用HCl调pH至7.4,补水至1L,消毒灭菌既得。
其在水溶液中的质子转移平衡如下:
H2PO4-+H2O? H2PO42-+H3O+ Ka2
由上式可知该缓冲液pH的计算公式为
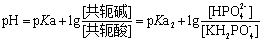
该公式计算出来的数值由于未考虑溶液的活度,所以所得的数值仍为近似值。
【仪器与试剂】
仪器:吸量管(5mL×5,10mL×5),比色管(20mL×4),量筒(10mL),烧杯(50mL×6),试管(10mL×6,20mL×6),滴管,玻棒,洗瓶,pHS-2C型酸度计等
试剂:1.0mol·L-1 HAc,0.1mol·L-1HAc,1.0mol·L-1 NaAc,0.10mol·L-1 NaAc, 0.15mol·L-1KH2PO4,0.10mol·L-1Na2HPO4,0.15mol·L-1NaCl,0.15mol·L-1KCl,1.0mol·L-1NaOH,1.0mol·L-1HCl,0.15mol·L-1HCl,蒸馏水,甲基红指示剂,广泛pH试纸,自带试样两份
【实验步骤】
一、缓冲溶液的配制
按照表2-3-2中用量,用吸量管配制甲、乙、丙及细胞培养用PBS缓冲溶液于已标号的四支10mL,25mL比色管中,备用。
二、缓冲溶液的性质
1. 缓冲溶液的抗酸、抗碱、抗稀释作用
取7支试管,按表2-3-3分别加入下列溶液,用广泛pH试纸测pH值。然后,分别在各试管中滴加2滴1mol·L-1HCl溶液或2滴1mol·L-1NaOH溶液,再测pH值。记录实验数据:解释所得结果。
2. 缓冲容量与缓冲溶液总浓度(c)及缓冲比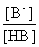 的关系
的关系
取6支试管,按表2-3-4分别加入下列溶液,测pH值。然后,在1~4号试管中各加2滴1mol·L-1HCl溶液或2滴1mol·L-1NaOH,再测pH值。5~6号试管中分别滴入2滴甲基红指示剂,溶液呈红色。然后一边振摇一边逐滴加入1.0mol·L-1NaOH溶液,直至溶液的颜色刚好变成黄色。记录所加的滴数。记录实验结果,解释所得结果。
三、PBS溶液及自带试样溶液pH值的测定
先用pH试纸测量PBS溶液及自带试样溶液的pH值。然后用pHS-2C型酸度计分别测定它们的pH值,比较一下所测的pH数值是否与你预想的一致。
【数据记录与结果分析】

表2-3-2 缓冲溶液的配制
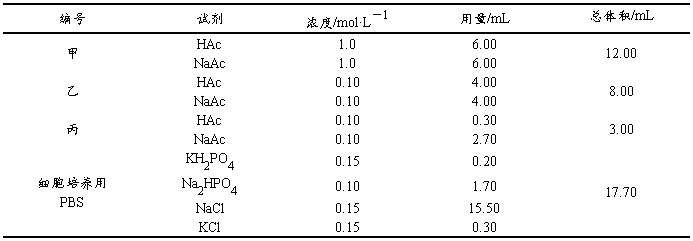
表2-3-3 缓冲溶液的抗酸、抗碱、抗稀释作用
结论:
表2-3-4 缓冲容量β与缓冲比(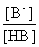 )及缓冲溶液总浓度(c)间的关系
)及缓冲溶液总浓度(c)间的关系
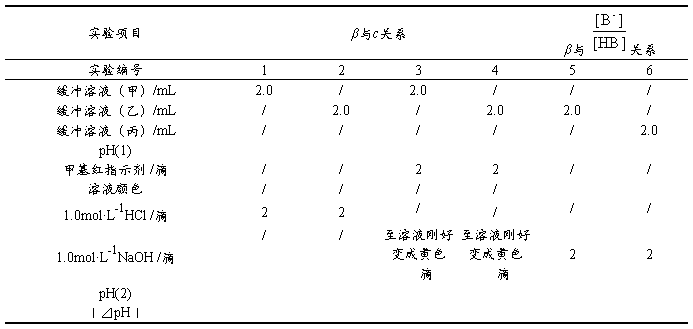
结论:
表2-3-5 PBS溶液及自带试样溶液pH值的测定

结论:
备注:本实验方法配制的细胞培养用PBS溶液,已与人体血浆渗透压等渗,若PBS溶液pH不等于7.4,可直接用0.15mol·L-1HCl调节至7.4。
【思考题】
1. 缓冲溶液的pH值由哪些因素决定?
2. 为什么缓冲溶液具有缓冲能力?
3. pH试纸与pHS-2C型酸度计测定溶液的pH值的准确度如何?
4. 为何每测定完一种溶液,复合电极需用蒸馏水洗净并吸干后才能测定另一种溶液?
5. 本实验是如何设计以验证这些性质的?
6. 本实验属定量测定还是定性测定或半定量测定?
7. 如果只有HAc和NaOH,,HCl和NH3·H2O,KH3PO4和NaOH,能够进行上述实验吗?你将怎样进行设计实验?
-
《缓冲溶液的配制与性质》
实验一缓冲溶液的配制和性质溶液pH值测定实验目的12345学习缓冲溶液及常用等渗磷酸盐缓冲溶液的配制方法加深对缓冲溶液性质的理解强…
-
实验七:缓冲溶液的配制与性能
实验七缓冲溶液的配制与性能一实验目的1学习缓冲溶液的配制方法加深对缓冲溶液性质的理解2了解缓冲容量与缓冲剂浓度和缓冲组分的比值关系…
-
《缓冲溶液的配制与性质》黄燕军
实验三缓冲溶液的配制和性质溶液pH值测定实验目的12345学习缓冲溶液及常用等渗磷酸盐缓冲溶液的配制方法加深对缓冲溶液性质的理解强…
-
实验一:一定物质量浓度溶液的配制实验报告
实验目的1熟练掌握配制一定物质的量浓度的溶液及容量瓶的使用方法2加深对物质的量浓度概念的理解实验内容配制01molL硫酸铜溶液1实…
-
实验活动5_一定溶质质量分数的氯化钠溶液的配制实验报告
实验报告班级姓名日期年月日一实验目的1练习配制一定溶质质量分数的溶液2加深对溶质的质量分数概念的理解二实验仪器与药品托盘天平烧杯玻…
-
EDTA标准溶液的配制与标定实验报告
EDTA标准溶液的配制与标定EDTA标准溶液的配制与标定一实验目的1掌握EDTA标准溶液的配制与标定方法2掌握铬黑T指示剂的应用条…
-
实验七:缓冲溶液的配制与性能
实验七缓冲溶液的配制与性能一实验目的1学习缓冲溶液的配制方法加深对缓冲溶液性质的理解2了解缓冲容量与缓冲剂浓度和缓冲组分的比值关系…
-
《缓冲溶液的配制与性质》
实验一缓冲溶液的配制和性质溶液pH值测定实验目的12345学习缓冲溶液及常用等渗磷酸盐缓冲溶液的配制方法加深对缓冲溶液性质的理解强…
-
《缓冲溶液的配制与性质》黄燕军
实验三缓冲溶液的配制和性质溶液pH值测定实验目的12345学习缓冲溶液及常用等渗磷酸盐缓冲溶液的配制方法加深对缓冲溶液性质的理解强…
- 一定溶质质量分数的氯化钠溶液的配制实验报告单