20xx年山东省大学生实验能竞赛 物理化学实验 弱电解质溶液电离平衡常数的测定
物理化学实验
实验一(2)、弱电解质溶液电离平衡常数的测定

说明:
1、本实验竞赛时间为 180 分钟(以选手在实验报告首页确认编号和监考教师签名为准),其中实验操作120分钟,数据处理60分钟。 每超时10分钟扣5分,最多不得超过20分钟;
2、实验设计要求从实验开始起20分钟内完成并交监考教师审阅。如果实验设计需监考老师部分指导,可提出申请,但需扣除相应的分数;
3、如果无法完成实验设计,可以由监考老师提供,但实验设计部分分数将被扣去;
4、请注意合理运筹时间。如在等待过程中,可进行后续实验准备或思考问答题等;
5、提供给每位选手的试剂已足够,请注意用量。不必要的过量使用将被扣分;
6、请认真阅读仪器使用说明并仔细操作。损坏仪器、打破玻璃器皿将被扣分。
7、实验完成后,请将所有玻璃仪器清洗干净,仪器设备归零、关闭电源。保持台面干净整洁,恢复原状。否则将被扣分;
8、本实验提供计算机及绘图软件(Origin, Excel)、毫米方格纸、直尺、铅笔、签字笔,供选用。
实验试题:
氨水溶液电离平衡常数的测定
实验原理:

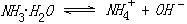
AB型弱电解质在溶液中电离达到平衡时,电离平衡常数KC与原始浓度C和电离度α有以下关系:
 (1)
(1)
在一定温度下KC是常数,因此可以通过测定AB型弱电解质在不同浓度时的α代入(1)式求出KC。
将电解质溶液注入电导池内,溶液电导(G)的大小与两电极之间的距离l成反比,与电极的面积A成正比:
G=κA/l  (2)
(2)
式中,l/A为电导池常数,以Kcell表示;κ为电导率。
由于电极的l和A不易精确测量,因此实验中用一种已知电导率值的溶液,先求出电导池常数Kcell,然后把待测溶液注入该电导池测出其电导值,再根据(2)式求其电导率。
摩尔电导率与电导率的关系:
Λm=κ/C (3)
式中,C为该溶液的浓度,其单位为mol·m-3。对于弱电解质溶液来说,可以认为:
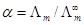 (4)
(4)
 是溶液在无限稀释时的摩尔电导率。
是溶液在无限稀释时的摩尔电导率。
将式(4)代入式(1)可得:
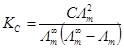 (5)
(5)
或
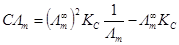 (6)
(6)
以CΛm对 1/Λm作图,其直线的斜率为 ( )2KC,若已知
)2KC,若已知 值,可求算KC。
值,可求算KC。
有关数据:
1、0.0100 mol·dm-3 KCl溶液的电导率

2、无限稀释离子的摩尔电导率和温度系数

根据氨水电离原理及提供的仪器设备和试剂,设计一“氨水溶液电离平衡常数的测定”实验,测定氨水溶液电离平衡常数。
供选用的主要仪器设备:
DDS-308A型电导率仪1台;超级恒温槽1台;夹套恒温反应池1只;50mL容量瓶5只;10mL移液管1支; 2mL移液管1支;250mL烧杯1只;废液回收杯1只。
供选用的试剂:
KCl溶液(0.010 mol·dm-3);氨水溶液(0.100 mol·dm-3);电导水。
回答问题(请将答案写在实验报告中):
1、为什么不能直接测量电导电极间的距离和面积计算电导池常数?
2、实验过程中,若电导率仪突然发生故障,换用另一台电导率仪继续做实验可以吗?以前的实验数据是否可用?为什么?
第二篇:实验一电导法测定弱电解质的电离平衡常数
实验一 电导法测定醋酸电离常数
一、实验目的
1.了解溶液电导、电导率和摩尔电导率的概念;
2.测量电解质溶液的摩尔电导率,并计算弱电解质溶液的电离常数。
二、实验原理
电解质溶液是靠正、负离子的迁移来传递电流。而弱电解质溶液中,只有已电离部分才能承担传递电量的任务。在无限稀释的溶液中可以认为电解质已全部电离,此时溶液的摩尔电导率为Λ∞m,而且可用离子极限摩尔电导率相加而得。
一定浓度下的摩尔电导率Λm与无限稀释的溶液中摩尔电导率Λ∞m是有差别的。这由两个因素造成,一是电解质溶液的不完全离解,二是离子间存在着相互作用力。所以,Λm通常称为表观摩尔电导率。
Λm/Λ∞m=α(U++ U-)/(U+∞+ U-∞)
若U+= U-,,U+∞=U-∞则
Λm/Λ∞m=α
式中α为电离度。
 AB型弱电解质在溶液中电离达到平衡时,电离平衡常数Ka?,起始浓度C0,电离度α有以下关系: AB A+ + B-
AB型弱电解质在溶液中电离达到平衡时,电离平衡常数Ka?,起始浓度C0,电离度α有以下关系: AB A+ + B-
起始浓度mol/L: C0 0 0
平衡浓度mol/L: C0·(1-α) αC0 αC0
Kc?=[c(A+)/c?][c(B-)/c?]/[c(AB)/c?]=C0α2/(1-α)=C0Λm2/[c?Λ∞m(Λ∞m-Λm)]
根据离子独立定律,Λ∞m可以从离子的无限稀释的摩尔电导率计算出来。Λm可以从电导率的测定求得,然后求出Ka?。
ΛmC0/c? =Λ∞m2Kc?/Λm-Λ∞mKc?
通过ΛmC0/c?~1/Λm作图,由直线斜率=Λ∞m2Kc?,可求出Kc?。
三、仪器与试剂
DDS-11A(T)型电导率仪1台;恒温槽1套;0.1000mol/L醋酸溶液。
四、实验步骤
1.调整恒温槽温度为25℃±0.3℃。
2.用洗净、烘干的义形管1支,加入20.00mL的0.1000mol/L醋酸溶液,测其电导率。
3.用吸取醋酸的移液管从电导池中吸出10.00mL醋酸溶液弃去,用另一支移液管取10.00mL电导水注入电导池,混合均匀,温度恒定后,测其电导率,如此操作,共稀释4次。
4.倒去醋酸溶液,洗净电导池,最后用电导水淋洗。注入20mL电导水,测其电导率。
五、实验注意事项
1.本实验配制溶液时,均需用电导水。
2.温度对电导有较大影响,所以整个实验必须在同一温度下进行。每次用电导水稀释溶液时,需温度相同。因此可以预先把电导水装入锥形瓶,置于恒温槽中恒温。
六、数据记录及处理
第一次实验:实验温度:25.2℃,电导池常数K(l/A):0.94 m-1,Λ∞m=390.72 s.cm2/mol-1
表1 醋酸电离常数的测定
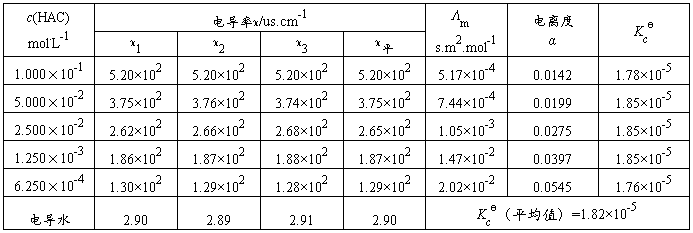
计算:Λm/s.m2.mol-1=(κHAC -κ电导水)us.cm-1×10-4/[c(HAC)mol.L-1×103]
={(κHAC -κ电导水) ×10-7/c(HAC)}
Λm(1)={(0.520×103-2.90)/(1.000×10-1)}×10-7=5.17×10-4s.m2.mol-1
Λm(2)={(0.375×103-2.90)/(5.000×10-2)}×10-7=7.44×10-4s.m2.mol-1
Λm(3)={(0.265×103-2.90)/(2.500×10-2)}×10-7=1.05×10-3s.m2.mol-1
Λm(4)={(0.187×103-2.90)/(1.250×10-3)}×10-7=1.47×10-2s.m2.mol-1
Λm(5)={(0.129×103-2.90)/(6.250×10-4)}×10-7=2.02×10-2s.m2.mol-1
Λ∞m(HAC)=Λ∞m(H+)+Λ∞m(AC-)=349.82s.cm2.mol-1+40.9s.cm2.mol-1
=390.72 s.cm2/mol=3.9072×10-2s.m2.mol-1
α=Λm/Λ∞m
α(1)= 5.17×10-4/ 3.9072×10-2=0.0142
α(2)= 7.44×10-4 / 3.9072×10-2=0.0199
α(3)= 1.05×10-3 / 3.9072×10-2=0.0275
α(4)= 1.47×10-2 / 3.9072×10-2=0.0397
α(5)= 2.02×10-2/ 3.9072×10-2=0.0545
Kc?=C0Λm2/[Λ∞m(Λ∞m-Λm)
Kc?(1)=1.000×10-1×(5.17×10-4)2/[390.72×(390.72-5.17)×10-8]=1.78×10-5
Kc?(2)=5.000×10-2×(7.44×10-4)2/[390.72×(390.72-7.44)×10-8]=1.85×10-5
Kc?(3)=2.500×10-2×(1.05×10-3)2/[390.72×(390.72-1.05)×10-8]=1.85×10-5
Kc?(4)=1.250×10-3×(1.47×10-3)2/[390.72×(390.72-1.47)×10-8]=1.85×10-5
Kc?(5)=6.250×10-3×(2.02×10-3)2/[390.72×(390.72-2.02)×10-8]=1.76×10-5
Kc?(平均值)= 1.82×10-5
表2 醋酸电离常数的测定

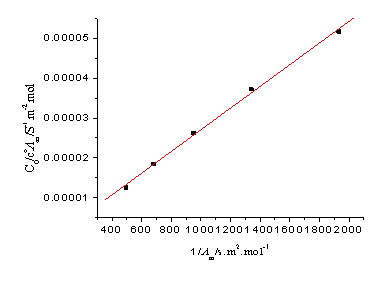
直线斜率=Λ∞m2Kc? =2.721×10-8,Kc?=2.721×10-8/(390.72×10-4)2=1.78×10-5
第二次实验:实验温度:24.9℃,电导池常数K(l/A):0.94 m-1,Λ∞m=390.72 s.cm2/mol-1
表1 醋酸电离常数的测定
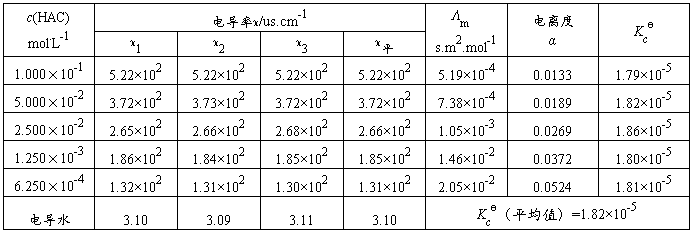
计算:Λm/s.m2.mol-1=(κHAC -κ电导水)us.cm-1×10-4/[c(HAC)mol.L-1×103]
={(κHAC -κ电导水) ×10-7/c(HAC)}
Λm(1)={(0.522×103-3.10)/(1.000×10-1)}×10-7=5.17×10-4s.m2.mol-1
Λm(2)={(0.372×103-3.10)/(5.000×10-2)}×10-7=7.44×10-4s.m2.mol-1
Λm(3)={(0.266×103-3.10)/(2.500×10-2)}×10-7=1.05×10-3s.m2.mol-1
Λm(4)={(0.185×103-3.10)/(1.250×10-3)}×10-7=1.46×10-2s.m2.mol-1
Λm(5)={(0.131×103-3.10)/(6.250×10-4)}×10-7=2.05×10-2s.m2.mol-1
Λ∞m(HAC)=Λ∞m(H+)+Λ∞m(AC-)=349.82s.cm2.mol-1+40.9s.cm2.mol-1
=390.72 s.cm2/mol=3.9072×10-2s.m2.mol-1
α=Λm/Λ∞m
α(1)= 5.19×10-4/ 3.9072×10-2=0.0133
α(2)= 7.38×10-4 / 3.9072×10-2=0.0189
α(3)= 1.05×10-3 / 3.9072×10-2=0.0269
α(4)= 1.46×10-2 / 3.9072×10-2=0.0372
α(5)= 2.05×10-2/ 3.9072×10-2=0.0524
Kc?=C0Λm2/[Λ∞m(Λ∞m-Λm)
Kc?(1)=1.000×10-1×(5.19×10-4)2/[390.72×(390.72-5.17)×10-8]=1.79×10-5
Kc?(2)=5.000×10-2×(7.38×10-4)2/[390.72×(390.72-7.44)×10-8]=1.82×10-5
Kc?(3)=2.500×10-2×(1.05×10-3)2/[390.72×(390.72-1.05)×10-8]=1.86×10-5
Kc?(4)=1.250×10-3×(1.46×10-3)2/[390.72×(390.72-1.47)×10-8]=1.80×10-5
Kc?(5)=6.250×10-3×(2.05×10-3)2/[390.72×(390.72-2.02)×10-8]=1.81×10-5
Kc?(平均值)= 1.82×10-5
表2 醋酸电离常数的测定
实验温度:24.9℃,电导池常数K(l/A):0.94 m-1,Λ∞m=390.72 s.cm2/mol-1
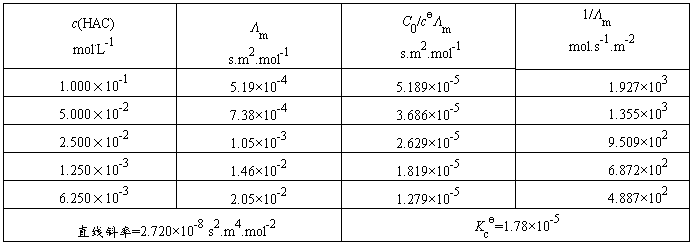
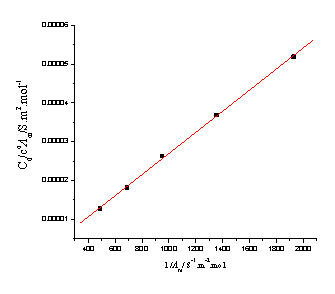
直线斜率=Λ∞m2Kc? =2.720×10-8,Kc?=2.720×10-8/(390.72×10-4)2=1.78×10-5
-
甲基红电离平衡常数测定实验预习报告
化学实验报告20xx年3月11日第一部分实验预习报告1实验目的要求测定弱电解质电离平衡常数了解指示剂变色反应原理学习使用721型或…
-
8 问题 实验七十七 化学平衡常数及分配系数的测定
实验七十七化学平衡常数及分配系数的测定预习提问1在实验中所用的碘量瓶和锥形瓶哪些需要干燥哪些不需要干燥为什么答1用标准Na2S2O…
-
分配系数和化学反应平衡常数的测定
分配系数和化学反应平衡常数的测定一实验目的1测定碘在四氯化碳和水中的分配系数2测定水溶液中碘与碘离子之间配合反应的标准平衡常数二实…
-
实验一 分光光度法测 液相反应的化学平衡常数
实验一分光光度计法测溶液化学反应的K一实验目的1利用分光光度计测定低浓度下铁离子与硫氰酸根离子生成硫氰合铁离子的平衡常数2通过实验…
-
6液相反应平衡常数的测定实验报告
华南师范大学实验报告学生姓名学号专业化学师范年级班级课程名称物理化学实验实验项目液相反应平衡常数的测定实验类型验证设计综合实验时间…
-
《水溶液中的解离平衡》实验报告
二实验步骤一同离子效应取两只小试管01molLHAc溶液及滴甲基橙混合均匀溶液呈红色在一试管中加入少量NaAcs观察指示剂颜色变化…
-
甲基红电离平衡常数测定实验预习报告
化学实验报告20xx年3月11日第一部分实验预习报告1实验目的要求测定弱电解质电离平衡常数了解指示剂变色反应原理学习使用721型或…
-
采用分光光度法测定弱电解质的电离常数实验报告
采用分光光度法测定弱电解质的电离常数实验报告一实验目的1了解一种测定弱电解质电离常数的方法2掌握分光光度计的测试原理和使用方法3进…
-
无机化学实验十一 电离平衡和沉淀反应
实验十一电离平衡和沉淀反应一实验目的1了解同离子效应对弱电解质电离平衡的影响2学习缓冲溶液的配制并了解其缓冲作用3加深理解盐类的水…
-
电导法测定乙酸电离平衡常数 实验报告
物理化学实验报告姓名何思思班级工艺五班学号教师李慎新学院材料化学与工程学院10031010526电导法测定乙酸电离平衡常数一实验目…