高中化学物质颜色总结
高中化学物质颜色总结
20##-02-16 12:15

首先要明确离子反应的概念。在反应中有离子参加或有离子生成的反应称为离子反应。在中学阶段仅限于在溶液中进行的反应,可以说离子反应是指在水溶液中有电解质参加的一类反应。因为电解质在水溶液里发生的反应,其实质是该电解质电离出的离子在水溶液中的反应。有离子参加的化学反应。离子反应的本质是某些离子浓度发生改变。常见离子反应多在水溶液中进行。根据反应原理,离子反应可分为复分解、盐类水解、氧化还原、络合4个类型;也可根据参加反应的微粒,分为离子间、离子与分子间、离子与原子间的反应等。
你把这些都弄明白了,就知道什么反应可以写成离子方程式啦1、写,指正确书写化学方程式,注意配平。
2、拆,是重中之重,归纳为三拆五不拆,即:强酸,可溶性强碱,可溶性盐拆开写;沉淀,气体,弱电解质,单质,氧化物不拆;微容物的处理则考虑形成溶液的强电解质拆,其余不拆
3、删,是指删掉方程式两端相同的离子
4、查,是指检查三守恒:质量守恒、电荷守恒、电子得失守恒 子方程式,顾名思义,要有离子参与才行,所以,没有离子参与的方程式就不能写成离子方程式(即不是在溶液中反应的化学反应)。当然,这只是常规判断,只对一般情况使用,特殊情况(例如,有潮湿环境的条件时)要具体情况具体分析
生成物中的沉淀、气体、弱电解质~~他们的组成元素中各元素的离子形式都是算参加反应的离子~~其他的元素除非反应物是沉淀、气体、弱电解质~~否则都算不参加反应的离子~~^ - ^
如果能写出相应的离子方程式就可以确定是离子反应了,而且需要有离子的参与,需要离子参与反应就要在溶液中或融熔状态下进行,因为这样才会有可移动的离子,首先看是否是复分解反应,如果是就一定是离子反应了,有些氧化还原反应也是离子反应也是离子反应,总之有离子加入反应就是了
继续追问: 来自手机问问 我就是不能判断它能不能写成离子方程式,能写的话,就不用问了。
补充回答: 来自手机问问 如果是考试的话它会标明让你写离子方程式的,
继续追问: 来自手机问问 可题目是这样子的:写出下列反应的反应方程式,是离子反应的写出离子方程式。
补充回答: 来自手机问问 额,那要看你积累的多不多咯,这个难概括,你看一下平时的离子反应有什么特征?
补充回答: 来自手机问问 我觉得反应物必须在溶液或者熔融状态下进行反应,不然就没有自由移动的离子,这是条件之一,还有离子与离子之间的反应总生成沉淀,气体,弱電电解质的方向进行,也就是复分解反应(绝对是离子反应),还有在一些在溶液或熔融下进行的氧化还原反应,
第二篇:高中化学物质颜色总结
高中化学物质颜色总结
1、红色世界
(1)基态:Fe2O3 (红褐色)、Fe (OH)3 (红 棕色)、[Fe (SCN)]2+ (血红色)、Cu (紫红色)、Cu2O (砖红色)、NO2 (红棕色)、P(红磷、暗红色)、Br2 (深红棕色)、红色石蕊试纸、 品红溶液。
(2)激发态:充氦气的灯光呈粉红色,充氖气的灯光呈红色,钙元素的焰色呈砖红色。
(3)化学变化:
①紫色石蕊在酸性溶液(pH<5.0)中变红,
②润湿的蓝色石蕊试纸遇酸性(CO2、SO2 、H2S 、HCl)变红,
③酚酞在碱性溶液中呈浅红色(8.2<pH<10.0)或红色(pH>10),
④甲基橙在酸性溶液(pH<3.1)中呈红色,
⑤甲基红在酸性溶液(pH<4.4)中呈红色,
⑥pH试纸(黄色)遇酸性溶液(pH<2)变红,
⑦已经被二氧化硫褪色的品红溶液在加热时会出现红色,
⑧C(NaHSO4)>0.001mol/L时遇甲基橙变红。
2、橙色世界
(1)基态:浓溴水 、甲基橙试剂、Br2 (CCl4)呈橙红色。
(2)化学变化:甲基橙在酸性溶液(3.1<pH< 4.4)中呈橙色,甲基红在酸性溶液(4.4<pH< 6.0)中呈橙色。
3、黄色世界
(1)基态:工业盐酸(含有 Fe3+)、Au 、 S8 、N
(2)激发态:钠元素焰色呈黄色
(3)化学变化:
①甲基橙在(pH>4.4)溶液中呈黄色,②久置的浓硝酸因溶有自身分解产生的二氧化氮而变黄
4、绿色世界A
(1)基态:F2 (浅黄绿色)、Cl2 (黄绿色)、Cu 2(OH)2CO3 (绿色)CuCl2(浓溶液呈绿色)、FeSO4(浅绿色)
(2)激发态:铜元素的焰色呈绿色
(3)化学变化:Fe (OH)2 (白色)—— 灰绿色——Fe (OH)3(红棕色)
5、青色世界
(1)基态:铁粉、银粉及大多数金属粉末、石墨、CuO 、 CuS 、Cu2S FeO 、 Fe3O4 、 MnO2
(2)化学变化:
①蔗糖遇浓硫酸被炭化变黑,
②润湿的白色醋酸铅试纸遇H2S变黑,
③硫磺粉与白色的水银反应生成黑红色的HgS,
④H2S通入Pb(NO3)2 、 AgNO3 、 CuSO4溶液产生不溶于水也不溶于稀盐酸和稀硫酸的黑色沉淀。
6、蓝色世界
(1)基态:CuSO4 (溶液)、 CuSO4 ?5H2O (晶体)、液氧、臭氧 a2O2 (淡黄色)、AgBr(淡黄色)、AgI、 Ag3PO4 (2)化学变化:
①紫色石蕊在碱性溶液(pH>8)中变蓝,
②润湿的红色石蕊试纸遇碱性气体变蓝,
③无水 CuSO4 (白色粉末)遇水变蓝,
④H2、H2S 、 CH4 、C2H5OH 燃烧火焰呈淡兰色,CO燃烧火焰呈蓝色,
⑤S8在空气中燃烧呈淡蓝色火焰,在纯氧中燃烧呈现明亮的蓝紫色火焰,
⑥淀粉遇 I2 (aq)变蓝,
⑦Cl2 、 Br2 、 NO2 、O3遇湿润的淀粉碘化钾试纸变蓝
7、紫色世界 ioqasdla吧SL;JD
(1)基态:KMnO4 (H+)、紫色石蕊、碘单质呈紫黑色
(2)激发态:充氩气的灯光呈紫蓝色,钾元素的焰色呈紫色(透过蓝色钴玻璃观察)
(3)化学变化:
①I2 升华生紫烟, ②NH4I受热生紫烟,
③紫色石蕊在(5.0<pH<8.0)溶液中呈紫色,
④锌粉与碘的混合物中滴入水会生紫烟(反应放热使碘升华)
8、白色世界
(1)基态:Pb(蓝白色)、Hg、铝粉、大多数块状金属、 PbSO4 、BaSO4 、AgCl 、BaCO3 、 Ba3(PO4)2 、BaSO3 、CaCO3 、 Fe (OH)2 (不稳定)、 Mg (OH)2 、 Al (OH)3 、 ZnS
(2)化学变化:
①H2在Cl2中燃烧呈现苍白色火焰, ②NH3遇 HCl 产生白烟,
③Mg 、 Al在氧气中燃烧发出耀眼的白光 ④红磷在氯气中燃烧时产生白色烟雾,
⑤红磷在氧气中燃烧时产生白烟。
高中化学元素知识点
(1)金属及其化合物
一、金属的通性
1.金属的物理性质:有金属光泽、有延展性、导电、导热。但不同金属在密度、硬度、熔沸点等方面差别较大。这也是金属单质的一大特点。
2.金属的化学性质:还原性,可表示为M – ne-→Mn+,金属的还原性主要表现在金属能与非金属、水、酸、某些盐发生反应。
4Na + O2 == 2Na2O 2Na + O2 Na2O2
2Na + Cl2 == 2NaCl
二、知识点归纳
(一)钠的化合物
⑴钠的重要化合物

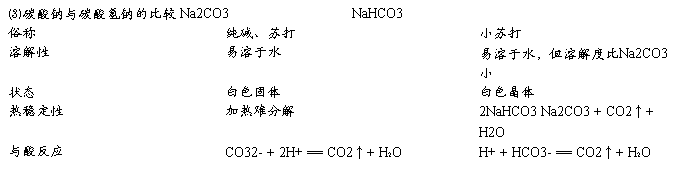
NaHCO3:俗名小苏打,不稳定,加热易分解,在水中溶解度小于Na2CO3,饱和Na2CO3溶液中通入CO2可见沉淀析出
Na2CO3:俗名苏打,纯碱,稳定,加热难分解,晶体Na2CO3?10H2O易风化
NaCl(食盐):存在于海水中
盐类
NaOH:白色固体,易潮解,俗名苛性钠,烧碱
碱
2Na2O2 + 2H2O == 4NaOH + O2↑(漂白剂)
2Na2O2 + 2CO2 == 2Na2CO3 + O2 (供氧剂)
Na2O2:淡黄色固体
Na2O:白色固体,溶于水生成NaOH,不稳定,继续跟O2反应生成淡黄色的Na2O2
氧化物
钠的重要化合物
-
高中化学物质颜色总结
高中化学物质颜色总结1红色世界1基态Fe2O3红褐色FeOH3红棕色FeSCN2血红色Cu紫红色Cu2O砖红色NO2红棕色P红磷暗…
-
高中化学物质颜色总结
高中化学物质颜色总结20xx-02-1612:15太多了,我都看不下,先弄到空间里先。1、黑色固体:石墨、炭粉、铁粉、FeS、Cu…
-
高中化学常见物质颜色归纳
中学化学常见物质颜色归纳一.常见的物质颜色1.红色部分含三价铁的化合物:Fe(OH)3红褐色(胶体或沉淀),Fe(SCN)n3?n…
-
高中化学物质颜色总结
初中化学常见物质的颜色一固体的颜色1红色固体铜氧化铁2绿色固体碱式碳酸铜3蓝色固体氢氧化铜硫酸铜晶体4紫黑色固体高锰酸钾5淡黄色固…
-
高中化学物质颜色总结
高中化学物质颜色总结一红色FeSCN3红色Cu2O砖红色Fe2O3红棕色红磷红棕色液溴深红棕色FeOH3红褐色Cu紫红色溴蒸气NO…
-
初中化学物质的颜色俗名鉴别除杂小结
一常见物质的颜色(一)、固体的颜色1、红色固体:铜,氧化铁【Fe2O3】,氧化汞【HgO】2、绿色固体:碱式碳酸铜【Cu2(OH)…
-
初三化学基础知识总结:常见物质的颜色的状态
初三化学基础知识总结:常见物质的颜色的状态同学们,是不是还在为如何复习化学而感到烦恼?是不是还找不到很好的总结性复习资料?告诉同学…
-
初中化学物质颜色总结
初中化学——物质的颜色1、常见物质的颜色:多数气体为无色,多数固体化合物为白色,多数溶液为无色。2、一些特殊物质的颜色:黑色:Mn…
-
初中化学物质的颜色总结
中学常见物质的颜色一固体的颜色1红色固体铜氧化铁2绿色固体碱式碳酸铜3蓝色固体氢氧化铜硫酸铜晶体4紫黑色固体高锰酸钾5淡黄色固体硫…
-
高中化学有色物质总结
一颜色1Fe2浅绿色2Fe3O4黑色晶体3FeOH2白色沉淀34Fe黄色5FeOH3红褐色沉淀6FeSCN3血红色溶液7FeO黑色…
-
20xx.3高中化学基础知识专题总结——物质的颜色
20xx.4.26高中化学物质的颜色(每年高考都考)1.红色:Fe(SCN)3(红色溶液)Cu2O(红色固体)Fe2O3(红棕色固…