篇一 :燃烧热的测定实验报告
实验二 燃烧热的测定
一、目的要求
1.用氧弹量热计测定萘的燃烧热。
2.了解氧弹量热计的原理、构造及使用方法。
二、实验原理
1摩尔物质完全氧化时的反应热称为燃烧热。所谓完全氧化是指C变为CO2(气),H变为H2O(液),S变为SO2(气),N变为N2(气),如银等金属都变成为游离状态。
例如:在25℃、1.01325×105Pa下苯甲酸的燃烧热为-3226.9kJ/mol,反应方程式为:
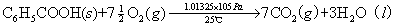
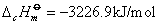
对于有机化合物,通常利用燃烧热的基本数据求算反应热。燃烧热可在恒容或恒压条件下测定,由热力学第一定律可知:在不做非膨胀功的情况下,恒容燃烧热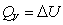 ,恒压燃烧热
,恒压燃烧热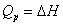 。在体积恒定的氧弹式量热计中测得的燃烧热为QV,而通常从手册上查得的数据为Qp,这两者可按下列公式进行换算
。在体积恒定的氧弹式量热计中测得的燃烧热为QV,而通常从手册上查得的数据为Qp,这两者可按下列公式进行换算
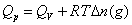 (2-1)
(2-1)
式中,Δn(g)——反应前后生成物和反应物中气体的物质的量之差;
R——气体常数;
…… …… 余下全文
篇二 :物化实验报告燃烧热的测定
华南师范大学实验报告
一、实验目的
1、明确燃烧热的定义,了解定压燃烧热与定容燃烧热的差别。
2、掌握量热技术的基本原理;学会测定萘的燃烧热
3、了解氧弹量热计的主要组成及作用,掌握氧弹量热计的操作技术。
4、学会雷诺图解法校正温度改变值。
二、 实验原理
通常测定物质的燃烧热,是用氧弹量热计,测量的基本原理是能量守恒定律。一定量被测物质样品在氧弹中完全燃烧时,所释放的热量使氧弹本身及其周围的介质和量热计有关附件的温度升高,测量介质在燃烧前后温度的变化值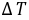 ,就能计算出该样品的燃烧热。
,就能计算出该样品的燃烧热。
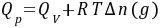 (1)
(1)
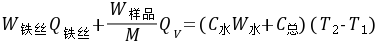 (2)
(2)
用已知燃烧热的物质(本实验用苯甲酸)放在量热计中燃烧,测其始末温度,求出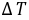 。
。
便可据上式求出K,再用求得的K值作为已知数求出待测物(萘)的燃烧热。
三、仪器和试剂
1.仪器
SHR-15氧弹量热计1台;贝克曼温度计;压片机 2台;充氧器1台;氧气钢瓶1个;1/10℃温度计;万能电表一个;天平
2.试剂
铁丝;苯甲酸(AR);萘(AR);氧气
四、实验步骤
1、测定氧氮卡计和水的总热容量
(1)样品压片:压片前先检查压片用钢模,若发现钢模有铁锈油污或尘土等,必须擦净后,才能进行压片,用天平称取约0.8g苯甲酸,再用分析天平准确称取一根铁丝质量,从模具的上面倒入己称好的苯甲酸样品,徐徐旋紧
…… …… 余下全文
篇三 :燃烧热的测定实验报告 20xx.11.9
华南师范大学实验报告
一、实验目的
1.明确燃烧热的定义,了解恒压燃烧热和恒容燃烧热的差别和联系;
2.掌握量热技术的基本原理,学会测定萘的燃烧热;
3.了解氧弹卡计主要部件的作用,掌握卡计的实验技术;
4.学会用雷诺图解法校正温度变化。
二、实验原理
燃烧热是指1摩尔物质完全燃烧时所放出的热量。在恒容条件下测得的燃烧热称为恒容燃烧热(Qv),恒容燃烧热这个过程的内能变化(ΔU)。在恒压条件下测得的燃烧热称为恒压燃烧热(Qp),恒压燃烧热等于这个过程的热焓变化(ΔH)。若把参加反应的气体和反应生成的气体作为理想气体处理,则有下列关系式:undefinedcHm = Qp=Qv +ΔnRT。
量热反应测量的基本原理为能量守恒定律。热是一个很难测定的物理量,热量的传递往往表现为温度的改变,而温度却很容易测量。本实验采用氧弹热量计为测量仪器。氧弹是一个特制的不锈钢容器,为了保证样品完全燃烧,氧弹中应充以高压氧气(或者其他氧化剂),还必须使燃烧后放出的热量尽可能全部传递给量热计本身和其中盛放的水,而几乎不与周围环境发生热交换。
在盛有定水的容器中,样品物质的量为n摩尔,放入密闭氧弹充氧,使样品完全燃烧,放出的热量传给水及仪器各部件,引起温度上升。设系统(包括内水桶,氧弹本身、测温器件、搅拌器和水)的总热容为C(通常称为仪器的水当量,即量热计及水每升高1K所需吸收的热量),假设系统与环境之间没有热交换,燃烧前、后的温度分别为T1、T2,则此样品的恒容摩尔燃烧热为:
…… …… 余下全文
篇四 :燃烧热的测定实验报告
一、目的要求1.用氧弹量热计测定萘的燃烧热。
2.了解氧弹量热计的原理、构造及使用方法。
二、实验原理1摩尔物质完全氧化时的反应热称为燃烧热。所谓完全氧化是指C变为CO2(气),H变为H2O(液),S变为SO2(气),N变为N2(气),如银等金属都变成为游离状态。
例如:在25℃、1.01325×105Pa下苯甲酸的燃烧热为-3226.9kJ/mol,反应方程式为:
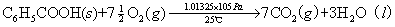
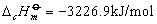
对于有机化合物,通常利用燃烧热的基本数据求算反应热。燃烧热可在恒容或恒压条件下测定,由热力学第一定律可知:在不做非膨胀功的情况下,恒容燃烧热 ,恒压燃烧热
,恒压燃烧热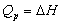 。在体积恒定的氧弹式量热计中测得的燃烧热为QV,而通常从手册上查得的数据为Qp,这两者可按下列公式进行换算
。在体积恒定的氧弹式量热计中测得的燃烧热为QV,而通常从手册上查得的数据为Qp,这两者可按下列公式进行换算
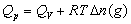 (2-1)
(2-1)
式中,Δn(g)——反应前后生成物和反应物中气体的物质的量之差;
R——气体常数; T——反应温度,用绝对温度表示。
…… …… 余下全文
篇六 :燃烧热的测定 实验报告
燃烧热的测定
一、实验目的
●使用氧弹式量热计测定固体有机物质(萘)的恒容燃烧热,并由此求算其摩尔燃烧热。
●了解氧弹式量热计的结构及各部分作用,掌握氧弹式量热计的使用方法,熟悉贝克曼温度计的调节和使用方法
●掌握恒容燃烧热和恒压燃烧热的差异和相互换算
二、实验原理
摩尔燃烧焓undefinedcHm 恒容燃烧热QV
undefinedrHm = Qp undefinedrUm = QV
对于单位燃烧反应,气相视为理想气体
undefinedcHm = QV +BRT= QV + △n(g)RT
氧弹中
放热(样品、点火丝)=吸热(水、氧弹、量热计、温度计)
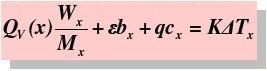 待测物质
待测物质
QV-摩尔恒容燃烧热 Mx-摩尔质量
-点火丝热值 bx-所耗点火丝质量
q-助燃棉线热值 cx-所耗棉线质量
K-氧弹量热计常数 undefinedTx-体系温度改变值
三、仪器及设备
标准物质:苯甲酸 待测物质:萘
氧弹式量热计

1-恒热夹套 2-氧弹3-量热容器4-绝热垫片5-隔热盖盖板 6-马达7,10-搅拌器8-伯克曼温度计9-读数放大镜11-振动器12-温度计
…… …… 余下全文
篇七 :燃烧热的测定_实验报告
燃烧热的测定
一、实验目的
l 使用氧弹式量热计测定固体有机物质(萘)的恒容燃烧热,并由此求算其摩尔燃烧热。
l 了解氧弹式量热计的结构及各部分作用,掌握氧弹式量热计的使用方法,熟悉贝克曼温度计的调节和使用方法
l 掌握恒容燃烧热和恒压燃烧热的差异和相互换算
二、实验原理
摩尔燃烧焓DcHm 恒容燃烧热QV
DrHm = Qp DrUm = QV
对于单位燃烧反应,气相视为理想气体
DcHm = QV +SnBRT= QV +△n(g)RT
氧弹中
放热(样品、点火丝)=吸热(水、氧弹、量热计、温度计)
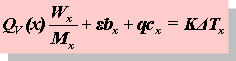 待测物质
待测物质
QV-摩尔恒容燃烧热 Mx-摩尔质量
e-点火丝热值 bx-所耗点火丝质量
…… …… 余下全文
篇八 :燃烧热的测定_实验报告
燃烧热的测定
【摘要】通过本实验了解氧弹式量热计的结构及各部分作用,掌握氧弹式量热计的使用方法,熟悉贝克曼温度计的调节和使用方法。学会雷诺图解法校正温度改变值。
关键字:氧弹式量热计 贝克曼温度计
雷诺图解法
引言:根据热化学的定义,1mol物质完全氧化时的反应热称作燃烧热。所谓完全氧化。对燃烧产物有明确的规定。如有机化合物中的碳氧化成一氧化碳不能认为完全氧化,只有氧化成二氧化碳才是完全氧化。
量热法是热力学的一种基本实验方法。在恒容或恒压条件下可以分别测得恒容燃烧热Qv和恒压燃烧热Qp。再根据热力学第一定律 Qp=Qv+△n(RT) 换算为恒压燃烧热。另外,直接测量热实际上是几乎不可能的,热量的传递往往表现为温度的改变,故实际中往往采用测量温差的办法来间接测量热。
一、实验目的
1、使用氧弹式量热计测定固体有机物质的恒容燃烧热,并由此求算其摩尔燃烧热。
2、了解氧弹式量热计的结构及各部分作用,掌握氧弹式量热计的使用方法,熟悉贝克曼温度计的调节和使用方法。
3、掌握恒容燃烧热和恒压燃烧热的差异和相互换算。
4、学会雷诺图解法校正温度改变值。 1、燃烧与量热
根据热化学的定义,1mol物质完全氧化时的反应热称作燃烧热。
…… …… 余下全文
