燃烧热的测定 实验报告
燃烧热的测定
一、实验目的
●使用氧弹式量热计测定固体有机物质(萘)的恒容燃烧热,并由此求算其摩尔燃烧热。
●了解氧弹式量热计的结构及各部分作用,掌握氧弹式量热计的使用方法,熟悉贝克曼温度计的调节和使用方法
●掌握恒容燃烧热和恒压燃烧热的差异和相互换算
二、实验原理
摩尔燃烧焓undefinedcHm 恒容燃烧热QV
undefinedrHm = Qp undefinedrUm = QV
对于单位燃烧反应,气相视为理想气体
undefinedcHm = QV +BRT= QV + △n(g)RT
氧弹中
放热(样品、点火丝)=吸热(水、氧弹、量热计、温度计)
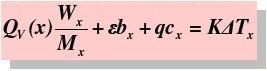 待测物质
待测物质
QV-摩尔恒容燃烧热 Mx-摩尔质量
-点火丝热值 bx-所耗点火丝质量
q-助燃棉线热值 cx-所耗棉线质量
K-氧弹量热计常数 undefinedTx-体系温度改变值
三、仪器及设备
标准物质:苯甲酸 待测物质:萘
氧弹式量热计

1-恒热夹套 2-氧弹3-量热容器4-绝热垫片5-隔热盖盖板 6-马达7,10-搅拌器8-伯克曼温度计9-读数放大镜11-振动器12-温度计
四、实验步骤
1.量热计常数K的测定
(1) 苯甲酸约1.0g,压片,中部系一已知质量棉线,称取洁净坩埚放置样片前后质量W1和W2
(2)把盛有苯甲酸片的坩埚放于氧弹内的坩埚架上,连接好点火丝和助燃棉线
(3) 盖好氧弹,与减压阀相连,充气到弹内压力为1.2MPa为止
(4)把氧弹放入量热容器中,加入3000ml水
(5) 调节贝克曼温度计,水银球应在氧弹高度约1/2处
(6) 接好电路,计时开关指向“1分”,点火开关到向“振动”,开启电源。约10min后,若温度变化均匀,开始读取温度。读数前5s振动器自动振动,两次振动间隔1min,每次振动结束读数。
(7)在第10min读数后按下“点火”开关,同时将计时开关倒向“半分”,点火指示灯亮。加大点火电流使点火指示灯熄灭,样品燃烧。灯灭时读取温度。
(8)温度变化率降为0.05°C·min-1后,改为1min计时,在记录温度读数至少10min,关闭电源。先取出贝克曼温度计,再取氧弹,旋松放气口排除废气。
(9)称量剩余点火丝质量。清洗氧弹内部及坩埚。
实验步骤
2. 萘的恒容燃烧热的测定
取萘0.6g压片,重复上述步骤进行实验,记录燃烧过程中温度随时间变化的数据
注意
1. 为避免腐蚀,必须清洗氧弹
2. 点火成败是实验关键。应仔细安装点火丝和坩埚。点火丝不应与弹体内壁接触,坩埚支持架不应与另一电极接触。
3. 每次实验前均应称量坩埚
数据记录和处理
1. 记录室温、大气压、样品质量(W2-W1)和剩余燃烧丝质量
2. 列表记录温度随时间变化数据
3. 画出雷诺图进行温度读数校正,求出在绝热条件下的真实温度改变值undefinedTe和undefinedTx
4. 计算量热计常数K
5. 计算萘的恒容燃烧热QV
6. 计算萘的摩尔燃烧焓undefinedcHm,并与文献值比较
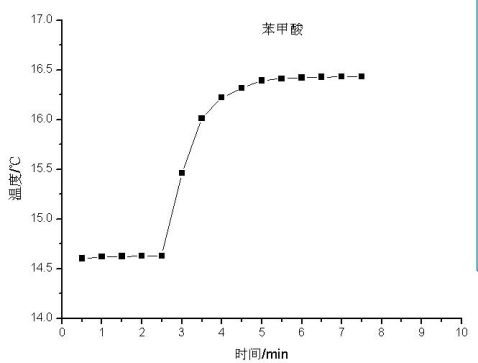
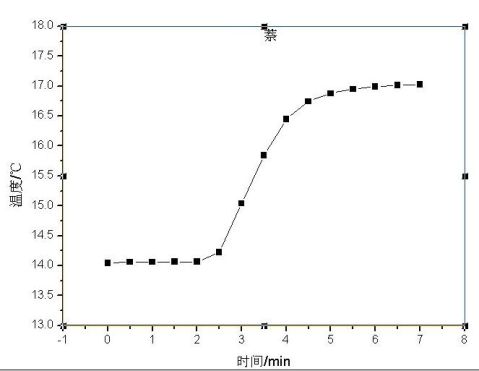
由图得:苯甲酸 *t=1.7K 萘*t=2.9K,苯甲酸恒容摩尔燃烧热为-3228kj/mol
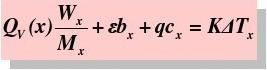 再由
再由
和K=n1C1+C热量计的
K=18.9KJ/K
undefinedrUm 萘= QV=-10022.4KJ/mol
五、思考题; 1.加入内筒中水的温度为什么要选择比外筒水温低?低多少合适?为什么?
2.在燃烧热测定实验中,哪些是体系?哪些是环境?有无热交换?这些热交换对实验结果有何影响?
3.在燃烧热测定的实验中,哪些因素容易造成实验误差?如何提高实验的准确度?
①检验多功能控制器数显读数是否稳定。熟习压片和氧弹装样操作,量热计安装注意探头不得碰弯,温度与温差的切换功能键钮,报时及灯闪烁提示功能等。
②干燥恒重苯甲酸(0.9~1.2g)和萘(0.6~0.8g)压片,注意紧实度,分析天平称样。③容量瓶量取3000mL水,调节水温低于室温1K。
④量取两根10厘米点火丝,中段在原珠笔蕊上绕几圈。燃烧丝缚紧使接触电阻尽可能小。氧弹充氧注意小动作缓缓旋开减压阀。
⑤氧弹内预滴10mL水,促产物凝聚成硝酸。
(1)实验关键:点火成功、试样完全燃烧是实验成败关键,可以考虑以下几项技术措施:
①试样应进行磨细、烘干、干燥器恒重等前处理,潮湿样品不易燃烧且有误差。
压片紧实度:一般硬到表面有较细密的光洁度,棱角无粗粒,使能燃烧又不至于引起爆炸性燃烧残剩黑糊等状。
②点火丝与电极接触电阻要尽可能小,注意电极松动和铁丝碰杯短路问题。
③充足氧(2MPa)并保证氧弹不漏氧,保证充分燃烧。燃烧不完全,还时常形
成灰白相间如散棉絮状。
④注意点火前才将二电极插上氧弹再按点火钮,否则因仪器未设互锁功能,极易发生(按搅拌钮或置0时)误点火,样品先已燃烧的事故。
(2) 氧弹内预滴几滴水,使氧弹为水汽饱和,燃烧后气态水易凝结为液态水。
试样在氧弹中燃烧产生的压力可达14MPa,长期使用,可能引起弹壁的腐蚀,减少其强度。故氧弹应定期进行20MPa水压检查,每年一次。
氧弹、量热容器、搅拌器等,在使用完毕后,应用干布擦去水迹,保持表面清洁干燥。恒温外套(即外筒)内的水,应采用软水。长期不使用时应将水倒掉。
氧弹以及氧气通过的各个部件,各联接部分不允许有油污,更不允许使用润滑油,在必须润滑时,可用少量的甘油。
5℃。每次测定时室温变化不得大于1℃。因此。室内禁止使用各种热源,如电炉、火炉、暖气等。 (3)仪器应置放在不受阳光直射的单独一间试验室内进行工作。室内温度和湿度应尽可能变化小。最适宜的温度是20
5K。国产型号为半自动HR—15A(B)数显微机型或WHR—15全自动微机型氧弹式热量计。进入了全面启用电脑处理数据的新时代。 4~10 (4) 如用贝克曼温度计,其调节可以归纳为倒立连接、设定温度、正立震断和校验四步,注意别让水银过多地流向弯曲贮管,导致因水银重而在正立时,玻管扩张处挂不住。也绝不允许放在电炉上烤等骤冷骤热情况出现。在精密的测量中,应进行贝克曼温度计的校正。改进后的本实验普遍采用热敏电阻温度计、铂电阻温度计或者热电堆等,相应配以电桥、指示mV值,实际已转换为温度 (数显温度计) 的仪器,能自动记录温度,精密度可达10
(5)苯甲酸和萘燃烧产物的热容差别因为产物量小而仪器热容的基数相对较大而可以忽略。
(6)量热方法和仪器多种多样,可参阅复旦大学物理化学实验教材。量热法广泛用来测量各种反应热如相变热等。本实验装置除可用作测定各种有机物质、燃料、谷物等固体、液体物质的燃烧热外,还可以研究物质在充入其它气体时反应热效应的变化情况。
-
燃烧热的测定实验报告
实验二燃烧热的测定一目的要求1用氧弹量热计测定萘的燃烧热2了解氧弹量热计的原理构造及使用方法二实验原理1摩尔物质完全氧化时的反应热…
-
物化实验报告燃烧热的测定
华南师范大学实验报告一实验目的1明确燃烧热的定义了解定压燃烧热与定容燃烧热的差别2掌握量热技术的基本原理学会测定萘的燃烧热3了解氧…
-
燃烧热的测定实验报告 20xx.11.9
华南师范大学实验报告一实验目的1明确燃烧热的定义了解恒压燃烧热和恒容燃烧热的差别和联系2掌握量热技术的基本原理学会测定萘的燃烧热3…
-
一、燃烧焓的测定实验报告
物理化学实验报告实验名称学院专业班级姓名指导教师日期燃烧焓的测定学号一实验目的1用氧弹式量热计测定萘的燃烧焓2明确燃烧焓的定义了解…
-
燃烧热的测定 实验报告
燃烧热的测定一实验目的使用氧弹式量热计测定固体有机物质萘的恒容燃烧热并由此求算其摩尔燃烧热了解氧弹式量热计的结构及各部分作用掌握氧…
-
大学物理化学实验报告-燃烧热的测定
物理化学实验报告院系:化学化工学院班级:化学061学号:13姓名:实验名称:燃烧热的测定日期:20XX.5.20同组者姓名:室温气…
-
物化实验报告燃烧热的测定
华南师范大学实验报告学生姓名学号专业化学师范年级班级课程名称物理化学实验实验项目燃烧热的测定实验类型验证设计综合实验时间20xx年…
-
物化实验报告燃烧热的测定
华南师范大学实验报告一实验目的1明确燃烧热的定义了解定压燃烧热与定容燃烧热的差别2掌握量热技术的基本原理学会测定萘的燃烧热3了解氧…
-
华师物化实验报告 燃烧热的测定
华南师范大学实验报告学生姓名学号专业年级班级课程名称实验项目燃烧热的测定实验类型验证设计综合实验时间年月日实验指导老师实验评分一实…
-
燃烧热的测定实验报告
浙江万里学院生物与环境学院化学工程实验技术实验报告实验名称燃烧热的测定1一实验预习30分1实验装置预习10分年月日指导教师签字成绩…
-
物化实验报告4-燃烧焓的测定
一实验目的1用氧弹量热计测定萘的摩尔燃烧焓2了解热量计中主要部分的作用掌握氧弹量热计的实验技术二实验原理燃烧反应系统中的气体可视为…