篇一 :附1临床试验 严重不良事件报告表(SAE)
严重不良事件报告表(SAE)
新药临床研究批准文号:NA 编号:
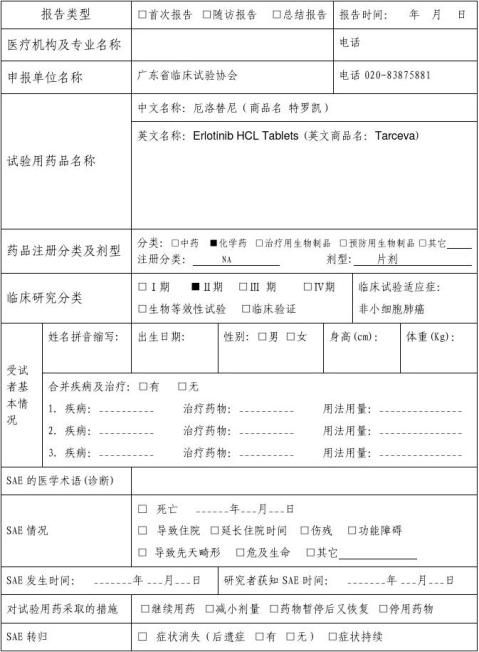
gcp_for001832 ( version 2.0 ) Page 1 of 2
报告单位名称: 报告人职务/职称: 报告人签名: gcp_for001832 ( version 2.0 ) Page 2 of 2

…… …… 余下全文
篇二 :不良事件报告处理程序
不良事件及严重不良事件报告及处理程序
1、申办者提供该药物的临床前安全性研究资料及其它与安全性有关的资料,并列入研究者手册。
2、在设计方案中对不良事件应作出明确的定义,并说明不良事件严重程度的判断标准,判断不良事件与试验药物关系的分类标准(如肯定有关、可能有关、可能无关、无关和无法判定)。方案中要求研究者必须如实填写不良事件记录表,记录不良事件的发生时间、严重程度、持续时间、采取的措施和转归。
3、试验开始前,研究小组成员必须熟悉该防范和处理医疗中受试者及突发事件预案的内容。
4、遇有严重不良事件,临床医师必须在第一时间(2小时内)向项目负责人和药物临床试验机构办公室报告,药物临床试验机构办公室应在24小时内向省食品药品监督管理部门、伦理委员会、申办单位报告。在原始资料中应记录何时、以何种方式(如电话、传真或书面)、向谁报告了严重不良事件。
5、临床研究医生根据病情实施处理,必要时,启动防范和处理医疗中受试者及突发事件的预案。
6、临床研究医生在报告的同时作好不良事件的记录,记录至少包括:不良事件的描述,发生时间,终止时间,程度及发作频度,是否需要治疗,如需要,记录给予的治疗。
…… …… 余下全文
篇四 :不良事件及严重不良事件处理及报告标准规程
不良事件及严重不良事件处理及报告标准规程
不良事件:不良事件是病人或临床试验的受试者接受一种药品后出现的不良医学事件,但不一定与治疗有因果关系。
严重不良事件:是试验过程中发生需住院治疗、延长住院时间、伤残、影响工作能力、危及生命或死亡、导致先天畸形等事件。 处理及报告程序
1、申办者提供该药物的临床前安全性研究资料及其它与安全性有关的资料,并列入研究者手册。
2、在设计方案中对不良事件应作出明确的定义,并说明不良事件严重程度的判断标准,判断不良事件与试验药物关系的分类标准(如肯定有关、可能有关、可能无关、无关和无法判定)。方案中要求研究者必须如实填写不良事件记录表,记录不良事件的发生时间、严重程度、持续时间、采取的措施和转归。
3、试验开始前,研究小组成员必须熟悉该防范和处理医疗中受试者及突发事件预案的内容。
4、遇有严重不良事件,临床医师必须在第一时间(2小时内)向项目负责人和药物临床试验机构办公室报告,药物临床试验机构办公室应在24小时内向省食品药品监督管理部门、伦理委员会、申办单位报告。在原始资料中应记录何时、以何种方式(如电话、传真或书面)、向谁报告了严重不良事件。
…… …… 余下全文
篇五 :不良事件报告控制程序

1. 目的
通过对上市产品在使用过程中出现的可疑或已发生的不良事件的监测和报告,确保上市产品得到有效的控制,防止上市产品后不良事件的重复发生和蔓延。
2. 范围
适用于对本公司上市产品可疑或已发生的不良事件的控制。
3.职责
3.1市场部负责填写上市产品按批追溯的记录并收集、反馈可疑或已发生的不良事件的信息。
3.2质量管理部负责收集产品开发过程临床试验中可疑或已发生的不良事件的信息;在总经理的直接领导下,负责不良事件报告、控制、处理的具体工作。
3.3 其他相关部门按总经理和质量管理部的要求参与调查、处理和改进工作。
3.4 质量管理部负责组织相关部门对产品上市后风险的分析、再评价。
4. 定义
4.1 医疗器械不良事件,是指获准上市的质量合格的医疗器械在正常使用情况下发生的,导致或者可能导致人体伤害的各种有害事件。
4.1.1 有下列情况之一者为严重伤害:
l 危及生命;
l 导致机体功能的永久性伤害或者机体结构的永久性损伤;
l 必须采取医疗措施才能避免上述永久性伤害或者损伤。
4.1.2 一般不良事件
…… …… 余下全文
篇七 :不良事件和严重不良事件报告SOP

不良事件和严重不良事件报告SOP
(签名、日期) (签名、日期) (签名、日期)
颁发日期: 生效日期:
修订记录
40

审查记录
41

不良事件和严重不良事件报告SOP
目的:建立不良事件和严重不良事件记录和报告规程,保证不良事件和严重不良事件得到迅速的报告和处理。
范围:适用于所有临床试验。
规程:
一、定义
不良事件是指受试者接受一种药品后出现的不良医学事件,但并不一定与治疗有因果关系。严重不良事件(Serious Adverse Event)是指临床试验过程中发生的需要住院治疗、延长住院时间、伤残、影响工作能力、危及生命或致命、导致先天畸形等事件。除依据上述规范所界定的SAE外,如试验方案做出的额外规定的SAE或妊娠等应同时遵循本SOP进行上报。
二、记录
无论不良事件是否与试验药物有因果关系,研究者均应在原始记录中记录并填写到病例报告表中,并在记录及报告上签名和注明日期。
不良事件和严重不良事件的记录内容应包括:不良事件和严重不良事件的详细描述,持续时间,严重程度及频率,具体治疗措施及转归,有关不良事件和严重不良事件的所有临床资料,与试验药物的因果关系的分析等。详见《不良事件及严重不良事件处理的 SOP》有关章节
…… …… 余下全文
篇八 :严重不良事件报告
严重不良事件报告
Serious Adverse Event Report Form
新药临床研究批准文号:______________ 方案编号:______________
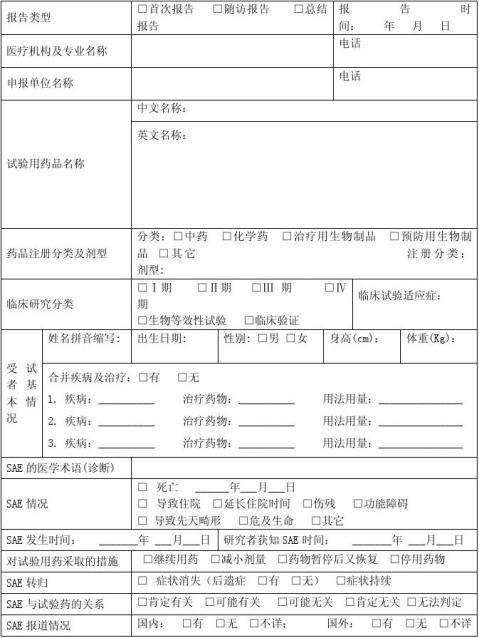

报告者(研究医生)/报告日期:
确认者(研究者)/日期:
发送者/日期/时间:
/ / /
…… …… 余下全文

