篇一 :《水溶液中的解离平衡》实验报告
二、 实验步骤
(一)同离子效应
1、取两只小试管,0.1mol/LHAc溶液及1滴甲基橙,混合均匀,溶液呈红色。在一试管中加入少量NaAc(s),观察指示剂颜色变化 指示剂变黄。
HA c = H+ + Ac-
NaAc = Na+ + Ac—
2、取两只小试管,各加入5滴0.1mol/LMgCl2溶液,在其中以支试管中再加入5滴饱和NH4Cl溶液,然后分别在这两支试管中加入5滴2mol/LNH3·H2O,观察两试管发生的现象有何不同?何故?
MgCl2 = Mg2+ + 2Cl-
Mg2+ + 2OH— = Mg(OH)2↓
NH4Cl解离出的Cl-使 MgCl2解离平衡向左移动减小了溶液中Mg2+的浓度,因而在入5滴饱和NH4Cl溶液,然后在这支试管中加入5滴2mol/LNH3·H2O无白色沉淀生成。
(二)缓冲溶液的配制
1、用1mol/LHAc溶液和1mol/LNaAc溶液配置pH=4.0的缓冲溶液10mL.应该如何配制?配好后,用pH试纸测定其pH值,检验其是否符合要求.
PH = pKa + lgCAc-/CHAc
…… …… 余下全文
篇二 :实验四 酸碱解离平衡和沉淀-溶解平衡
山东大学西校区实验报告
姓名 危诚 年级班级 公共卫生1班
实验四 酸碱解离平衡和沉淀-溶解平衡
实验目的: 了解弱酸与弱碱的解离平衡及其平衡移动原理;掌握缓冲溶液恶性质及缓冲溶液的配置方法;掌握难溶点解释的沉淀-溶解平衡及溶度积规则的运用;学习液体及固体的分离以及pH试纸的使用等基本操作。
实验原理: 一元弱酸中的浓度: 一元弱碱中的浓度: 缓冲溶液的pH值: ; 难溶强电解质的标准溶度积常数:
实验器材:离心机,离心试管,试管,烧杯,玻璃棒,量筒,试管架,滴管,药匙 实验药品:

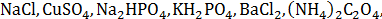
甲基橙,酚酞,广泛pH试纸,精密pH试纸
(pH=3.8~5.4;pH=5.5~9.0)
实验过程:
(一) 测定溶液pH
用广泛pH试纸测量0.1mol/L的溶液,0.1mol/L的溶液和的0.1mol/L溶液的pH。测得分别为pH=1.0; pH=13; pH=8.0。通过计算,易知理论值分别为pH=1.0; pH=13.0; pH=8.2552。
(二) 同离子效应
(1)取两支试管A、B,各加入等量0.1mol/L的
液颜色为橙红色。然后向A管中加入少量
…… …… 余下全文
篇三 :《水溶液中的解离平衡》实验报告
二、 实验步骤
(一)同离子效应
1、取两只小试管,0.1mol/LHAc溶液及1滴甲基橙,混合均匀,溶液呈红色。在一试管中加入少量NaAc(s),观察指示剂颜色变化 指示剂变黄。
HA c = H+ + Ac-
NaAc = Na+ + Ac—
2、取两只小试管,各加入5滴0.1mol/LMgCl2溶液,在其中以支试
管中再加入5滴饱和NH4Cl溶液,然后分别在这两支试管中加入5滴
2mol/LNH3·H2O,观察两试管发生的现象有何不同?何故?
MgCl2 = Mg2+ + 2Cl-
Mg2+ + 2OH— = Mg(OH)2↓
NH4Cl解离出的Cl-使 MgCl2解离平衡向左移动减小了溶液中Mg2+的
浓度,因而在入5滴饱和NH4Cl溶液,然后在这支试管中加入5滴
2mol/LNH3·H2O无白色沉淀生成。
(二)缓冲溶液的配制
1、用1mol/LHAc溶液和1mol/LNaAc溶液配置pH=4.0的缓冲溶液10mL.应该如何配制?配好后,用pH试纸测定其pH值,检验其是否符合要求.
PH = pKa + lgCAc-/CHAc
4 = 4.75 + lgCAc-/CHAc
…… …… 余下全文
篇四 :电导法测定乙酸电离平衡常数 实验报告
物理化学实验报告
姓名:何思思
班级:工艺五班
学号:10031010526
教师:李慎新
学院:材料化学与工程学院
电导法测定乙酸电离平衡常数
一、 实验目的
1、 掌握电导、电导率、摩尔电导率的概念以及他们之间的联系。
2、 掌握由电导法测定弱电解质电离平衡常熟的原理。
二、 实验原理
1、 电离平衡常数Kc的测定原理:
α=∧m/∧m∞
CH3COOH —→ CH3COO- + H
开始 C 0 0
平衡 C(1-α) Cα Cα
…… …… 余下全文
篇五 :生产线平衡实验报告
实验二:用Flexible Line Balancing进行生产线平衡
1. 实验目的
(1)掌握对生产线平衡问题及其约束进行形式化描述以及基本思路和平衡效果的评价指标;
(2)掌握用Flexible Line Balancing V.3进行生产线平衡的方法
2. 实验任务
(1)熟练掌握生产线问题及其约束的形式化描述
(2)掌握生产线平衡的指标
(3)利用软件得到生产线平衡方案
3. 实验内容与步骤
3.1实验内容:
针对下列问题进行生产线平衡:
上海大众三厂总装车间在20##年引入了国际汽车制造企业流行的模块化装配工艺,其中的底盘装配模块是四大模块中投资最大,技术含量最高的模块流水线。该模块由动力总成预装线,底盘模块线,底盘总装,底盘螺栓拧紧及返修设备四大部分组成,采用大量自动化螺栓拧紧设备和电磁感应自动运行装配小车。该生产线原设计为专门生产帕萨特B5轿车,但20##年公司引入全新的途安多功能乘用车,为了为尽可能利用现有资源,决定将该车与B5混线生产。根据市场需求预测,混线后的生产节拍仍然定为2.5分钟,即180秒。现使用本系统对动力总成预装模块重新进行生产线平衡。
…… …… 余下全文
篇六 :四川理工实验报告电导法测定乙酸电离平衡常数 (2)
实验六 电导法测定乙酸电离平衡常数
报告人:曾辉 实验时间20##年03月07日
一.实验目的:
1.掌握电导、电导率、摩尔电导率的概念以及它们之间的相互关系。
3.掌握电导法测定弱电解质电离平衡常数的原理。
二.实验原理:
1.电离平衡常数Kc的测定原理
在弱电解质溶液中,只有已经电离的部分才能承担传递电量的任务。在无限稀释的溶液中可以认为弱电解质已全部电离,此时溶液的摩尔电导率为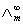 ,可以用离子的极限摩尔电导率相加而得。而一定浓度下电解质的摩尔电导率∧m与无限稀释的溶液的摩尔电导率
,可以用离子的极限摩尔电导率相加而得。而一定浓度下电解质的摩尔电导率∧m与无限稀释的溶液的摩尔电导率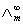 是有区别的,这由两个因素造成,一是电解质的不完全离解,二是离子间存在相互作用力。二者之间有如下近似关系:
是有区别的,这由两个因素造成,一是电解质的不完全离解,二是离子间存在相互作用力。二者之间有如下近似关系:
 (1)
(1)
…… …… 余下全文
篇七 :化学-电解质溶液-同离子效应”实验报告
中国石油大学(华东)现代远程教育
实验报告
课程名称:普通化学 / 化学原理1
实验名称:电解质溶液-同离子效应
实验形式:在线模拟+现场实践
提交形式:在线提交实验报告
学生姓名: 学号:
年级专业层次:
…… …… 余下全文
篇八 :化学-电解质溶液-同离子效应”实验报告
中国石油大学(华东)现代远程教育
实验报告
课程名称:普通化学 / 化学原理1
实验名称:电解质溶液-同离子效应
实验形式:在线模拟+现场实践
提交形式:在线提交实验报告
学生姓名: 吴洪涛 学号:15470485003
年级专业层次:15秋机械制造与自动化网络秋高起专
学习中心: 浙江杭州学习中心
…… …… 余下全文