篇一 :分解过氧化氢制取氧气实验活动报告
氧气的实验室制取与性质报告
姓名_____学校_____ 班级_____
【实验名称】
氧气的实验室制取与性质(分解过氧化氢制取氧气)
【实验目的】
1.学习实验室制取氧气的方法。
2.加深对氧气性质的认识。
【实验用品】
锥形瓶、双孔橡胶塞、长颈漏斗、集气瓶、玻璃导管、胶皮管、水槽、二氧化锰,过氧化氢溶液、木炭、澄清石灰水、细铁丝。
【实验步骤、现象及结论】

…… …… 余下全文
篇三 :过氧化氢的催化分解实验报告
过氧化氢的催化分解
一、实验目的:
1.用静态法测定H2O2分解反应的速度常数和半衰期。
2.熟悉一级反应特点,了解反应物浓度、温度、催化剂等因素对一级反应速度的影响。
3.掌握量气技术和体积校正,学会用图解计算法求出一级反应的速度常数。
二、实验原理:
1. 凡反应速度只与反应物浓度的一次方成正比的反应,称为一级反应,实验证明H2O2的分解反应如下:

2 H 2O 2 → 2 H 2O + O 2 (1)

2. 若该反应属于一级反应,则其速度方程应是:
式中:CH2O2—时间t时的H2O2浓度; k—反应速度常数。
…… …… 余下全文
篇四 :实验报告探究不同条件下过氧化氢的分解
实验:比较过氧化氢在不同条件下的分解
目的要求:通过比较过氧化氢在不同条件下分解的快慢,了解过氧化氢酶的作用和意义。
实验材料:新鲜的质量分数为20%的肝脏(如猪肝、鸡肝)研磨液。
新配制的体积分数为3%的过氧化氢溶液,质量分数为3.5%的FeCl3溶液。
量筒、试管、滴管、试管架、卫生香、火柴、酒精灯、试管夹、大烧杯、三脚架、石棉网、温度计
实验原理:新鲜肝脏中有较多的过氧化氢酶。经计算,质量分数为3.5%的FeCl3溶液和质量分数为20%的肝脏研磨液相比,每滴FeCl3溶液的Fe3+数,大约是每滴研磨液中过氧化氢酶分子数的25万倍。比较过氧化氢在常温、加热、滴加FeCl3溶液和肝脏研磨液的条件下,比较过氧化氢的分解产生的气泡数或者观察带火星的木条复燃的情况,来分析不同条件下的过氧化氢的分解情况。
变量控制:自变量 因变量
…… …… 余下全文
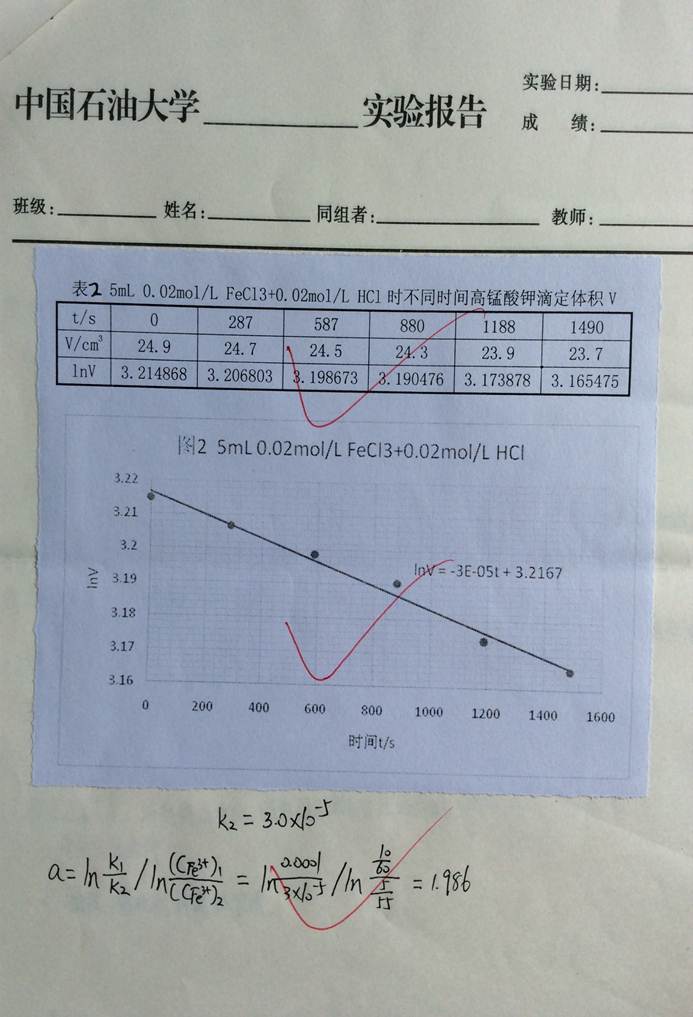
篇五 :实验14 过氧化氢催化分解反应速率常数的测定
第 次课 4 学时







实验14 过氧化氢催化分解反应速率常数的测定
一、实验目的
1. 测定过氧化氢催化分解反应速率常数;
2. 掌握通过测量反应系统的体积跟踪反应系统浓度从而研究反应速率的方法。
二、实验原理
过氧化氢在没有催化剂存在时,分解反应进行的很慢。加入催化剂能够提高分解速率。过氧化氢分解反应的化学计量式如下:
H2O2(l) = H2O(l) + 1/2O2(g)
若以KI为催化剂,在KI作用下催化分解步骤为:
KI(l) + H2O2(l) = KIO + H2O(l) (慢)
…… …… 余下全文
篇六 :过氧化氢催化剂的研究 实验报告
过氧化氢催化剂的研究
摘 要:过氧化氢是目前实验室制取氧气安全、廉价的试剂。由于过氧键的特殊性质,有各种各样的催化剂可供选择。本文就过氧化氢催化剂的选择进行探究。
关键词:过氧化氢 氧气 催化剂
氧气在化学实验中十分重要,初中课本中制备氧气的途径之一是过氧化氢催化分解。随着工艺的改进,过氧化氢的成本不断降低,是一种很有前途的制备氧气的途径。过氧化氢具有过氧键,-O-O-中O不是最低氧化态,故不稳定,容易断开。常温下波长为320~380nm的光照射,或是加热,使用催化剂都可以加速过氧化氢的分解。光照速度太慢,加热浪费能源,而分解速率不稳定,所以寻找一种合适的催化剂便更加重要。过氧化氢的催化原理主要有以下几种:
1. 氧化重金属氧化物或金属盐,生成的物质立刻分解放出氧气。
例:H2O2+MnO2=H2MnO4
H2MnO4+H2O2=MnO2+O2↑+2H2O
2. 过氧化氢在碱性条件下容易分解为氧气和水,氢氧根使溶液显碱性,利于过氧化氢的分解。
…… …… 余下全文
篇七 :7实验报告探究不同条件下过氧化氢的分解
实验报告七:比较过氧化氢在不同条件下的分解
目的要求:通过比较过氧化氢在不同条件下分解的快慢,了解过氧化氢酶的作用和意义。
实验材料:新鲜的质量分数为20%的肝脏(如猪肝、鸡肝)研磨液。
新配制的体积分数为3%的过氧化氢溶液,质量分数为3.5%的FeCl3溶液。
量筒、试管、滴管、试管架、卫生香、火柴、酒精灯、试管夹、大烧杯、三脚架、石棉网、温度计
实验原理:新鲜肝脏中有较多的过氧化氢酶。经计算,质量分数为3.5%的FeCl3溶液和质量分数为20%的肝脏研磨液相比,每滴FeCl3溶液的Fe3+数,大约是每滴研磨液中过氧化氢酶分子数的25万倍。比较过氧化氢在常温、加热、滴加FeCl3溶液和肝脏研磨液的条件下,比较过氧化氢的分解产生的气泡数或者观察带火星的木条复燃的情况,来分析不同条件下的过氧化氢的分解情况。
变量控制:自变量 因变量
…… …… 余下全文
篇八 :过氧化氢含量的测定 实验报告
实验一 过氧化氢含量的测定(高锰酸钾法)
一、 实验目的
(1) 掌握高锰酸钾法测定过氧化氢含量的原理、滴定条件和操作步骤;
(2) 掌握移液管及容量瓶的正确使用方法,熟悉液体样品的取样和稀释操作。
二、 实验原理
过氧化氢(H2O2)在工业、生物、医药等方面应用很广泛。利用H2O2的氧化性漂白毛、丝织物;医药上常用于消毒和杀菌剂;纯H2O2可作为火箭燃料的氧化剂:工业上利用H2O2的还原性除去氯气;植物体内的过氧化氢酶也能催化H2O2的分解反映,股在生物上利用H2O2分解所放出的氧气来测量过氧化氢酶的活性。由于H2O2有着广泛的应用,常需要测定它的含量。
由于在酸性溶液中,KMnO4的氧化性比H2O2的氧化性强,所以,测定H2O2的含量时,常采用在稀硫酸溶液中,室温条件下用高锰酸钾法测定。其反应为:
5H2O2+2MnO4-+6H+=2Mn2++8H2O+5O2
…… …… 余下全文