篇一 :过氧化氢的催化分解实验报告
过氧化氢的催化分解
一、实验目的:
1.用静态法测定H2O2分解反应的速度常数和半衰期。
2.熟悉一级反应特点,了解反应物浓度、温度、催化剂等因素对一级反应速度的影响。
3.掌握量气技术和体积校正,学会用图解计算法求出一级反应的速度常数。
二、实验原理:
1. 凡反应速度只与反应物浓度的一次方成正比的反应,称为一级反应,实验证明H2O2的分解反应如下:

2 H 2O 2 → 2 H 2O + O 2 (1)

2. 若该反应属于一级反应,则其速度方程应是:
式中:CH2O2—时间t时的H2O2浓度; k—反应速度常数。
…… …… 余下全文
篇二 :实验14 过氧化氢催化分解反应速率常数的测定
第 次课 4 学时







实验14 过氧化氢催化分解反应速率常数的测定
一、实验目的
1. 测定过氧化氢催化分解反应速率常数;
2. 掌握通过测量反应系统的体积跟踪反应系统浓度从而研究反应速率的方法。
二、实验原理
过氧化氢在没有催化剂存在时,分解反应进行的很慢。加入催化剂能够提高分解速率。过氧化氢分解反应的化学计量式如下:
H2O2(l) = H2O(l) + 1/2O2(g)
若以KI为催化剂,在KI作用下催化分解步骤为:
KI(l) + H2O2(l) = KIO + H2O(l) (慢)
…… …… 余下全文
篇三 :过氧化氢催化剂的研究 实验报告
过氧化氢催化剂的研究
摘 要:过氧化氢是目前实验室制取氧气安全、廉价的试剂。由于过氧键的特殊性质,有各种各样的催化剂可供选择。本文就过氧化氢催化剂的选择进行探究。
关键词:过氧化氢 氧气 催化剂
氧气在化学实验中十分重要,初中课本中制备氧气的途径之一是过氧化氢催化分解。随着工艺的改进,过氧化氢的成本不断降低,是一种很有前途的制备氧气的途径。过氧化氢具有过氧键,-O-O-中O不是最低氧化态,故不稳定,容易断开。常温下波长为320~380nm的光照射,或是加热,使用催化剂都可以加速过氧化氢的分解。光照速度太慢,加热浪费能源,而分解速率不稳定,所以寻找一种合适的催化剂便更加重要。过氧化氢的催化原理主要有以下几种:
1. 氧化重金属氧化物或金属盐,生成的物质立刻分解放出氧气。
例:H2O2+MnO2=H2MnO4
H2MnO4+H2O2=MnO2+O2↑+2H2O
2. 过氧化氢在碱性条件下容易分解为氧气和水,氢氧根使溶液显碱性,利于过氧化氢的分解。
…… …… 余下全文
篇四 :过氧化氢的催化分解实验
过氧化氢的催化分解
一 实验目的
1. 熟悉一级反应特点,了解反应浓度、温度和催化剂等因素对一级反应速度的影响;
2. 用静态法测H2O2分解反应的反应速度常数和半衰期.并求反应活化能;
3. 学会用图解法求出一级反应的反应速度常数.
二 实验原理
凡是反应速度只与反应浓度的一次方成正比的反应称为一级反应。实验证明,过氧化氢的反应机理为一级反应.化学反应速度取决于反应物的浓度、温度、反应压力、催化剂、搅拌速度等许多因素。许多催化剂如Pt、Ag、MnO2、FeCl3碘化物等都能加速H2O2分解。在催化剂KI作用下的分解反应,反应历程如下:
H2O2+Iˉ→IOˉ+H2O
H2O2+ IOˉ→H2O+O2+Iˉ
按此历程,可推导出总反应的速度公式:
-=Kˊ[H2O2][ Iˉ]
…… …… 余下全文
篇五 :过氧化氢的催化分解
过氧化氢分解氧气
成员:罗玉洁、何瑾、徐丽、胡艳、骆磊、申林
一、 实验目的
1、 掌握实验室用双氧水制备氧气的原理、装置和操作。
2、 了解影响双氧水制备氧气反应速率的因素。
3、 能认识催化剂在化学反应中的作用及化学反应前后质量的变化。
二、 实验原理
过氧化氢不稳定,在常温下就能缓慢分解放出氧气。但速度较慢,不易察觉。在过氧化氢溶液中加入适量二氧化锰后,能立即有氧气迅速放出。在此反应中,二氧化锰是催化剂,能加速该反应的发生。

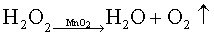
三、 实验药品与仪器
实验药品:5%、30%的双氧水、二氧化锰、氧化铜。
仪 器:注射器(20ml)、锥形瓶、导管、软木塞、恒温水浴锅、集气瓶、橡皮管、钥匙。
四、 实验步骤
1、实验室制备氧气
①连接仪器,检查装置的气密性;
②在锥形瓶中加入少量二氧化锰粉末,旋紧软木塞,用注射器在双氧水瓶里吸取10ml 5%双氧水,将注水器里的双氧水按需要的量缓慢注入加入装有少量二氧化锰粉末的锥形瓶中;
…… …… 余下全文
篇六 :实验十五 过氧化氢催化分解
2.3 动力学部分
实验十五 过氧化氢催化分解
1 目的要求
(1) 测定过氧化氢分解的反应速度常数。
(2) 了解用体积法研究动力学的基本原理。
(3) 了解实验测定活化能E的原理和方法。
2 基本原理
过氧化氢在没有催化剂时,分解反应进行得很慢,加入催化剂时能促进其分解。过氧化氢分解的化学计量式如下:
H2O2→H2O+1/2O2
很多物质都能对这一反应起催化作用,如铂、银、铅、二氧化锰、三氯化铁以及三氯化铁和氯化铜的混合物等。本实验是以三氯化铁和氯化铜混合物作催化剂,研究H2O2分解反应的动力学。其中CuCl2是助催化剂,单独使用它,并不能催化该反应。
在本实验条件下,过氧化氢的分解是一级反应。若 以 a 表示H2O2的起始浓度,x表示在时刻 t 时已经分解掉的H2O2的浓度,则所剩余的H2O2的浓度为(a-x),于是有:
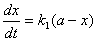
积分上式: ln(a-x)= -k1t + lna
…… …… 余下全文
篇七 :过氧化氢催化分解反应速率常数的测定
过氧化氢催化分解反应速率常数的测定

一、实验目的
(1)了解过氧化氢催化分解反应速率常数的测定方法。
(2)熟悉一级反应的特点,了解催化剂对反映速率的影响。
(3)掌握用图解计算法求反应速率常数。
二、实验用品
1、仪器
玻璃反应容器1个、水准瓶1个、50mL量气管1个、超级恒温槽1套、三通活塞1个、秒表1块、10mL量筒1个、5mL吸量管2支、胶管3m。
2、药品
质量分数为2%的H2O2溶液(新鲜配制)、0.1mol·L-1KI溶液。
三、实验原理与技术
过氧化氢很不稳定,在常温下的分解反应式为:
H2O2→H2O+1/2O2 (Ⅰ)
在KI作用下的分解反应机理为:
H2O2+KI→KIO+ H2O (慢) (Ⅱ)
KIO→KI+1/2O2 (快) (Ⅲ)
(Ⅱ)式是H2O2分解的速控步骤,H2O2分解反应的反应速率方程为:
-dcH2O2/dt=k´cH2O2·cKI (Ⅳ)
…… …… 余下全文
篇八 :实验七 过氧化氢催化分解
实验七 过氧化氢催化分解
Catalyzed Decomposition of Hydrogen Peroxide
实验类型:基础性
实验学时:5
教学对象:临床药学专业
一.实验目的
1. 熟悉一级反应的特点,了解浓度、温度、催化剂等因素对反应速率的影响。
2. 用量气法测定过氧化氢分解反应的速率常数和活化能。
二.实验原理
过氧化氢的催化分解是一级反应:
H2O2 → H2O + 1 / 2 O2
ln  =–kt (3-1)
=–kt (3-1)
在分解过程中,放出的氧气的体积与分解了的H2O2浓度成正比:
C0∝ V∞
Ct ∝(V∞–Vt)
代入式(3-1),整理后可得:
ln(V∞–Vt)=–kt + ln V∞
用ln(V∞–Vt)对t作图,从直线的斜率可求出速率常数k,由两个不同温度的k值可以求出活化能Ea:
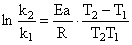
三. 实验准备
1. 仪 器:恒温槽,量气管装置,锥形瓶,移液管,秒表。
2. 药 品:3%H2O2溶液,KI溶液(0.1mol·mol–3)。
四.仪器安装要点
【插入录像】 安装量气管装置
…… …… 余下全文