篇一 :实验十四 氯化铵生成焓的测定
实验十四 氯化铵生成焓的测定
实验内容
一、 量热计热容量的测定
二、 NH3·H2O与HCl中和热的测定
三、 三、NH4Cl溶解热的测定
四、 记录和结果
实验目的
利用量热计测定NH4Cl生成焓,加深对盖斯定律的理解。
基本原理
热力学标准状态下由稳定单质生成一摩尔化合物时的反应焓变称为该化合物的标准摩尔生成热焓。标准摩尔生成热焓一般可通过测定有关反应热间接求得。本实验就是分别测定氨水和盐酸的中和反应热和氯化铵固体的溶解热,然后利用氨水和盐酸的标准生成热焓,通过盖斯定律计算而求得氯化铵固体的标准生成热焓。
NH3(aq)十HCl(aq) →NH4Cl(aq) ΔH中和
NH4Cl (s)→NH4Cl(aq) ΔH溶解
中和热和溶解热可采用简易量热计来测量。当反应在量热计中进行时,反应放出或吸收
的热量将使量热计系统温度升高或降低,因此,只要测定量热计系统温度的改变值ΔT以及量热计系统的热容量C,就可以利用下式计算出反应的热效应:

量热计系统的热容量C是指量热计系统温度升高1K时所需的热量。测定量热计系统的热容量有多种方法,本实验是采用化学反应标定法,即利用盐酸和氢氧化钠水溶液在量热计内反应,测定其系统温度改变值ΔT后,根据已知的中和反应热(ΔH⊙=一57.3kJ·mol-1)可求出量热计系统的热容量C。

(注:虽然各种盐溶液的热容略有差别,但在本实验可不予考虑。)
实验器材
量热计(由保温杯,一支1/10K刻度的温度计和一支环状搅拌棒组成),秒表,量筒。
…… …… 余下全文
篇二 :物化实验报告4-燃烧焓的测定
一、实验目的
1、 用氧弹量热计测定萘的摩尔燃烧焓。
2、 了解热量计中主要部分的作用,掌握氧弹量热计的实验技术。
二、实验原理
燃烧反应系统中的气体可视为理想气体,存在以下关系:
QP = Q V + △nRT ①
△rH0m=△rU0m+RT∑Vb (g) ②
本实验采用氧弹式量热计测萘的燃烧焓,构造如图1所示。测定的原理是将一定量待测萘样品在氧弹中完全燃烧,燃烧放出的热使量热计本身及氧弹周围介质(水)的温度升高,通过测定燃烧前后量热计温度的变化,就可求出QV,再通过①、②式可算出△cHm。
整个量热计可看做一个等容系统,其热力学能△U=0。
△U = △cUB + △cU引燃丝 + △U量热计 =0
如果已知物质的质量、等容燃烧热值及燃烧前后系统温度的变化△T,则上式还可以写为更实用的形式 mBQV,B + LQl + K△T=0
式中mB为样品的质量(g);Qv,B为样品的等容燃烧热值(J*g-1);l为燃烧掉的引燃丝的长度(cm);Ql为引燃丝的燃烧热值(J*cm-1);△T为修正后的内桶中水的真实温差(K)。mB和L的数据可直接由实验测得,而真实温差T可由对实测温差进行修正获得,可通过作下图来得到。
…… …… 余下全文
篇六 :有机物燃烧焓的测定。实验报告
有机物燃烧焓的测定
一.实验目的
1.明确燃烧焓的定义,了解恒压热效应与恒容热效应的关系。
2.掌握有关热化学实验的一般知识和技术。
3.用氧弹式量热计测定有机物的燃烧焓。
二.实验原理
热化学中定义:在指定温度和压力下,一摩尔物质完全燃烧成指定产物的焓变,称为该物质在此温度下的摩尔燃烧焓,记作ΔCHm。通常,C、H等元素的燃烧产物分别为CO2(g)、H2O(l)等。由于上述条件下ΔH=Qp,因此ΔCHm也就是该物质燃烧反应的等压热效应Qp,m。
在适当的条件下,许多有机物都能迅速而完全地进行氧化反应,这就为准确测定它们的燃烧焓创造了有利条件。
在实际测量中,燃烧反应常在恒容条件下进行,如在弹式量热计中进行,这样直接测得的是反应的恒容热效应QV(即燃烧反应的热力学能变ΔCU)。若将应系统中的气体物质视为理想气体,根据热力学推导可得ΔCHm和ΔCUm的关系为:
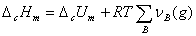 或
或  (1)
(1)
式中,T为反应温度(K);ΔCHm为摩尔燃烧焓(J·mol-1);ΔCUm为摩尔燃烧热力学能变(J·mol-1);vB(g)为燃烧反应方程中各气体物质的化学计量数,规定生产物取正值,反应物取负值。
…… …… 余下全文
篇七 :氯化铵及水的测定方法
氯化铵及水的测定方法
一 、原理:
试样在100~105℃下干燥至恒重,由失重求得水分和氯化铵百分含量。
二、仪器:
1、磨口塞称量瓶
2、电热恒温干燥箱
三、分析步骤:
用预先在100~105℃下干燥并恒重的称量瓶,称取10g试样,精确至0.001g,置于100~105℃干燥箱中,干燥至恒重(不超过4小时)。
四、分析结果计算:
X3=m-m1/m×100
NH4Cl=m-x3
式中: X3—以水的质量百分数表示
m—干燥前试样重(g)
m1—干燥后试样重(g)
x3—所测水重
五、允许差:
1、取平行测定结果的算术平行值为测定结果。
2、平行测定结果的绝对差不大于0.05% 。
硬化剂氯化铵NH4Cl溶液试验方法
一、方法要点:
氯化铵在中性溶液中与甲醛化合生成中性(对酚酞)化合物六次甲基四胺并释放出氯化氢,用碱中和即可算出NH4Cl的浓度。
二、所需试剂:
1 氢氧化钠标准容液: 0.5N
2 中性甲醛溶液 (2:1)
3 酚酞指示剂 (1%乙醇溶液)
三、测定方法:
用移液管吸取NH4Cl溶液1ml置于250ml三角瓶中,加中性甲醛溶液5ml,酚酞指示剂3滴,用氢氧化钠标准溶液滴定至微红色为终点,按下式计算NH4Cl含量:
…… …… 余下全文