篇三 :实验三 硫酸铜的提纯
实验二 硫酸铜的提纯
实验目的
1、了解化学方法提纯粗硫酸铜的原理和方法。
2、练习无机制备的基本操作。
实验原理
粗硫酸铜中含有不溶性杂质和可溶性杂质FeSO4、Fe2(SO4)3等,不溶性杂质可用过滤法除去,杂质FeSO4需要用氧化剂H2O2或Br2氧化为Fe3+,然后调节溶液的pH值4,使Fe3+水解成Fe(OH)3沉淀而除去,其反应如下:
2FeSO4 + H2SO4 + H2O2= Fe2(SO4)3 + 2H2O
Fe3++ 3H2O → Fe(OH)3↓ + 3H+
除去铁离子之后的滤液,蒸发结晶,其它微量可溶性杂质在硫酸铜结晶时仍留在母液中,过滤时可与硫酸铜分离。
实验步骤
称取5g研细的粗硫酸铜放在100mL小烧杯中,加入20mL蒸馏水,加热搅拌促使溶解.
滴加1 mL 3% H2O2,将溶液加热,同时逐滴加入0.5 mol?L-1NaOH溶液,直到pH≈4,再加热片刻静置使水解生成Fe(OH)3沉淀用倾斜法在普通漏斗上过滤,滤液过滤到洁净的蒸发皿中。
在提纯后的硫酸铜滤液中,滴加1mol?L-1 H2SO4酸化,调节pH至1~2,然后在石棉网上加热,蒸发浓缩至液面出现薄层结晶时,即停止加热。
…… …… 余下全文
篇四 :应用化学综合实验实验报告
题目Ⅰ 利用粗铜粉制备硫酸四氨合铜
一、实验目的:
1.掌握利用铜粉制备硫酸铜的方法。
2.用精制的硫酸铜通过配位取代反应制备硫酸四氨合铜。
3.掌握和巩固倾洗法、减压过滤、蒸发浓缩和冷却结晶等试验基本操作。
4.掌握固体的灼烧、直接加热、水浴加热和溶解等操作。
二、实验原理
利用废铜粉灼烧氧化法制备CuSO4·5H2O:先将铜粉在空气中灼烧氧化成氧化铜,然后将其溶于硫酸而制得:
2Cu + O2 === 2CuO(黑色) CuO + H2SO4 === CuSO4 + H2O
由于废铜粉不纯,所得CuSO4溶液中常含有不溶性杂质和可溶性杂质FeSO4、Fe2(SO4)3及其他重金属盐等。Fe2+ 离子需用氧化剂H2O2溶液氧化为Fe3+ 离子,然后调节溶液pH≈4.0,并加热煮沸,使Fe3+ 离子水解为Fe(OH)3沉淀滤去。其反应式为
2Fe2+ + 2H+ + H2O2 === 2Fe3+ + 2H2O Fe3+ + 3H2O === Fe(OH)3↓ + 3H+
…… …… 余下全文
篇五 :硫酸铜的制备及产品质量分析
硫酸铜的制备及产品质量分析
一、实验目的
1.了解硫酸铜的制备原理和用重结晶法提纯物质的基本原理。
2.掌握加热、溶解、蒸发浓缩、结晶、常压过滤、减压过滤等基本操作技术。
3.掌握天平、电炉和研钵的操作。
二、实验原理
(一)硫酸铜的制备
铜是不活泼金属,不能直接和稀硫酸发生反应制备硫酸铜,必须加入氧化剂。在浓硝酸和稀硫酸的混合液中,浓硝酸将铜氧化成Cu2+,Cu2+与SO42-结合得到硫酸铜 :
Cu + 2HNO3 + H2SO4 == == CuSO4 + 2NO2 + 2H2O
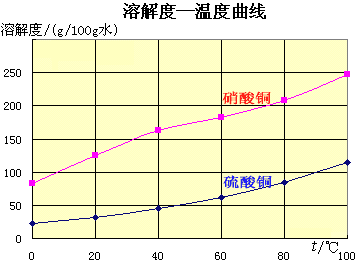
未反应的铜屑(不溶性杂质)用倾滗法除去。利用硝酸铜的溶解度在0~100℃范围内均大于硫酸铜溶解度的性质,溶液经蒸发浓缩析出硫酸铜,经过滤与可溶性杂质硝酸铜分离,得到粗产品。
硫酸铜的溶解度随温度升高而增大,可用重结晶法提纯。在粗产品硫酸铜中,加适量水,加热成饱和溶液,趁热过滤除去不溶性杂质。滤液冷却,析出硫酸铜,过滤,与可溶性杂质分离,得到纯的硫酸铜。

(二)硫酸铜的提纯
硫酸铜为可溶性晶体物质。根据物质的溶解度的不同,可溶性晶体物质中的杂质包括难溶于水的杂质和易溶于水的杂质。一般可先用溶解、过滤的方法,除去可溶性晶体物质中所含的难溶于水的杂质;然后再用重结晶法使可溶性晶体物质中的易溶于水的杂质分离。
…… …… 余下全文
篇六 :粗硫酸铜提纯
一、实验目的
(1)学习粗硫酸铜提纯的原理和方法,掌握水浴加热、常压过滤、减压过滤、蒸发浓缩结晶、重结晶等基本操作技能。
二、实验原理
1.粗硫酸铜提纯的原理
粗硫酸铜晶体中的主要杂质是Fe3+、Fe2+ 以及一些可溶性的物质如Na+ 等。
Cu2+ 与Fe3+ 的分离可以利用溶度积的差异,因为氢氧化铁的Kθsp= 4×10 –38,而氢氧化铜的Kθsp= 2.2×10 –20,当c(Fe3+) 降到10 –6 mol?L-1时,
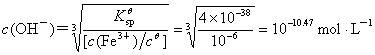
pH = 3.53
而此时溶液中允许存在的Cu2+ 量为
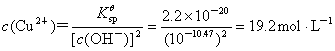
大大超过了CuSO4?5H2O的溶解度,所以Cu2+ 不会沉淀。从上述计算可以粗略看出,Cu2+ 与Fe3+ 是可以利用溶度积的差异,适当控制条件(如pH等),达到分离的目的。
由Cu(OH)2与Fe(OH)2的溶度积计算,Cu2+ 与Fe2+ 似乎也可以用分步沉淀法分离,但由于Cu2+ 是主体,Fe2+ 是杂质,这样进行分步沉淀会产生共沉淀现象(Cu(OH)2沉淀吸附、包裹少量Fe2+ 杂质的现象),达不到分离目的。因此在本实验中先将Fe2+ 在酸性介质中用H2O2氧化成Fe3+ :
…… …… 余下全文
篇七 :实验二 硫酸铜的提纯
实验二 硫酸铜的提纯(3学时)
一、实验目的
1.了解用重结晶法提纯物质的基本原理。
2.练习托盘天平的使用。
3.掌握加热、溶解、蒸发浓缩、结晶、常压过滤、减压过滤等基本操作技术。
二、实验原理
硫酸铜为可溶性晶体物质。根据物质的溶解度的不同,可溶性晶体物质中的杂质包括难溶于水的杂质和易溶于水的杂质。一般可先用溶解、过滤的方法,除去可溶性晶体物质中所含的难溶于水的杂质;然后再用重结晶法使可溶性晶体物质中的易溶于水的杂质分离。
重结晶的原理是由于晶体物质的溶解度一般随温度的降低而减小,当热的饱和溶液冷却时,待提纯的物质首先结晶析出而少量杂质由于尚未达到饱和,仍留在母液中。 粗硫酸铜晶体中的杂质通常以硫酸亚铁(FeSO4)、硫酸铁[Fe2(SO4) 3]为最多。当蒸发浓缩硫酸铜溶液时,亚铁盐易氧化为铁盐,而铁盐易水解,有可能生成Fe(OH) 3 沉淀,混杂于析出的硫酸铜晶体中,所以在蒸发浓缩的过程中,溶液应保持酸性。 若亚铁盐或铁盐含量较多,可先用过氧化氢(H2O2)将 Fe2氧化为 Fe3,再调节溶液++的pH值约至4,使Fe3水解为Fe(OH) 3沉淀过滤而除去。 +
…… …… 余下全文
篇八 :硫酸铜重结晶实验
一. 实验目的1. 了解重结晶法提纯物质的原理及方法;
2. 掌握加热、溶解、蒸发、过滤及结晶等基本操作;
3. 掌握水解反应及抑制水解进行的条件;
4. 了解产品纯度检验的原理及方法。
二. 实验原理
1. 机械杂质分离
机械杂质可以通过倾斜法中除去。
2. Fe2+、Fe3+分离
工业粗硫酸铜中含有不溶性杂质和可溶性杂质FeSO4和Fe2(SO4)3等物质。可用氧化剂H2O2或Br2将杂质Fe2+氧化为Fe3+,然后在溶液pH≈4的条件下,使Fe3+离子水解形成Fe(OH)3沉淀而除去。该过程可用下列反应表示:2Fe2++H2O2+2H+===2Fe3++2H2O Fe3++3H2O===Fe(OH)3↓+3H+
除去铁离子之后的滤液,用检验KNCS没有Fe3+存在,
在 0.01mol/L 的 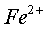 、
、 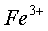 溶液中
溶液中 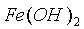 和
和 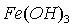 分别于 pH=7.5 、 2.3 时开始沉淀,在 pH=9.7 、 4.1 式沉淀完全(残留离子浓度 <
分别于 pH=7.5 、 2.3 时开始沉淀,在 pH=9.7 、 4.1 式沉淀完全(残留离子浓度 < 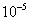 mol/L )。
mol/L )。
3. 结晶或重结晶纯化
可溶性晶体物质中的杂质可以通过重结晶法除去。重结晶的原理是基于物质的溶解度一般随着温度的降低而减小,当热的饱和溶液冷却时,待提取物质首先以结晶析出,而少量杂质由于还没有达到饱和,仍然留在母液当中,通过过滤即可获得纯物质。
…… …… 余下全文