硫酸铜重结晶实验
一. 实验目的1. 了解重结晶法提纯物质的原理及方法;
2. 掌握加热、溶解、蒸发、过滤及结晶等基本操作;
3. 掌握水解反应及抑制水解进行的条件;
4. 了解产品纯度检验的原理及方法。
二. 实验原理
1. 机械杂质分离
机械杂质可以通过倾斜法中除去。
2. Fe2+、Fe3+分离
工业粗硫酸铜中含有不溶性杂质和可溶性杂质FeSO4和Fe2(SO4)3等物质。可用氧化剂H2O2或Br2将杂质Fe2+氧化为Fe3+,然后在溶液pH≈4的条件下,使Fe3+离子水解形成Fe(OH)3沉淀而除去。该过程可用下列反应表示:2Fe2++H2O2+2H+===2Fe3++2H2O Fe3++3H2O===Fe(OH)3↓+3H+
除去铁离子之后的滤液,用检验KNCS没有Fe3+存在,
在 0.01mol/L 的 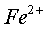 、
、 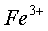 溶液中
溶液中 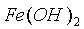 和
和 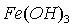 分别于 pH=7.5 、 2.3 时开始沉淀,在 pH=9.7 、 4.1 式沉淀完全(残留离子浓度 <
分别于 pH=7.5 、 2.3 时开始沉淀,在 pH=9.7 、 4.1 式沉淀完全(残留离子浓度 < 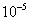 mol/L )。
mol/L )。
3. 结晶或重结晶纯化
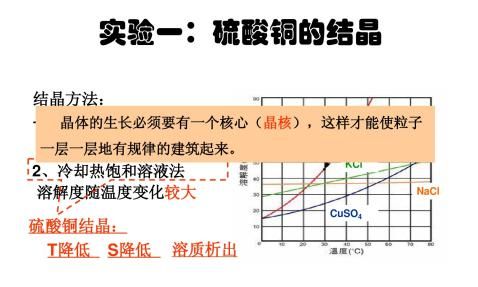
可溶性晶体物质中的杂质可以通过重结晶法除去。重结晶的原理是基于物质的溶解度一般随着温度的降低而减小,当热的饱和溶液冷却时,待提取物质首先以结晶析出,而少量杂质由于还没有达到饱和,仍然留在母液当中,通过过滤即可获得纯物质。
4.
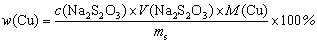
式中, 为铜的百分含量,ms为硫酸铜晶体的质量,Ar(Cu)为铜的摩尔原子质量
三. 仪器、试剂
1. 仪器 分析天平,普通漏斗,布氏漏斗,吸滤瓶,蒸发皿,真空泵,台秤、烧杯(100rnl) 、量筒、石棉网、玻棒、酒精灯、漏斗架、表面皿、铁三脚、洗瓶、油滤装置、硫酸铜回收瓶。
2. 试剂 2 mol·L-1 HCl,1 mol·L-1 H2SO4,3.0% H2O2,6 mol·L-1、2 mol·L-1 NH3·H2O,2 mol·L-1 NaOH,0.1 mol·L-1 KSCN,粗硫酸铜(研细的粉末),NaOH(0.5 mol?L-1)。
3. 材料 滤纸,火柴,称量纸,角勺,pH试纸
四. 实验内容
1.粗硫酸铜的提纯
(1)称量和溶解
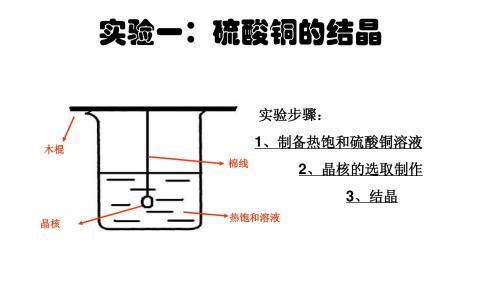
用天平称取工业粗硫酸铜晶体8 g,在研钵中研细后,再重新称量6g,放入100 mL烧杯中,加入30 mL蒸馏水。将烧杯放在石棉网上加热,用玻璃棒搅拌使晶体溶解。溶解时加入2~3滴1 mol·L-1的H2SO4溶液以加速溶解。
(2)沉淀和过滤
向溶液中逐滴加入2 mL 3.0%的H2O2溶液,加热,边搅拌边逐滴加入2 mol·L-1 的NaOH溶液到pH≈4(用pH试纸检验)。再加热片刻,静置,使红棕色Fe(OH)3沉降。趁热用倾析法在普通漏斗上过滤,滤液收在洁净的蒸发皿中,用蒸馏水洗涤烧杯及玻璃棒,洗涤液也全部转入蒸发皿中。
(三)蒸发和结晶
在滤液中滴入2滴1mol?L-1H2SO4溶液,调节pH=1~2,使溶液酸化,然后放在石棉网上加热,蒸发浓缩(切勿加热过猛以免液体溅失)。当溶液表面刚出现一层极薄的晶膜时,停止加热。静置冷却至室温,使CuSO4?5H2O充分结晶析出。
(四)减压过滤
将蒸发皿中CuSO4?5H2O晶体用玻棒全部转移到布氏漏斗中,抽气减压过滤,尽量抽干,并用干净的玻棒轻轻挤压布氏漏斗上的晶体,尽可能除去晶体间夹的母液。停止抽气过滤,将晶体转到已备好的干净滤纸上,再用滤纸尽量吸干母液,然后将晶体用台秤称量,计算产率。晶体倒入硫酸铜回收瓶中。
五、结果记录
粗硫酸铜的重量W1 = g 精制硫酸铜的重量W2 = g。
(六)称重、计算产率
用天平称量产品质量,计算产率。
2. 纯度检定
称1 g已研细的粗硫酸铜和1 g提纯后的硫酸铜晶体分别按照以下操作步骤进行:
(1) 把晶体倒入小烧杯加10 mL蒸馏水溶解,再加入1 mL 1 mol·L-1 H2SO4酸化(可用试纸检验),逐滴加入2 mL 3.0% H2O2,煮沸片刻,使Fe2+氧化为Fe3+。
(2) 溶液冷却后在搅拌条件下分别逐滴加入6 mol·L-1氨水,直至生成的蓝色沉淀完全溶解,溶液呈深蓝色为止,其反应为:
Fe3++3NH3+3H2O=Fe(OH)3↓+3NH4+
2CuSO4+2NH3+2H2O=Cu2(OH)2SO4+(NH4)2SO4
Cu2(OH)2SO4+(NH4)2SO4+6NH3=2[Cu(NH3)4]SO4+2H2O
(3) 用普通漏斗过滤后,向滤纸上滴加2 mol·L-1氨水,直至滤纸上的蓝色褪去为止,弃去滤液。
(4) 用滴管滴加3 mL 2 mol·L-1 HCl至滤纸上,溶解Fe(OH)3沉淀,溶液收集于一干净的试管中(如果一次不能完全溶解,可用滤液再次溶解,反复操作,直到Fe(OH)3完全溶解)。
(5) 向溶液中加入1滴0.1 mol·L-1 KSCN,溶液变成血红色。Fe3+浓度越大,红色越深,可根据颜色深浅比较溶液含Fe3+的多少,评价工业粗硫酸铜晶体的提纯效果。
提问思考题
1、粗硫酸铜溶液中杂质Fe2+为什么要氧化为Fe3+除去?
因为氢氧化亚铁比氢氧化铜先沉淀,氢氧化铜比氢氧化铁先沉淀。
如果不氧化,无法分离铜离子和亚铁离子。
二价铁离子只有在PH值为7.6-9.6的时候才会沉淀
二价铜离子只有在PH值为4.4-6.4的时候才会沉淀
三价铁离子只有在PH值为2.7-3.7的时候才会沉淀
如果不先把二价铁离子氧化为三价铁离子,直接加入碱,则会造成二价铁离子与二价铜离子一起沉淀,这样就达不到除杂的目的了
2、除Fe3+时,为什么要调节到pH≈4左右?pH值太小或太大有什么影响?
如果PH太高的话,铜离子则会生成沉淀,如果太低的话则不利于Fe3+的沉淀形成.
3、怎样鉴定提纯后的硫酸铜纯度?
1,为什么用双氧水而不用高锰酸钾或者重铬酸钾氧化Fe2+?
因为用后两种会产生新的杂质,且会污染环境,二者本身又有颜色,会干扰试验。双氧水足可氧化Fe2+,还原产物为水,避免带来新的杂质
2,精制后的硫酸铜溶液为什么要滴几滴稀硫酸调节PH至1-2,然后再加热蒸发?
调节PH值,抑制硫酸铜水解。因为硫酸铜是强酸弱碱盐,加热的时候,回出现水解现象,有氢氧化铜胶体,CuSO4 + 2H2O = Cu(OH)2 + H2SO4 ,此反应是可逆的。加入硫酸后,反应向左移动,抑制硫酸铜的水解
2.实验中如何控制得合格的硫酸铜五水合物?
控制加热的温度.
3.要提高产品的纯度应注意什么问题?
注意温度不要过高,防止结晶水被去掉.
注意事项
1、注意各步的pH值控制。
2、蒸发浓缩时,要小火加热。
3、注意滤纸的使用。
4、注意减压过滤操作。
5、提存过的粗品和硫酸铜同时进行鉴定和比较。
。
第二篇:7.4 结晶现象-硫酸铜晶体的制备实验 课件 (粤教版九年级下)



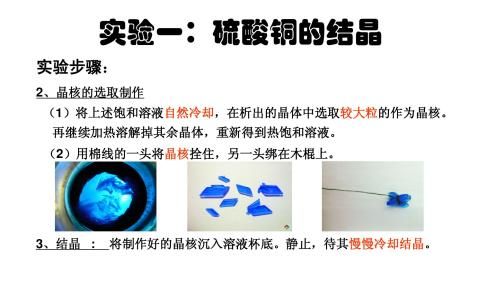
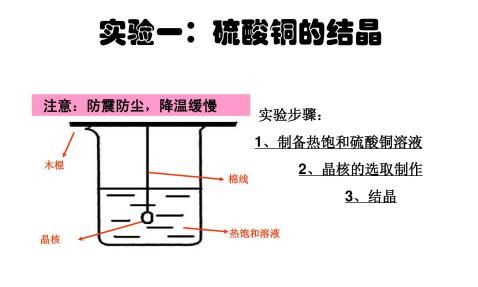

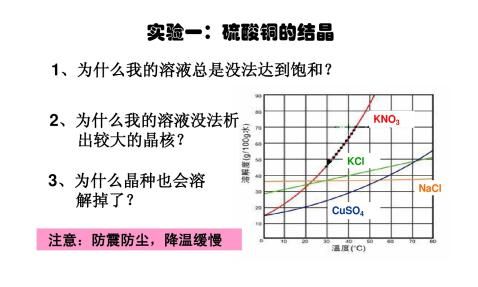
-
重结晶实验报告
广东工业大学学院姓名协作者教师评定实验题目重结晶一实验目的1学习重结晶提纯固态有机化合物的原理和方法2掌握抽滤热滤操作和滤纸折叠的…
-
有机化学实验报告 重结晶
实验学专班姓指导日机化学实验报告名称重结晶提纯法院化学工程学院业化学工程与工艺级化工班名学号教师期有一实验目的学习重结晶法提纯固态…
-
乙酰苯胺的重结晶实验报告(4)沈x
有机化学实验报告实验名称:乙酰苯胺的重结晶学院:化学工程学院专业:化学工程与工艺班级:化工11-4班姓名:沈x学号********…
-
苯甲酸重结晶实验报告
苯甲酸的重结晶实验目的了解重结晶提纯粗苯甲酸的原理和方法实验原理苯甲酸在水中的溶解度随温度的变化较大通过重结晶可以使它与杂质分离从…
-
苯甲酸重结晶实验报告作业
实验二苯甲酸的重结晶及测熔点10级班1一实验目的1了解重结晶原理初步学会用重结晶方法提纯固体有机化合物2掌握热过滤和抽滤操作二基本…
-
学校双拥工作总结材料
学校双拥工作总结材料_单位总结国防教育和双拥工作是关系到国计民生的大事。多年来,**市第二中学非常重视国防教育,并在“拥军优属、拥…
-
校外实习总结报告
经历了一个月的实习生活,让我初尝了身为一名教师的酸甜苦辣。回顾和学生们一起走过的日子,不禁想起自己的中学时代,一份灵活,一份大胆。…
-
家长教子工作总结 00
XX小学“家长教子”工作总结(20xx——20xx学年度第一学期)家庭是社会的细胞,家庭教育是基础教育,又是终身教育,它对一个人的…
-
中心学校双拥工作总结
中心学校20xx年双拥工作总结双拥工作是关系到国计民生的大事。近两年来,我校很重视此项工作,将双拥工作列入学校工作计划,把双拥工作…
-
学习生活个人总结
转眼间,我已不再是那个初入大学殿堂的大一新生了,也不再是那个经常向师兄师姐寻求帮助的师妹了。大一的时光短暂而又漫长,我所学的是那么…