篇一 :缓冲溶液配制实验

缓冲溶液的配制和PH的测定
区县____________学号____________姓名___________
成绩_________

实验内容:
1.HAc-NaAc缓冲溶液的配制
注意:百里酚蓝指示剂的变色范围如下:

在试管中加入3mL0.1mol·L-1的HAc和3mL0.1mol·L-1的NaAc溶液就配制成了该缓冲溶液.加百里酚蓝指示剂5滴,显示___________色.
计算此缓冲溶液的pH
将配制的缓冲溶液为为3份.
(1)取一份,加入5滴0.1mol·L-1的盐酸,则颜色变化是_____________
_____________________________.再加入过量的0.1mol·L-1的盐酸,则颜色的变化是_________________________________.
…… …… 余下全文
篇二 :实验七:缓冲溶液的配制与性能
实验七:缓冲溶液的配制与性能
一 实验目的
(1)学习缓冲溶液的配制方法,加深对缓冲溶液性质的理解
(2)了解缓冲容量与缓冲剂浓度和缓冲组分的比值关系:
(3)练习吸量管的使用方法。
二 实验原理
能抵抗外来少量强酸、强碱或适当稀释而保持pH值基本不变的溶液叫缓冲溶液。缓冲溶液一般是由弱酸及其盐、弱碱及其盐、多元弱酸的酸式盐及其次级盐组成。缓冲溶液的pH值可用下式计算:
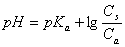 或
或 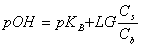
缓冲溶液pH值除主要决定于pKb(pKb)外,还与盐和酸(或碱)的浓度比值有关,若配制缓冲溶液所用的盐和酸(或碱)的原始浓度相同均为C,酸(碱)的体积为Va(Vb),盐的体积为Vs总体积为V,混合后酸(或碱)的浓度为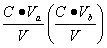 ,盐的浓度为
,盐的浓度为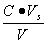 ,则
,则
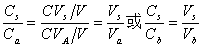
所以缓冲溶液pH值可写为
 或
或 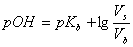
配制缓冲溶液时,只要按计算值量取盐和酸〔或碱)溶液的体积,混合后即可得到一定pH值的缓冲溶液。
…… …… 余下全文
篇三 :EDTA标准溶液的配制与标定实验报告
EDTA标准溶液的配制与标定实验报告
EDTA标准溶液的配制与标定
一、实验目的
(1)、掌握EDTA标准溶液的配制与标定方法。
(2)、掌握铬黑T指示剂的应用条件和终点颜色变化。
二、实验原理
EDTA(Na2H2Y)标准溶液可用直接法配制,也可以先配制粗略浓度,再用金属Zn、ZnO、CaCO3或MgSO4· 7H2O等标准物质来标定。当用金属锌标定时,用铬黑T(H3In)做指示剂,在pH=10的款冲溶液中进行,滴定到溶液呈蓝色时为止。滴定反应式:
指示剂反应 Hln2- + Zn2+ = Znln- + H+
滴定反应 H2Y2- + Zn2+ = ZnY2- + 2H+
终点反应 Znln- + H2Y2- ↔ ZnY2- + Hln2- + H+
二、实验注意事项
(1)、称取EDTA和金属时,保留四位有效数;
(2)、控制好滴定速度;
(3)、加热锌溶解时,用表面皿盖住以免蒸发掉。
三、主要仪器与药品
仪器:酸式滴定管、25ml移液管、250ml容量瓶、250ml锥形瓶、250ml烧杯、表面皿。
…… …… 余下全文
篇四 :分析化学实验-常用缓冲溶液的配制及原理-北理工
分析化学实验-缓冲溶液配制原理&常用缓冲溶液的配制
一、缓冲溶液与缓冲作用原理
(一)缓冲作用与缓冲溶液
纯水在25℃时PH值为7.0,但只要与空气接触一段时间,因为吸收二氧化碳而使PH值降到5.5左右。1滴浓盐酸(约12.4mol·L-1)加入1升纯水中,可使[H+]增加5000倍左右(由1.0×10-7增至5×10-4mol·L-1),若将1滴氢氧化钠溶液(12.4mol·L-1)加到1升纯水中,PH变化也有3个单位。可见纯水的PH值因加入少量的强酸或强碱而发生很大变化。然而,1滴浓盐酸加入到1升HAc-NaOAc混合溶液或NaH2PO4-Na2HPO4混合溶液中,[H+]的增加不到百分之一(从1.00×10-7增至1.01×10-7mol·L-1),PH值没有明显变化.这种能对抗外来少量强酸\强碱或稍加稀释不引起溶液PH值发生明显变化的作用叫做缓冲作用;具有缓冲作用的溶液,叫做缓冲溶液。
(二)缓冲溶液的组成
缓冲溶液由足够浓度的共轭酸碱对组成。其中,能对抗外来强碱的称为共轭酸,能对抗外来强酸的称为共轭碱,这一对共轭酸碱通常称为缓冲对、缓冲剂或缓冲系,常见的缓冲对主要有三种类型。
…… …… 余下全文
篇五 :生物化学实验常用试剂、缓冲溶液的配制
生物化学实验常用试剂、缓冲溶液的配制方法
http://vok-bio.com/news_view.asp?id=9
1、0.5mol/L氢氧化钠溶液 □组份浓度 0.5mol/L
□配制量 2L
□配置方法 1.准确称取氢氧化钠40g。
2.用去离子水溶解并稀释至2L。
2、0.5mol/L盐酸溶液 □组份浓度 0.5mol/L
□配制量 2L
□配置方法 1.准确量取盐酸83.4mL。
2.用去离子水稀释至2L。
4、0.2%葡萄糖标准溶液 □组份浓度 0.2%
□配制量 1L
□配置方法 1.称取葡萄糖2.5g置于称量瓶中,在70℃干燥2小时。
2.干燥器中冷却至室温,重复干燥,冷却至恒重。
3.准确称取葡萄糖2.000g。
4.用去离子水溶解并定容至1L
5.于4℃保存。
5、250μg/mL牛血清 □组份浓度 250μg/mL
白蛋白标准液 □配制量 2L
□配置方法 1.准确称取250mg标准牛血清白蛋白。
2.用0.03mol/LpH7.8的磷酸缓冲液溶解并定容至1L。
…… …… 余下全文
篇六 :实验室常用的50种缓冲溶液的配制
1.乙醇-醋酸铵缓冲液(pH3.7)
取5mol/L醋酸溶液15.0ml,加乙醇60ml和水20ml,用10mol/L氢氧化铵溶液调节pH值至3.7,用水稀释至1000ml,即得。
2.三羟甲基氨基甲烷缓冲液(pH8.0)
取三羟甲基氨基甲烷12.14g,加水800ml,搅拌溶解,并稀释至1000ml,用6mol/L盐酸溶液调节pH值至8.0,即得。
3.三羟甲基氨基甲烷缓冲液(pH8.1)
取氯化钙0.294g,加0.2mol/L三羟甲基氨基甲烷溶液40ml使溶解,用1mol/L盐酸溶液调节pH值至8.1,加水稀释至100ml,即得。
4.三羟甲基氨基甲烷缓冲液(pH9.0)
取三羟甲基氨基甲烷6.06g,加盐酸赖氨酸3.65g、氯化钠5.8g、乙二胺四醋酸二钠0.37g,再加水溶解使成1000ml,调节pH值至9.0,即得。
5.乌洛托品缓冲液
取乌洛托品75g,加水溶解后,加浓氨溶液4.2ml,再用水稀释至250ml,即得。
6.巴比妥缓冲液(pH7.4)
取巴比妥钠4.42g,加水使溶解并稀释至400ml,用2mol/L盐酸溶液调节pH值至7.4,滤过,即得。
…… …… 余下全文
篇七 :一、实验室常用试剂、缓冲液的配制方法
一、实验室常用试剂、缓冲液的配制方法

1 M Tris-HCl(pH7.4,7.6,8.0)
组份浓度 1 M Tris-HCl
配制量 1L
配制方法 1.称量121.1 g Tris置于l L烧杯中。
2.加入约800 ml的去离子水,充分搅拌溶解。
3.按下表加入浓HCl量调节所需要的pH值。
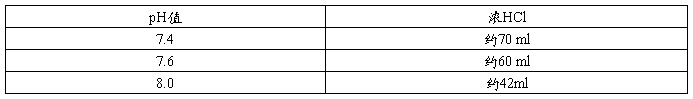
4.将溶液定容至1 L。
5.高温高压灭菌后,室温保存。
注意:应使溶液冷却至室温后再调定pH值,因为Tris溶液的pH值随温度的变化差异很大,温度每升高l℃,溶液的pH值大约降低0.03个单位。

1.5 M Tris-HCl(pH8.8)
…… …… 余下全文
篇八 :-设计性实验-生物缓冲溶液的配制及pH值的测定和调校
实验六 生物缓冲溶液的配制及pH值的测定和调校
[教学内容及掌握程度]
了解:用pH标准溶液定位的意义和温度补偿装置的作用。
掌握:
1. 溶液pH值测定的基本原理与方法。
2. 生物缓冲溶液的配制方法。
3. 酸度计性能检验的意义。
[学习难点]
学员独立分析解决问题能力的培养。
[教学时数与教学形式] 3学时(实验)
[实施方法与学习建议] 本实验为设计性实验,实验前认真审阅学员拟定的实验方案。利用学员阐述、教员讲评的方式进行讨论交流,帮助学员养成初步的科研能力。复习缓冲溶液、pH测定及酸度计的性能等相关基本知识,再查阅资料,确定实验方案,方案要具体,包括:研究目的、实验原理、材料与方法、实验设计、预期结果、参考文献等。体会分析方法的建立过程。
…… …… 余下全文