篇一 :高中化学平衡归纳总结
高中化学平衡的归纳总结
化学反应速率与化学平衡
一、高考展望:
化学反应速率和化学平衡理论的初步知识是中学化学的重要基本理论。从历年高考经典聚焦也不难看出,这是每年高考都要涉及的内容。从高考试题看,考查的知识点主要是:①有关反应速率的计算和比较;②条件对反应速率影响的判断;③确定某种情况是否是化学平衡状态的特征;④平衡移动原理的应用;⑤转化率的计算或比较;⑥速率、转化率、平衡移动等多种图象的分析。要特别注意本单元知识与图象结合的试题比较多。从题型看主要是选择题和填空题,其主要形式有:⑴根据化学方程式确定各物质的反应速率;⑵根据给定条件,确定反应中各物质的平均速率;⑶理解化学平衡特征的含义,确定某种情况下化学反应是否达到平衡状态;⑷应用等效平衡的方法分析问题;⑸应用有关原理解决模拟的实际生产问题;⑹平衡移动原理在各类平衡中的应用;⑺用图象表示外界条件对化学平衡的影响或者根据图象推测外界条件的变化;⑻根据条件确定可逆反应中某一物质的转化率、消耗量、气体体积、平均式量的变化等。预计以上考试内容和形式在今后的高考中不会有太大的突破。
从考题难度分析,历年高考题中,本单元的考题中基础题、中档题、难题都有出现。因为高考中有几年出现了这方面的难题,所以各种复习资料中高难度的练习题较多。从新大纲的要求预测命题趋势,这部分内容试题的难度应该趋于平缓,从20xx年高考题看(考的是图象题),平衡方面的题目起点水平并不是太高。在今后的复习中应该抓牢基础知识,掌握基本方法,提高复习效率。
…… …… 余下全文
篇二 :化学平衡知识点总结
化学平衡基础知识
三、化学平衡
1、可逆反应
⑴定义:在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应叫做可逆反应。用“ ”代替“==”。
”代替“==”。
⑵可逆反应中所谓的正反应、逆反应是相对的,一般把向右进行的反应叫做正反应,向左进行的反应叫做逆反应。
⑶在不同条件下能向两个方向进行的反应不叫可逆反应。如:
2H2 + O2 2H2O;2H2O
2H2O;2H2O 2H2↑+ O2↑
2H2↑+ O2↑
⑷可逆反应不能进行到底,在一定条件下只能进行到一定程度后达到平衡状态。
2、化学反应的限度
⑴化学反应的限度就是研究可逆反应在一定条件下所能达到的最大限度。
⑵反应的转化率
反应物的转化率:α=
3、化学平衡
⑴化学平衡状态:在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应物和生成物的浓度保持不变的状态,叫做化学平衡状态,简称化学平衡。
…… …… 余下全文
篇三 :化学平衡图像总结
化学平衡图像
一.化学平衡图象常见类型
注意:(1)首先要看清楚横轴和纵轴意义(特别是纵轴。表示转化率和表示反应物的百分含量情况就完全相反)以及曲线本身属等温线还是等压线。(当有多余曲线及两个以上条件时,要注意“定一议二”)
(2)找出曲线上的特殊点,并理解其含义。(如“先拐先平数值大”)
(3)根据纵轴随横轴的变化情况,判定曲线正确走势,以淘汰错误的选项。
1、速率—时间图
 此类图象定性地揭示了v正、v逆随时间(含条件改变对速率的影响)而变化的规律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向.
此类图象定性地揭示了v正、v逆随时间(含条件改变对速率的影响)而变化的规律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向.
例1:对达到平衡状态的可逆反应X+Y Z+W,在其他条件不变的情况下,增大压强,反应速率变化图象如图1所示,则图象中关于X、Y、Z、W四种物质的聚集状态为( )
Z+W,在其他条件不变的情况下,增大压强,反应速率变化图象如图1所示,则图象中关于X、Y、Z、W四种物质的聚集状态为( )
…… …… 余下全文
篇四 :化学反应速率、化学平衡知识点总结用
化学反应速率和平化学衡
【命题规律】
化学反应速率和化学平衡是高考的必考内容,其主要命题内容有:①化学反应速率影响因素及计算;②化学平衡状态的判断及影响因素;③应用平衡原理判断反应进行的方向;④化学反应速率和化学平衡的图象分析;⑤转化率、平衡常数的含义及简单计算。
将化学反应速率和化学平衡移动的原理与化工生产、生活实际相结合的题目是最近几年的高考命题的热点。特别是化学平衡常数的影响因素及其计算是新教材增加的内容,应引起同学们的关注 。
【知识网络】
【重点知识梳理】
一 物质状态和浓度对反应速率的影响
1.对于有固体参加的化学反应而言,由于在一定条件下,固体的浓度是固定的,所以固体物质在化学反应中浓度不改变,因此在表示化学反应速率时,不能用固体物质。但因为固体物质的反应是在其表面进行的,故与其表面积有关,当固体颗粒变小时,会增大表面积,加快反应速率。
2.对于有气体参加的反应而言,改变压强,对化学反应速率产生影响的根本原因是引起浓度改变所致。所以,在讨论压强对反应速率的影响时,应区分引起压强改变的原因,这种改变对反应体系的浓度产生何种影响,由此判断出对反应速率产生何种影响。
…… …… 余下全文
篇五 :【人教版】高中化学选修4知识点总结:第二章化学反应速率和化学平衡
第二章化学反应速率和化学平衡
一、化学反应速率
课标要求
1、掌握化学反应速率的含义及其计算
2、了解测定化学反应速率的实验方法
要点精讲
1、化学反应速率
(1)化学反应速率的概念
化学反应速率是用来衡量化学反应进行的快慢程度的物理量。
(2)化学反应速率的表示方法
 对于反应体系体积不变的化学反应,通常用单位时间内反应物或生成物的物质的量浓度的变化值表示。
对于反应体系体积不变的化学反应,通常用单位时间内反应物或生成物的物质的量浓度的变化值表示。
某一物质A的化学反应速率的表达式为:
式中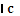 ——某物质A的浓度变化,常用单位为mol·L-1。
——某物质A的浓度变化,常用单位为mol·L-1。
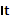 ——某段时间间隔,常用单位为s,min,h。
——某段时间间隔,常用单位为s,min,h。
υ——物质A的反应速率,常用单位是mol·L-1·s-1,mol·L-1·s-1等。
(3)化学反应速率的计算规律
①同一反应中不同物质的化学反应速率间的关系
同一时间内,用不同的物质表示的同一反应的反应速率数值之比等于化学方程式中各物质的化学计量数之比。
②化学反应速率的计算规律
同一化学反应,用不同物质的浓度变化表示的化学反应速率之比等于反应方程式中相应的物质的化学计量数之比,这是有关化学反应速率的计算或换算的依据。
…… …… 余下全文
篇六 :化学平衡移动原理总结
化学平衡系列问题
化学平衡移动影响条件
(一)在反应速率(v)-时间(t)图象中,在保持平衡的某时刻t1改变某一条件前后,
V正、V逆的变化有两种:
V正、V逆同时突变——温度、压强、催化剂的影响
V正、V逆之一渐变——一种成分浓度的改变
对于可逆反应:mA(g) + nB(g)  pc(g) + qD(g) + (正反应放热)
pc(g) + qD(g) + (正反应放热)
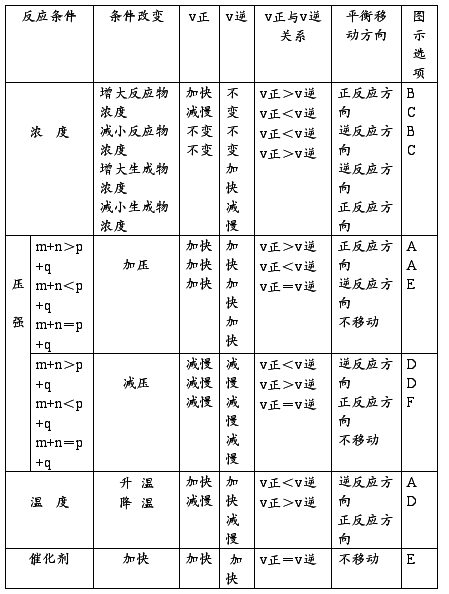

【总结】增大反应物浓度或减小生成物浓度,化学平衡向正反应方向移动;减小反应物浓度或增大生成物浓度,化学平衡向逆反应方向移动。
增大压强,化学平衡向系数减小的方向移动;减小压强,平衡会向系数增大的方向移动。
升高温度,平衡向着吸热反应的方向移动;降低温度,平衡向放热反应的方向移动。
催化剂不改变平衡移动
(二)勒夏特列原理(平衡移动原理)
如果改变影响平衡的一个条件,平衡就会向着减弱这种改变的方向移动。
具体地说就是:增大浓度,平衡就会向着浓度减小的方向移动;减小浓度,平衡就会向着浓度增大的方向移动。
增大压强,平衡就会向着压强减小的方向移动;减小压强,平衡就会向着压强增大的方向移动。
…… …… 余下全文
篇七 :化学平衡中规律总结
化学平衡中规律总结
解决化学平衡中的一些问题,关键是建立等效平衡的模型。
一、转化率:
转化率(只针对反应物而言):
反应物的转化率=反应物转化的物质的量(或体积、浓度)/反应物起始的物质的量(或体积、浓度)×100%
(一)转化率与浓度的关系
1、增大或减少某反应物浓度判断转化率的变化
例1.在557℃时,密闭容器中进行下列反应 CO(g)+H2O(g) 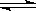 CO2(g)+H2(g)。
CO2(g)+H2(g)。
若CO起始浓度为2mol/L,水蒸气浓度为3mol/L,达到平衡时,测得CO2的浓度为1.2mol/L。求CO及H2O的转化率。
例2.若将例1中,改成水蒸气浓度为6mol/L,而其他条件不变,达到平衡时,测得CO2的浓度为1.5mol/L。则CO转化率为 ,H2O的转化率为 。
例3.若将例1中,改成CO起始浓度为1mol/L,而其他条件不变,达到平衡时,测得CO2的浓度为0.75mol/L。则CO转化率为 ,H2O的转化率为 。
…… …… 余下全文
篇八 :化学平衡知识点总结
第二章化学反应速率和化学平衡
一、可逆反应
⑴定义:在同一条件下,同时向正逆两个方向进行的化学反应。
⑵可逆反应中所谓的正反应、逆反应是相对的,一般把向右进行的反应叫做正反应,向左进行的反应叫做逆反应。
⑶在不同条件下能向两个方向进行的反应不叫可逆反应。
⑷可逆反应不能进行到底,在一定条件下只能进行到一定程度后达到平衡状态。
二、化学反应的限度
⑴化学反应的限度就是研究可逆反应在一定条件下所能达到的最大限度。
⑵反应的转化率
反应物的转化率:α=
三、化学平衡
⑴化学平衡状态:在一定条件下,当可逆反应的正、逆反应速率相等时,体系中各种物质的含量(物质的量、浓度、体积分数、质量分数等)保持恒定的状态。
①化学平衡的微观标志(即本质):v正=v逆
②化学平衡的宏观标志:反应混合物中各组分的浓度和体积分数保持不变。
⑵化学平衡的特征
①逆:化学平衡研究的对象是可逆反应。
②动:化学平衡是动态平衡,反应处于平衡态时,化学反应仍在进行,反应并没有停止。
③等:化学反应处于化学平衡状态时,正反应速率等于逆反应速率,且都不等于零。④定:化学反应处于化学平衡状态时,反应混合物中各组分的浓度保持一定,体积分数保持一定。对反应物,有一定的转化率,对生成物,有一定的产率。
…… …… 余下全文