化学平衡图像总结
化学平衡图像
一.化学平衡图象常见类型
注意:(1)首先要看清楚横轴和纵轴意义(特别是纵轴。表示转化率和表示反应物的百分含量情况就完全相反)以及曲线本身属等温线还是等压线。(当有多余曲线及两个以上条件时,要注意“定一议二”)
(2)找出曲线上的特殊点,并理解其含义。(如“先拐先平数值大”)
(3)根据纵轴随横轴的变化情况,判定曲线正确走势,以淘汰错误的选项。
1、速率—时间图
 此类图象定性地揭示了v正、v逆随时间(含条件改变对速率的影响)而变化的规律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向.
此类图象定性地揭示了v正、v逆随时间(含条件改变对速率的影响)而变化的规律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向.
例1:对达到平衡状态的可逆反应X+Y Z+W,在其他条件不变的情况下,增大压强,反应速率变化图象如图1所示,则图象中关于X、Y、Z、W四种物质的聚集状态为( )
Z+W,在其他条件不变的情况下,增大压强,反应速率变化图象如图1所示,则图象中关于X、Y、Z、W四种物质的聚集状态为( )
A.Z、W均为气体,X、Y中有一种是气
B.Z、W中有一种是气体,X、Y皆非气体
C.X、Y、Z、W皆非气体
D.X、Y均为气体,Z、W中有一种为气体
专练1:A(g)+3B(g)  2C(g)+Q(Q>0)达到平衡,改变下列条件,正反应速率始终增大,直达到新平衡的是( )
2C(g)+Q(Q>0)达到平衡,改变下列条件,正反应速率始终增大,直达到新平衡的是( )
A.升温 B.加压 C.增大c(A) D.降低c(C) E.降低c(A)
2、浓度—时间图
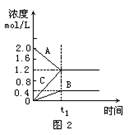 此类图象能说明各平衡体系组分(或某一成分)在反应过程中的变化情况.解题时要注意各物质曲线的折点(达平衡时刻)。
此类图象能说明各平衡体系组分(或某一成分)在反应过程中的变化情况.解题时要注意各物质曲线的折点(达平衡时刻)。
例2:图2表示800℃时A、B、C三种气体物质的浓度随时间
的变化情况,t1是到达平衡状态的时间.试回答:
(1)该反应的反应物是______;
(2)反应物的转化率是______;
(3)该反应的化学方程式为______.
3、含量—时间—温度(压强)图
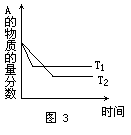 例3:同压、不同温度下的反应:A(g)+B(g)
例3:同压、不同温度下的反应:A(g)+B(g) C(g);△HA的含量和温度的关系如图3所示,下列结论正确的是 ( )
C(g);△HA的含量和温度的关系如图3所示,下列结论正确的是 ( )
A.T1>T2,△H>0 B.T1<T2,△H>0 C.T1>T2,△H<0 D.T1<T2,△H<0
专练3:现有可逆反应A(g)+2B(g) nC(g);△H<0,在相同温度、不同压强时,A的转化率跟反应时间(t)的关系如图4,其中结论正确的是()
nC(g);△H<0,在相同温度、不同压强时,A的转化率跟反应时间(t)的关系如图4,其中结论正确的是()
A.p1>p2,n>3 B.p1<p2,n>3
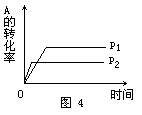 C.p1<p2,n<3 D.p1>p2,n=3
C.p1<p2,n<3 D.p1>p2,n=3
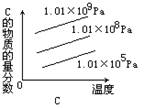
4、恒压(温)线
该类图象的纵坐标为物质的平衡浓度或反应物的转化率,横坐标为温度或压强.
例4:对于反应2A(g)+B(g) 2C(g);△H<0,下列图象正确的是 ( )
2C(g);△H<0,下列图象正确的是 ( )

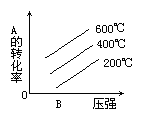

例5:速率—温度(压强)图
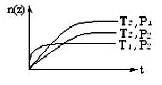 11.反应2X(气)+Y(气)
11.反应2X(气)+Y(气)  2Z(气)(正反应为放热反应),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量[n(z)]与反应时间(t)的关系如图所示。下列判断正确的是( )
2Z(气)(正反应为放热反应),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量[n(z)]与反应时间(t)的关系如图所示。下列判断正确的是( )
A.T1<T2,P1<P2 B.T1<T2,P1>P2
C.T1>T2,P1>P2 D.T1>T2,P1<P2
小结:
一看轴(纵、横坐标的意义);
二看线(线的走向和变化趋势);
三看点(起点、折点、交点、终点、零点的意义);
四看要不要作辅助线(等温线、等压线、平衡线);
五看量的变化(如浓度变化、温度变化等);
六想规律(外界条件对反应速率的影响规律和化学平衡移动规律);
七作判断,做出答案。
第二篇:关于化学平衡的总结
 关于化学平衡的总结
关于化学平衡的总结
1;关于化学平衡
指在一定条件下的可逆反应里,当正逆反应速率相等时,反应混合物中各组分的质量和浓度保持不变时。
有以下特征;
逆…..只有可逆反应才有化学平衡一说。
等…..达到平衡时。V正=V逆【对于同一物质速度数字相同。不同物质速度之比等于化学计量数之比】
动…..其为动态平衡,反应仍在进行。
定…..混合物中各物质的浓度一定,反应速率一定,反应物转化率一定,各组分的含量一定,化学平衡常数一定。
变…..影响化学平衡条件改变【温度。压强。浓度】。平衡会改变。
同…..对一确定的可逆反应无论其进行的方式如何其平衡不变
2化学平衡的标志
1V正=v逆【本质特征】。各组分浓度保持不变【表观特征】
2间接标志;物质的量。气体体积,压强。密度。平均相对分质量,温度,颜色,可作为化学平衡的标志
3对于气体。判断应注意一下情况
1;从混合气体平均相对分子质量来判断【M=m总/n总】
各个成分都为气体时
当气体Δn=0时可用于判断;当Δn不等于0时不可用于判断。
有非气体参加时无论Δn是否等于0都可用于判断。
2从气体密度判断【密度=质量/体积】
若参加反应的反应物都为气体时
衡容时不可用于判断,恒压时n+m=p+q时不可用于判断,n+m不等于p+q是可用于判断。
有非气体参加时
无论衡容还是恒压都可作为判断平衡的条件
3从内部压强判断
气压强与物质的量成正比则m+n=p+q不可作为判断依据n+m不等于p+q则可以用于判断。
化学平衡移动的判断
1;V平衡移动看反应速度,速度增大则反应向速度快的一方移动
2;T平衡移动看温度,温度升高则平衡向吸热反应方向移动,温度降低则反应向放热方向移动
3;K化学反应平衡移动看平衡常数。平衡常数增大说明反应进行的越完全,平衡性正反应方向进行。若平衡常数减小则平衡向逆反应方向进行
4;C平衡移动看浓度。反应物浓度减小则正反应速度减小平衡向正反应方向进行,反应物浓度升高则正反应速度增大,平衡向正反应方向移动。
5;P再有气体参加的反应中增大压强平衡向物质的量减小的方向移动,减小压强平衡向物质的量增大的方向移动。

等效平衡
恒温恒容时气体体积发生变化的反应,等价转换后各物质的物质的量和起始量相同时叫等效平衡。
恒温恒容时气体体积不发生变化的反应,等价转换后各物质的物质的量比例与起始是相同时为等效平衡
恒温恒压时气体等效转化后,只要反应物各物质的量和起始时成比例为等效平衡
如何利用等效平衡
1判断其各个物质的量
2判断反应进行方向
做题要点;等效平衡的等效转换
一般考察其比例关系要记住其比例关系解题,要找到比例关系答题。要摆出比例关系做题

例题;1升的容器中 甲加1mol的氮和1mol的氢气,乙加入2mol的氮气和2mol的氢气比较这两容器的反应速度,氮气的转化率,和平衡时氨气的浓度; 

图中可知相同的是第一横行,从第一横行到下一行是一样的过程故得从第一横行第2图到第二行是一个加压的过程正反应是气体体积减小的反应,则平衡向正反应方向移动。则答案为;乙中的速度快,乙中氮的转化率高,乙中氨其体积分数大
-
高中化学平衡归纳总结
高中化学平衡的归纳总结化学反应速率与化学平衡一、高考展望:化学反应速率和化学平衡理论的初步知识是中学化学的重要基本理论。从历年高考…
-
化学平衡知识点总结
化学平衡基础知识三化学平衡1可逆反应定义在同一条件下既能向正反应方向进行同时又能向逆反应方向进行的反应叫做可逆反应用代替可逆反应中…
-
化学平衡图像总结
化学平衡图像一化学平衡图象常见类型注意1首先要看清楚横轴和纵轴意义特别是纵轴表示转化率和表示反应物的百分含量情况就完全相反以及曲线…
-
化学反应速率、化学平衡知识点总结用
化学反应速率化学平衡知识点总结化学反应速率和平化学衡命题规律化学反应速率和化学平衡是高考的必考内容其主要命题内容有化学反应速率影响…
-
【人教版】高中化学选修4知识点总结:第二章化学反应速率和化学平衡
第二章化学反应速率和化学平衡一化学反应速率课标要求1掌握化学反应速率的含义及其计算2了解测定化学反应速率的实验方法要点精讲1化学反…
-
高中化学平衡归纳总结
高中化学平衡的归纳总结化学反应速率与化学平衡一、高考展望:化学反应速率和化学平衡理论的初步知识是中学化学的重要基本理论。从历年高考…
-
化学平衡专题总结
一、化学平衡状态的判断:具体表现为“一等六定”:一等:正逆反应速率相等;六定:①物质的量一定,②平衡浓度一定,③百分含量保持一定,…
-
高中化学平衡归纳总结
高中化学平衡的归纳总结化学反应速率与化学平衡一、高考展望:化学反应速率和化学平衡理论的初步知识是中学化学的重要基本理论。从历年高考…
-
高中化学选修4知识点归纳总结律
高中化学选修4知识点归纳总结第一章化学反应与能量一焓变反应热1反应热一定条件下一定物质的量的反应物之间完全反应所放出或吸收的热量2…
-
高中化学《化学平衡》知识点总结 新人教版选修4
安徽省安庆市第九中学高二化学化学平衡知识点总结新人教版选修4一1定义化学平衡状态一定条件下当一个可逆反应进行到正逆反应速率相等时更…