篇一 :高中化学除杂总结大全
除杂题除杂选择试剂的原则是:不增、不减、不繁。
气体的除杂(净化): 1. 气体除杂的原则: (1) 不引入新的杂质 (2) 不减少被净化气体的量 2. 气体的除杂方法:
注意的问题:
(1) 需净化的气体中含有多种杂质时,除杂顺序:一般先除去酸性气体,如:氯化氢气体,CO2、SO2等,水蒸气要在最
后除去。
(2)除杂选用方法时要保证杂质完全除掉,如:除CO2最好用NaOH不用Ca(OH)2溶液,因为Ca(OH)2是微溶物,石灰水中Ca(OH)2浓度小,吸收CO2不易完全。 (3)除杂装置与气体干燥相同。
典型例题
1. 填写实验报告
考点:物质的鉴别,物质的除杂问题。 (1)H2、CO2的化学性质。 (2)SO42-的特性。
评析:①利用H2、CO2的性质不同,加以鉴别。
如H2有还原性而CO2没有,将气体分别通入灼热的CuO加以鉴别。
CuO+H2Cu+H2O
或利用H2有可燃性而CO2不燃烧也不支持燃烧,将气体分别点燃加以鉴别。
或利用CO2的水溶液显酸性而H2难溶于水,将气体分别通入紫色石蕊试液加以鉴别。CO2使紫色石蕊试液变红而H2不能。
…… …… 余下全文
篇二 :高中化学除杂总结大全
除杂问题专题
除杂题除杂选择试剂的原则是:不增、不减、不繁。
气体的除杂(净化):气体除杂的原则: 不引入新的杂质 不减少被净化气体的量
注意的问题:
需净化的气体中含有多种杂质时,除杂顺序:一般先除去酸性气体,如:氯化氢气体,CO2、SO2等,水蒸气要在最后除去。
(2)除杂选用方法时要保证杂质完全除掉,如:除CO2最好用NaOH不用Ca(OH)2溶液,因为Ca(OH)2是微溶物,石灰水中Ca(OH)2浓度小,吸收CO2不易完全。
(3)除杂装置与气体干燥相同。
典型例题
1. 考点:物质的鉴别,物质的除杂问题。
(1)H2、CO2的化学性质。
(2)SO42-的特性。
评析:①利用H2、CO2的性质不同,加以鉴别。
如H2有还原性而CO2没有,将气体分别通入灼热的CuO加以鉴别。
CuO+H2Cu+H2O
或利用H2有可燃性而CO2不燃烧也不支持燃烧,将气体分别点燃加以鉴别。
或利用CO2的水溶液显酸性而H2难溶于水,将气体分别通入紫色石蕊试液加以鉴别。CO2使紫色石蕊试液变红而H2不能。
②属于除杂质问题,加入试剂或选用方法要符合三个原则:(1)试剂与杂质反应,且使杂质转化为难溶物质或气体而分离掉;(2)在除杂质过程中原物质的质量不减少;(3)不能引入新杂质。 在混合物中加入BaCl2,与H2SO4生成白色沉淀,过滤后将其除去,同时生成物是HCl,没有引入新的离子。
…… …… 余下全文
篇三 :高中化学除杂总结大全
除杂问题专题
除杂题除杂选择试剂的原则是:不增、不减、不繁。
气体的除杂(净化):
1. 气体除杂的原则:
(1) 不引入新的杂质
(2) 不减少被净化气体的量
注意的问题:
(1) 需净化的气体中含有多种杂质时,除杂顺序:一般先除去酸性气体,如:氯化氢气体,
CO2、SO2等,水蒸气要在最后除去。
(2)除杂选用方法时要保证杂质完全除掉,如:除CO2最好用NaOH不用Ca(OH)2溶液,
因为Ca(OH)2是微溶物,石灰水中Ca(OH)2浓度小,吸收CO2不易完全。
(3)除杂装置与气体干燥相同。 典型例题
1. 填写实验报告
考点:物质的鉴别,物质的除杂问题。 (1)H2、CO2的化学性质。 (2)SO42-的特性。 评析:①利用H2、CO2的性质不同,加以鉴别。 如H2有还原性而CO2没有,将气体分别通入灼热的CuO加以鉴别。
CuO+H
2Cu+H2O
或利用H2有可燃性而CO2不燃烧也不支持燃烧,将气体分别点燃加以鉴别。
或利用CO2的水溶液显酸性而H2难溶于水,将气体分别通入紫色石蕊试液
加以鉴别。CO2使紫色石蕊试液变红而H2不能。
…… …… 余下全文
篇四 :高中化学常见物质除杂方法归纳
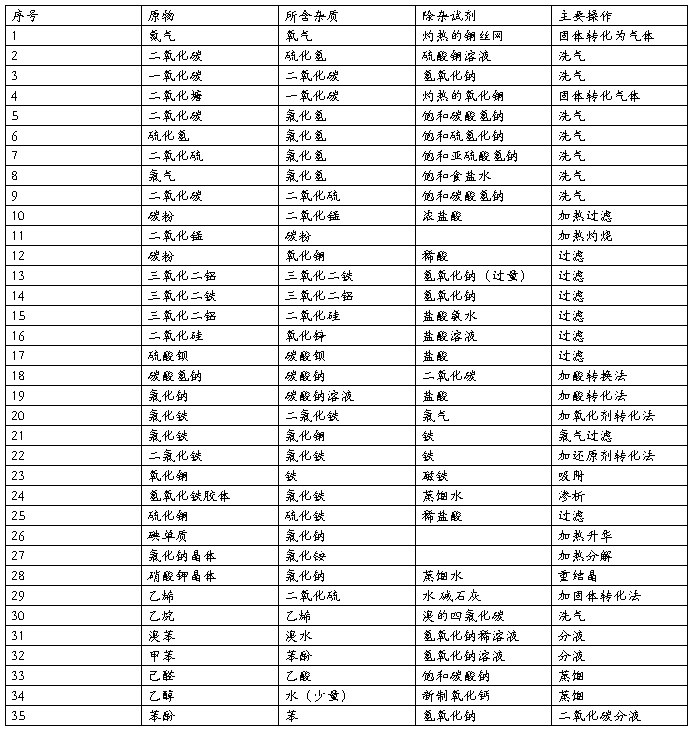
原物 所含杂质除杂质试剂 除杂质的方法
1 N2O2 灼热的铜丝网 洗气
2 CO2H2S硫酸铜溶液洗气
3 CO CO2石灰水或烧碱液 洗气
4 CO2HCl饱和小苏打溶液 洗气
5 H2SHCl饱和NaHS溶液 洗气
6 SO2HCl 饱和NaHSO3溶液 洗气
7 Cl2HCl饱和NaCl溶液 洗气
8 CO2 SO2饱和小苏打溶液 洗气
9 碳粉 MnO2浓盐酸 加热后过滤
10 MnO2 碳粉 ----------- 加热灼烧
11 碳粉CuO盐酸或硫酸 过滤
12 Al2O3Fe2O3NaOH溶液(过量),再通CO2过滤、加热固体
13 Fe2O3 Al2O3NaOH溶液 过滤
14 Al2O3 SiO2盐酸 NH3?H2O 过滤、加热固体
15 SiO2ZnO盐酸 过滤
16 CuOZnONaOH溶液 过滤
17 BaSO4BaCO3稀硫酸 过滤
18 NaOH Na2CO3Ba(OH)2溶液(适量) 过滤
19 NaHCO3Na2CO3通入过量CO2 ------
20 Na2CO3 NaHCO3 ------- 加热
21 NaClNaHCO3 盐酸 蒸发结晶
…… …… 余下全文
篇五 :高中化学除杂归纳
除去物质中少量杂质的过程叫做物质的提纯,简称除杂。此类习题的考察一直是高考实验的最爱。解答时应考虑物质的存在状态、被提纯物质与杂质间在物理和化学性质上的差异与联系,再选择操作简单、最佳方案和相应试剂进行提纯。本文拟从除杂的方法、程序和试剂的选择几方面,谈谈其中存在的规律,以助掌握除杂的试验方法。
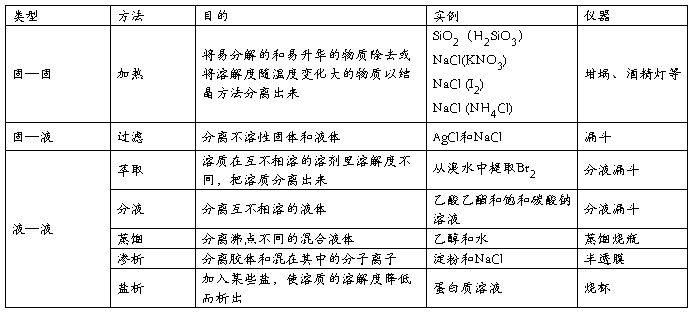
一.常见的物理分离和提纯方法
1. 基本类型
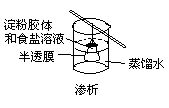
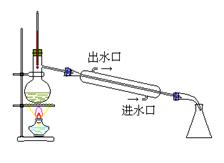
2.典型装置
过滤 分液 蒸发
蒸馏
二.化学分离提纯法 (1)基本原则
①化学方法除杂的方法关键是正确选择化学试剂。所选试剂一般只能与杂质反应,且杂质与试剂反应的生成物要跟被提纯物质易分离,而最佳试剂是将杂质转化为被提纯的物质。 ②除杂后的物质成分不变
③实验过程和操作方法简单易行 (2)基本方法
①吸收法:常用于气体的净化和干燥,可根据被提纯气体中所含杂质气体的性质,选择适当的固体或溶液作为吸收剂。如Cl2中混有HCl可通过饱和食盐水除去。常用装置是洗气瓶或干燥管(U形管)。
②气体法:根据物质中所含杂质的性质加入适当试剂,让杂质转化为气体除去。如KCl中混有少量的K2CO3,可加入适量的盐酸除去。
…… …… 余下全文
篇六 :高中化学常见的物质除杂表格总结 精编 带方程式
中学化学常见的物质除杂表格总结
将固体混合物溶于过量的氢氧化钠溶液,过滤除去氧化铁,留下滤液。 Al2O3+2OH-=2AlO2-+H2O
向滤液中通入过量的CO2,过滤得到Al(OH)3,3分解。 AlO2-+2H2O+CO2=Al(OH)3+HCO3- 2Al(OH)3====Al23+3H2O 方法二:
将固体混合物溶于过量的盐酸溶液中,是混合物完全溶解。 Al2O3+6H+=2Al3++3H2O Fe2O3+6H+=2Fe3++3H2O 2、加入过量NaOH溶液,过滤除去沉淀Fe(OH)3, Fe3++3OH-=Fe(OH)3 Al3++4OH-=AlO-+2H2O 3、向滤液中通入过量的CO2,过滤得到Al(OH)3,加热使Al(OH)3分解。AlO2-+2H2O+CO2=Al(OH)3+HCO3- 2Al(OH)3=Al2O3+3H2O 注:如果是Fe2O3(Al2O3)就直接加氢氧化钠啊!
…… …… 余下全文
篇七 :高中化学除杂归纳
高考化学实验热点——除杂问题小结
除去物质中少量杂质的过程叫做物质的提纯,简称除杂。此类习题的考察一直是高考实验的最爱。解答时应考虑物质的存在状态、被提纯物质与杂质间在物理和化学性质上的差异与联系,再选择操作简单、最佳方案和相应试剂进行提纯。本文拟从除杂的方法、程序和试剂的选择几方面,谈谈其中存在的规律,以助掌握除杂的试验方法。
一.常见的物理分离和提纯方法
基本类型
2.典型装置



过滤 分液 蒸发
 蒸馏
蒸馏
二.化学分离提纯法
…… …… 余下全文