必修3概率部分典型例题解析必修4知识点总结
必修3概率部分知识点总结及典型例题解析
u 事件包括随机事件和确定性事件。确定性事件即必然事件和不可能事件
v 随机事件的概率(统计定义):一般的,如果随机事件  在
在 次实验中发生了
次实验中发生了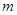 次,当实验的次数
次,当实验的次数 很大时,我们称事件A发生的概率为
很大时,我们称事件A发生的概率为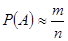
w概率的性质: 对任意的一个随机事件 ,有
,有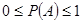

x 古典概率:必须满足两个条件① 所有基本事件有限个 ② 每个基本事件发生的可能性相等, 这样的概率模型称为古典概型
古典概型的概率公式:如果一次试验的等可能的基本事件的个数为个 ,则每一个基本事件发生的概率都是
,则每一个基本事件发生的概率都是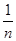 ,如果事件
,如果事件 包含了其中的
包含了其中的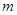 个等可能的基本事件,则事件
个等可能的基本事件,则事件 发生的概率为
发生的概率为 
y 几何概型:一般地,一个几何区域 中随机地取一点,记事件“改点落在其内部的一个区域
中随机地取一点,记事件“改点落在其内部的一个区域 内”为事件
内”为事件 ,则事件
,则事件 发生的概率为
发生的概率为
 ( 这里要求
( 这里要求 的侧度不为0,其中侧度的意义由
的侧度不为0,其中侧度的意义由 确定,一般地,线段的侧度为该线段的长度;平面多变形的侧度为该图形的面积;立体图像的侧度为其体积 )
确定,一般地,线段的侧度为该线段的长度;平面多变形的侧度为该图形的面积;立体图像的侧度为其体积 )
几何概型的基本特点:① 基本事件等可性 ② 基本事件无限多
几何概型与古典概型的区别?
z互斥事件:不能同时发生的两个事件称为互斥事件
对立事件:两个互斥事件中必有一个发生,则称两个事件为对立事件 ,事件 的对立事件 记为:
的对立事件 记为: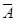 ,总有
,总有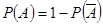
即对立事件的概率之和一定是1
而两个互斥事件的概率之和小于或者等于1
若事件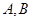 是互斥事件,则有
是互斥事件,则有
|例题选讲:
例1. 袋中有标号为1、2、3、4、5的5个球,从中随机取出两个球.
(1)写出所有的基本事件;(2)求所取出的两个球的标号之和大于5的概率.
【解析】(1)随机取两个球的基本事件为(1,2),(1,3),(1,4),(1,5),(2,3),(2,4),(2,5),(3,4),(3,5),(4,5).
(2)两球标号之和大于5的有(1,5),(2,4),(2,5),(3,4),(3,5),(4,5),共有6个,所以所求概率为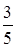 .
.
 例2. 急救飞机向一个边长为1千米的正方形急救区域空头急救物品,在该区域内有一个长宽分别为80米和50米的水池,当急救物品落在水池及距离水池10米的范围内时,物品会失效,假设急救物品落在正方形区域内的任意一点是随机的(不考虑落在正方形区域范围之外的),求发放急救物品无效的概率?
例2. 急救飞机向一个边长为1千米的正方形急救区域空头急救物品,在该区域内有一个长宽分别为80米和50米的水池,当急救物品落在水池及距离水池10米的范围内时,物品会失效,假设急救物品落在正方形区域内的任意一点是随机的(不考虑落在正方形区域范围之外的),求发放急救物品无效的概率?
【分析】为题属于几何概型,是平面图形,其测度用面积来衡量
解:如图,设急救物品投放的所有可能的区域,即边长为1千米的正方形为区域  ,事件“发放急救物品无效”为
,事件“发放急救物品无效”为 ,距离水池10米范围为区域
,距离水池10米范围为区域  ,即为图中的阴影部分, 则有
,即为图中的阴影部分, 则有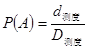

答:略
会面问题:甲乙两人约定在6时到7时在某地会面,并约定先到者等候另一人一刻钟,过时即可离去,求两人能会面的概率?
解:设“两人能会面”为事件 ,以 x和y分别表示
,以 x和y分别表示
 甲、乙两人到达约会地点的时间,则两人能够会面的充
甲、乙两人到达约会地点的时间,则两人能够会面的充
要条件为: 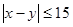 在平面上建立如图所示的
在平面上建立如图所示的
坐标系,则 的所有可能的结果是边长为60的
的所有可能的结果是边长为60的
正方形,而可能会面的时间由图中阴影部分所表示,
由几何概型知,
答:两人能会面的概率 .
.
 ◆课本上一道例题的变式训练:如图,在等腰直角三角形
◆课本上一道例题的变式训练:如图,在等腰直角三角形 中,在斜边
中,在斜边 上任取一点
上任取一点 ,求
,求 的概率?
的概率?
【分析】点 随机的落在线段
随机的落在线段 上,故线段
上,故线段 为区域
为区域
 ,当点
,当点 位于如图的
位于如图的 内时
内时 ,故线段
,故线段
 即为区域
即为区域
解: 在 上截取
上截取 ,于是
,于是

答: 的概率为
的概率为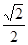
高一数学必修4知识要点
1、与角 终边相同的角的集合为
终边相同的角的集合为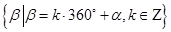
终边在 轴上的角的集合为
轴上的角的集合为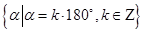
终边在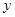 轴上的角的集合为
轴上的角的集合为
终边在坐标轴上的角的集合为
2、 弧度的角长度等于半径长的弧所对的圆心角叫做
弧度的角长度等于半径长的弧所对的圆心角叫做 弧度.所以半径为
弧度.所以半径为 的圆的圆心角
的圆的圆心角 所对弧的长为
所对弧的长为 ,则角
,则角 的弧度数的绝对值是
的弧度数的绝对值是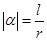 .
.
3、扇形的弧长公式、面积公式
若扇形的圆心角为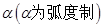 ,半径为
,半径为 ,弧长为
,弧长为 ,周长为
,周长为 ,面积为
,面积为 ,则弧长
,则弧长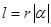 ,周长
,周长 ,
,
面积 .
.
4、三角函数定义:设 是一个任意大小的角,
是一个任意大小的角, 的终边上任意一点
的终边上任意一点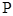 的坐标是
的坐标是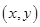 ,它与原点的距离是
,它与原点的距离是 ,则
,则 ,
, ,
,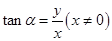 .
.
5、三角函数在各象限的符号:第一象限全为正,第二象限正弦为正,第三象限正切为正,第四象限余弦为正.
 11、三角函数线:
11、三角函数线: ,
, ,
,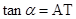 .
.
6、同角三角函数的基本关系:
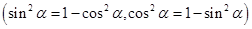 ;
;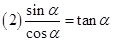
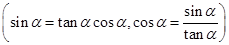
7、三角函数的诱导公式:
口诀:奇变偶不变,符号看象限.
8、图像变换
9、函数 的性质:
的性质:
①振幅: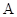 ;②周期:
;②周期: ;③频率:
;③频率: ;④相位:
;④相位: ;⑤初相:
;⑤初相: .
.
10、正弦、余弦和正切函数的图象与性质:(查课本)
11、向量有关概念
单位向量:长度等于 个单位的向量.
个单位的向量.
 平行向量(共线向量):方向相同或相反的非零向量.
平行向量(共线向量):方向相同或相反的非零向量.
零向量与任一向量平行.
相等向量:长度相等且方向相同的向量.
12、向量加减的几何运算:
⑴三角形法则的特点:首尾相连.即共起点,连终点,方向指向被减向量.

⑵平行四边形法则的特点:共起点.
13、共线向量定理:向量 与
与 共线,当且仅当有唯一一个实数
共线,当且仅当有唯一一个实数 ,使
,使 .
.
共线向量定理的坐标形式:设 ,
, ,其中
,其中 ,则当且仅当
,则当且仅当 时,向量
时,向量 、
、 共线.
共线.
14、平面向量基本定理:如果 、
、 是同一平面内的两个不共线向量,那么对于这一平面内的任意向量
是同一平面内的两个不共线向量,那么对于这一平面内的任意向量 ,有且只有一对实数
,有且只有一对实数 、
、 ,使
,使 .(不共线的向量
.(不共线的向量 、
、 作为这一平面内所有向量的一组基底)
作为这一平面内所有向量的一组基底)
15、平面向量的数量积:
⑴定义: .零向量与任一向量的数量积为
.零向量与任一向量的数量积为 .
.
⑵向量垂直的充要条件: .
.
16、平面向量的数量积的坐标运算:设两个非零向量 ,
, ,则
,则 .
.
若 ,则
,则 ,或
,或 .
.
设 ,
, ,则
,则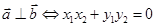 .
.
17、平面向量的夹角:设 、
、 都是非零向量,
都是非零向量, ,
, ,
,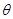 是
是 与
与 的夹角,则
的夹角,则 .
.
范围是
18、两角和与差的正弦、余弦和正切公式:
⑴ ;
;
⑵ ;
;
⑶ ;
;
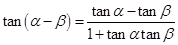 ⑷
⑷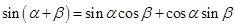 ;
;
 ⑸(
⑸( );
);
⑹(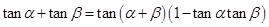 ).
).
19、二倍角的正弦、余弦和正切公式:
⑴ .
.
⑵ .
.
⑶ .
.
20、合角公式(两角和与差的正弦、余弦和正切公式的变形)
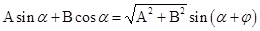 ,其中
,其中 .
.
21、降幂公式(二倍角的余弦公式的变形): ,
,
第二篇:分析化学部分知识点总结
部分知识点总结
一、 颜色
铁:铁粉是黑色的;一整块的固体铁是银白色的。 Fe2+——浅绿色 Fe3O4——黑色晶体 Fe(OH)2——白色沉淀 Fe3+——黄色 Fe (OH)3——红褐色沉淀 Fe (SCN)3——血红色溶液
FeO——黑色的粉末 Fe (NH4)2(SO4)2——淡蓝绿色 Fe2O3——红棕色粉末 FeS——黑色固体
铜:单质是紫红色 Cu2+——蓝色 CuO——黑色 Cu2O——红色 CuSO4(无水)—白色 CuSO4·5H2O——蓝色 Cu2 (OH)2CO3 —绿色 Cu(OH)2——蓝色
[Cu(NH3)4]SO4——深蓝色溶液
BaSO4 、BaCO3 、Ag2CO3 、CaCO3 、AgCl 、 Mg (OH)2 、三溴苯酚均是白色沉淀 Al(OH)3 白色絮状沉淀 H4SiO4(原硅酸)白色胶状沉淀
Cl2、氯水——黄绿色 F2——淡黄绿色气体 Br2——深红棕色液体 I2——紫黑色固体 HF、HCl、HBr、HI均为无色气体,在空气中均形成白雾
CCl4——无色的液体,密度大于水,与水不互溶 KMnO4--——紫色 MnO4-——紫色 Na2O2—淡黄色固体 Ag3PO4—黄色沉淀 S—黄色固体 AgBr—浅黄色沉淀 AgI—黄色沉淀 O3—淡蓝色气体 SO2—无色,有剌激性气味、有毒的气体 SO3—无色固体(沸点44.8 0C) 品红溶液——红色 氢氟酸:HF——腐蚀玻璃 N2O4、NO——无色气体 NO2——红棕色气体 NH3——无色、有剌激性气味气体 有色溶液:Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、MnO4-(紫色)
有色固体:红色(Cu、Cu2O、Fe2O3)、红褐色[Fe(OH)3] 黑色(CuO、FeO、FeS、CuS、Ag2S、PbS)
蓝色[Cu(OH)2] 黄色(AgI、Ag3PO4) 白色[Fe(0H)2、CaCO3、BaSO4、AgCl、BaSO3]
有色气体:Cl2(黄绿色)、NO2(红棕色)
二
能发生银镜反应的有:醛、甲酸、甲酸盐、甲酰铵(HCNH2O)、葡萄溏、果糖、麦芽糖,均可发生
银镜反应。(也可同Cu(OH)2反应) 计算时的关系式一般为:—CHO —— 2Ag 注意:当银氨溶液足量时,甲醛的氧化特殊: HCHO —— 4Ag ↓ + H2CO3 反应式为:HCHO +4[Ag(NH3)2]OH = (NH4)2CO3 + 4Ag↓ + 6NH3 ↑+ 2H2O 能够做喷泉实验的气体
1、NH3、HCl、HBr、HI等极易溶于水的气体均可做喷泉实验。
2、CO2、Cl2、SO2与氢氧化钠溶液; 3、C2H2、C2H2与溴水反应
十六、“10电子”、“18电子”的微粒小结
1.
2.“18
262526滴加顺序不同,现象不同
1.AgNO3与NH3·H2O:
AgNO3向NH3·H2O中滴加——开始无白色沉淀,后产生白色沉淀
NH3·H2O向AgNO3中滴加——开始有白色沉淀,后白色沉淀消失
2.NaOH与AlCl3:
NaOH向AlCl3中滴加——开始有白色沉淀,后白色沉淀消失
AlCl3向NaOH中滴加——开始无白色沉淀,后产生白色沉淀
3.HCl与NaAlO2:
HCl向NaAlO2中滴加——开始有白色沉淀,后白色沉淀消失
NaAlO2向HCl中滴加——开始无白色沉淀,后产生白色沉淀
4.Na2CO3与盐酸:
Na2CO3向盐酸中滴加——开始有气泡,后不产生气泡
盐酸向Na2CO3中滴加——开始无气泡,后产生气泡
规律性的知识归纳
1、能与氢气加成的:苯环结构、C=C 、 C C 、C=O 。
O 和 OH 中的C=O双键不发生加成)
OH2、能与NaOH反应的:—COOH 、 O 。 3、能与NaHCO3反应的:OH—COOH
4、能与Na反应的:—COOH、 、 -OH 5、能发生加聚反应的物质 烯烃、二烯烃、乙炔、苯乙烯、烯烃和二烯烃的衍生物。
6、能发生银镜反应的物质 凡是分子中有醛基(-CHO)的物质均能发生银镜反应。
(1)所有的醛(R-CHO); (2)甲酸、甲酸盐、甲酸某酯;
注:能和新制Cu(OH)2反应的——除以上物质外,还有酸性较强的酸(如甲酸、乙酸、丙
酸、盐酸、硫酸、氢氟酸等),发生中和反应。
7、能与溴水反应而使溴水褪色或变色的物质
有机:
1.不饱和烃(烯烃、炔烃、二烯烃、苯乙烯等);
2.不饱和烃的衍生物(烯醇、烯醛、油酸、油酸盐、油酸某酯、油等)
3.石油产品(裂化气、裂解气、裂化汽油等);
4.苯酚及其同系物(因为能与溴水取代而生成三溴酚类沉淀)
5.含醛基的化合物
6.天然橡胶(聚异戊二烯) CH2=CH-C=CH2
CH3
有机物燃烧通式
烃: CxHy+(x+yy)O2 ? xCO2+H2O 42
烃的含氧衍生物: CxHyOz+(x+zyy-)O2 ? xCO2+H2O 422
有机合成路线:
有机化学知识点总结
1.需水浴加热的反应有:
(1)、银镜反应(2)、乙酸乙酯的水解(3)苯的硝化(4)糖的水解
(5)、酚醛树脂的制取(6)固体溶解度的测定
2.需用温度计的实验有:
(1)、实验室制乙烯(170℃) (2)、蒸馏 (3)、固体溶解度的测定
(4)、乙酸乙酯的水解(70-80℃) (5)、中和热的测定
(6)制硝基苯(50-60℃)甲烷:无色 无味 难溶
乙烯:无色 稍有气味 难溶
乙炔:无色 无味 微溶
(电石生成:含H2S、PH3 特殊难闻的臭味)
苯:无色 有特殊气味 液体 难溶 有毒
乙醇:无色 有特殊香味 混溶 易挥发
乙酸:无色 刺激性气味 易溶 能挥发
甲烷:CH3COONa + NaOH →(CaO,加热) → CH4↑+Na2CO3
注:无水醋酸钠:碱石灰=1:3 固固加热 (同O2、NH3)
无水(不能用NaAc晶体) CaO:吸水、稀释NaOH、不是催化剂 乙烯:C2H5OH →(浓H2SO4,170℃)→ CH2=CH2↑+H2O
注:V酒精:V浓硫酸=1:3(被脱水,混合液呈棕色)排水收集(同Cl2、HCl)控温170℃(140℃:乙醚)碱石灰除杂SO2、CO2 碎瓷片:防止暴沸
乙炔:CaC2 + 2H2O → C2H2↑ + Ca(OH)2
注:排水收集 无除杂 不能用启普发生器 饱和NaCl:降低反应速率
导管口放棉花:防止微溶的Ca(OH)2泡沫堵塞导管
有机酸酸性的强弱:乙二酸 >甲酸 >苯甲酸 >乙酸 >碳酸 >苯酚 >HCO3- 有机鉴别时,注意用到水和溴水这二种物质。
例:鉴别:乙酸乙酯(不溶于水,浮)、溴苯(不溶于水,沉)、乙醛(与水互溶),则可用水。
取代反应包括:卤代、硝化、磺化、卤代烃水解、酯的水解、酯化反应等; 乙醇:CH2=CH2 + H2O →(催化剂,加热,加压)→CH3CH2OH
(话说我不知道这是工业还实验室。。。)
注:无水CuSO4验水(白→蓝) 提升浓度:加CaO 再加热蒸馏
四、酸性KMnO4&溴水
烷:都不褪色
烯 炔:都褪色(前者氧化 后者加成)
苯:KMnO4不褪色 萃取使溴水褪色
化学方程式
3Cl2(过量)+2KI+3H2O===6HCl+KIO3
–––3Cl2+I+3H2O=6H++6Cl+IO3
5Cl2+I2+6H2O===2HIO3+10HCl
––5Cl2+I2+6H2O=10Cl+IO3+12H+
Cl2+SO2+2H2O===H2SO4+2HCl
Cl2+SO2+2H2O=4H++SO42+2Cl––
Cl2+Na2S===2NaCl+S↓ Cl2+S2=2Cl+S↓
–Cl2+H2S===2HCl+S↓ (水溶液中:Cl2+H2S=2H++2Cl+S↓ ––
S+6HNO3(浓)H2SO4+6NO2↑+2H2O
2-S+4H++6==6NO2↑+2H2O+SO4
3S+4HNO3(稀)
?3S+4H++4NO3
3SO2+4NO↑+2H2O 3SO2+4NO↑+2H2O
Al2O3+2Fe 2Al+3FeOAl2O3+3Fe 2Al+Fe2O3
2Al+6HCl===2AlCl3+3H2↑ 2Al+6H+=2Al3++3H2↑
2Al+3H2SO4===Al2(SO4)3+3H2↑ 2Al+6H+=2Al3++3H2↑
2Al+6H2SO4(浓)===Al2(SO4)3+3SO2+6H2O (Al,Fe在冷,浓的H2SO4,HNO3中钝化)
–Al+4HNO3(稀)===Al(NO3)3+NO↑+2H2O Al+4H++NO3=Al3++NO↑+2H2O
––2Al+2NaOH+2H2O===2NaAlO2+3H2↑ 2Al+2OH+2H2O=2AlO2+3H2↑
16HCl+2KMnO4===2KCl+2MnCl2+5Cl2↑+8H2O
-– 16 H++10Cl+2MnO4=2Mn2++5Cl2↑+8H2O
6HCl+KClO3==KCl+3Cl2↑+3H2O
––6H++5Cl+ClO3=3Cl2↑+3H2O
14HCl+K2Cr2O7===2KCl+2CrCl3+3Cl2↑+7H2O
––14H++6Cl+Cr2O72=2Cr3++5Cl2↑+7H2O
3NaAlO2+AlCl3+6H2O==4Al(OH)3↓+3NaCl (物质之间的双水解反应)
- 3AlO2+Al3++6H2O=4Al(OH)3↓
3NaAlO2+FeCl3+6H2O==3Al(OH)3↓+Fe(OH)3↓+3NaCl
- 3AlO2+Fe3++6H2O=3Al(OH)3↓+Fe(OH)3↓ NaAlO2+NH4Cl+2H2O==Al(OH)3↓+NH3·H2O+NaCl
- AlO2+NH4++2H2O=Al(OH)3↓+NH3·H2O 取代(水解)【NaOH水溶液】
消去【NaOH醇溶液】
通式
CnH2n+2 烷烃
CnH2n 烯烃 / 环烷烃
CnH2n-2 炔烃 / 二烯烃
CnH2n-6 苯及其同系物
CnH2n+2O 一元醇 / 烷基醚
CnH2nO 饱和一元醛 / 酮
CnH2n-6O 芳香醇 / 酚
CnH2nO2 羧酸 / 酯
不饱和度=(C原子数×2+2 – H原子数)/ 2 烷基不属于官能团
-
特殊的平行四边形知识点总结
矩形:有一个角是直角的平行四边形叫做矩形,也说是长方形矩形的性质:矩形的四个角都是直角;矩形的对角线相等矩形的对角线相等且互相平分…
-
初中数学四边形知识点总结大全
四边形知识点总结大全一基本概念:四边形,四边形的内角,四边形的外角,多边形,平行线间的距离,平行四边形,矩形,菱形,正方形,中心对…
-
新课标人教版八年级数学第十九章四边形知识点总结
新课标人教版八年级数学知识点总结第十九章四边形一、平行四边形:㈠.平行四边形定义:有两组对边分别平行的四边形叫做平行四边形。㈡.平…
-
四边形的知识点总结
(一)平行四边形的定义、性质及判定.1.两组对边平行的四边形是平行四边形.2.性质:(1)平行四边形的对边相等且平行;(2)平行四…
-
计算机二级考试C语言知识点总结
总体上必须清楚的:1)程序结构是三种:顺序结构,循环结构(三个循环结构),选择结构(if和switch)2)读程序都要从main(…
-
导数及其应用 知识点总结
1、函数f?x?从x1到x2的平均变化率:f?x2??f?x1?x2?x1x?x0f(x0??x)?f(x0)?x2、导数定义:f…
-
1、20xx高考文科数学:导数知识点总结
、20xx高考文科数学:导数知识点总结(4)(cosx)???sinx.(5)(lnx)??'''exxxxx;(loga)??l…
-
导数复习知识点总结
导数知识点一、导数相关概念1.导数?y?y=f(x0+?x)-f(x0)函数y=f(x),如果自变量x在x0处有增量?x,那么函数…
-
高中数学人教版选修2-2导数及其应用知识点总结
数学选修2-2导数及其应用知识点必记1.函数的平均变化率是什么?答:平均变化率为f(x2)?f(x1)f(x1??x)?f(x1)…
-
7整式的乘除与因式分解知识点总结
戴氏教育开县校区年级:初二上册教师:张苏整式的乘除与因式分解知识点总结1、单项式的概念:由数与字母的乘积构成的代数式叫做单项式。单…
-
20xx年投资软环境工作总结
在县委、县政府的正确领导下,立足机关作风转变、行政审批制度改革,以强化内部管理和优化对外服务为重点,采取措施,加大力度,有效地推进…