高中化学常用公式总结
高中化学常用公式总结
1. 有关物质的量(mol)的计算公式
(1)物质的量(mol)
(2)物质的量(mol)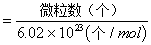
(3)气体物质的量(mol)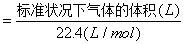
(4)溶质的物质的量(mol)=物质的量浓度(mol/L)×溶液体积(L)
2. 有关溶液的计算公式
(1)基本公式
①溶液密度(g/mL)
②溶质的质量分数
③物质的量浓度(mol/L)
(2)溶质的质量分数、溶质的物质的量浓度及溶液密度之间的关系:
①溶质的质量分数
②物质的量浓度
(3)溶液的稀释与浓缩(各种物理量的单位必须一致):
①浓溶液的质量×浓溶液溶质的质量分数=稀溶液的质量×稀溶液溶质的质量分数(即溶质的质量不变)
②浓溶液的体积×浓溶液物质的量浓度=稀溶液的体积×稀溶液物质的量浓度[即c(浓)·V(浓)=c(稀)·V(稀)]
(4)任何一种电解质溶液中:阳离子所带的正电荷总数=阴离子所带的负电荷总数(即整个溶液呈电中性)
3. 有关溶解度的计算公式(溶质为不含结晶水的固体)
(1)基本公式:
①
②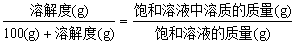
(2)相同温度下,溶解度(S)与饱和溶液中溶质的质量分数(w%)的关系:


(3)温度不变,蒸发饱和溶液中的溶剂(水),析出晶体的质量m的计算:

(4)降低热饱和溶液的温度,析出晶体的质量m的计算:

4. 平均摩尔质量或平均式量的计算公式
(1)已知混合物的总质量m(混)和总物质的量n(混):
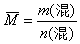
说明:这种求混合物平均摩尔质量的方法,不仅适用于气体,而且对固体或液体也同样适用。
(2)已知标准状况下,混合气体的密度 (混):
(混):
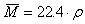 (混)
(混)
注意:该方法只适用于处于标准状况下(0℃, )的混合气体。
)的混合气体。
(3)已知同温、同压下,混合气体的密度与另一气体A的密度之比D(通常称作相对密度):

则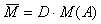
5. 化学反应速率的计算公式
(1)某物质X的化学反应速率:
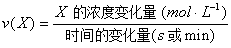
(2)对于下列反应:
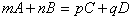
有
或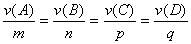
6. 化学平衡计算公式
对于可逆反应:
(1)各物质的变化量之比=方程式中相应系数比
(2)反应物的平衡量=起始量-消耗量
生成物的平衡量=起始量+增加量
表示为(设反应正向进行):
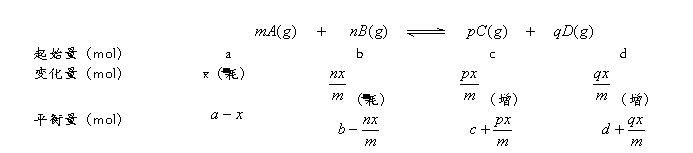
(3)反应达平衡时,反应物A(或B)的平衡转化率(%)

说明:计算式中反应物各个量的单位可以是mol/L、mol,对于气体来说还可以是L或mL,但必须注意保持分子、分母中单位的一致性。
(4)阿伏加德罗定律及阿伏加德罗定律的三个重要推论。
①恒温、恒容时: ,即任何时刻反应混合气体的总压强与其总物质的量成正比。
,即任何时刻反应混合气体的总压强与其总物质的量成正比。
②恒温、恒压时: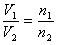 ,即任何时刻反应混合气体的总体积与其总物质的量成正比。
,即任何时刻反应混合气体的总体积与其总物质的量成正比。
③恒温、恒容时: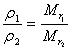 ,即任何时刻反应混合气体的密度与其反应混合气体的平均相对分子质量成正比。
,即任何时刻反应混合气体的密度与其反应混合气体的平均相对分子质量成正比。
(5)混合气体的密度
(6)混合气体的平均相对分子质量 的计算。
的计算。
①
其中M(A)、M(B)……分别是气体A、B……的相对分子质量;a%、b%……分别是气体A、B……的体积(或摩尔)分数。
②
7. 溶液的pH值计算公式
(1)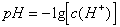
若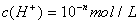 ,则
,则
若 ,则
,则
(2)任何水溶液中,由水电离产生的 与
与 总是相等的,即:
总是相等的,即:

(3)常温(25℃)时:
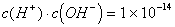
(4)n元强酸溶液中 ;n元强碱溶液中
;n元强碱溶液中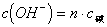
8. 有关物质结构,元素周期律的计算公式
8.1 原子核电荷数、核内质子数及核外电子数的关系
核电荷数=核内质子数=原子核外电子数
注意:阴离子:核外电子数=质子数+所带的电荷数
阳离子:核外电子数=质子数-所带的电荷数
8.2 质量数(A)、质子数(Z)、中子数(N)的关系

8.3 元素化合价与元素在周期表中的位置关系
(1)对于非金属元素:最高正价+|最低负价|=8(对于氢元素,负价为-1,正价为+1)。
(2)主族元素的最高价=主族序数=主族元素的最外层电子数。
9. 烃的分子式的确定方法
(1)先求烃的最简式和相对分子质量,再依(最简式相对分子质量)n=相对分子质量,求得分子式。
(2)商余法: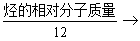 商为C原子数,余数为H原子数。
商为C原子数,余数为H原子数。
注意:一个C原子的质量=12个H原子的质量
10. 依含氧衍生物的相对分子质量求算其分子式的方法
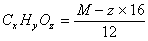 ,所得的商为x,余数为y。
,所得的商为x,余数为y。
注意:1个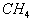 原子团的式量=1个O原子的相对原子质量=16
原子团的式量=1个O原子的相对原子质量=16

第二篇:高中化学常用公式系统总结
高中化学常用公式
1. 有关物质的量(mol)的计算公式 (1)物质的量(mol)?
物质的质量?g?物质的摩尔质量(g/mol)
微粒数(个)
(2)物质的量(mol)?
6.02?1023?个/mol?
(3)气体物质的量(mol)?
标准状况下气体的体积(L)
22.4(L/mol)
(4)溶质的物质的量(mol)=物质的量浓度(mol/L)×溶液体积(L)
2. 有关溶液的计算公式 (1)基本公式 ①溶液密度(g/mL)?
溶液质量(g)溶液体积(mL)
②溶质的质量分数?
溶质质量(g)
?溶质质量?溶剂质量?(g)
溶液体积(L)
?100%
③物质的量浓度(mol/L)?
溶质物质的量(mol)
(2)溶质的质量分数、溶质的物质的量浓度及溶液密度之间的关系: ①溶质的质量分数?
物质的量浓度(mol/L)?1(L)?溶质的摩尔质量(g/mol)
1000(mL)?溶液密度(g/mL)
?100%
②物质的量浓度?
1000(mL)?溶液密度(g/mL)?溶质的质量分数
溶质摩尔质量(g/mol)?1(L)
(3)溶液的稀释与浓缩(各种物理量的单位必须一致):
①浓溶液的质量×浓溶液溶质的质量分数=稀溶液的质量×稀溶液溶质的质量分数(即溶质的质量不变)
②浓溶液的体积×浓溶液物质的量浓度=稀溶液的体积×稀溶液物质的量浓度[即c(浓)·V(浓)=c(稀)·V(稀)] (4)任何一种电解质溶液中:阳离子所带的正电荷总数=阴离子所带的负电荷总数(即整个溶液呈电中性)
3. 有关溶解度的计算公式(溶质为不含结晶水的固体) (1)基本公式:
①
溶解度(g)100(g)
?
饱和溶液中溶质的质量(g)
溶剂质量(g)
②
溶解度(g)100(g)?溶解度(g)
?
饱和溶液中溶质的质量(g)
饱和溶液的质量(g)
(2)相同温度下,溶解度(S)与饱和溶液中溶质的质量分数(w%)的关系: S(g)?
w(g)
?100(g)
(100?w)(g)
w%?
S(g)
?100%
(100?S)(g)
(3)温度不变,蒸发饱和溶液中的溶剂(水),析出晶体的质量m的计算: m?
溶解度(g)
100(g)
?蒸发溶剂(水)的质量(g)
(4)降低热饱和溶液的温度,析出晶体的质量m的计算: m?
?高温溶解度?低温溶解度?
?高温原溶液质量(g)
?100?高温溶解度?(g)
4. 平均摩尔质量或平均式量的计算公式
(1)已知混合物的总质量m(混)和总物质的量n(混): ?
m(混)
n(混)
说明:这种求混合物平均摩尔质量的方法,不仅适用于气体,而且对固体或液体也同样适用。
(2)已知标准状况下,混合气体的密度?(混): ?22.4??(混)
注意:该方法只适用于处于标准状况下(0℃,101.?10Pa)的混合气体。 (3)已知同温、同压下,混合气体的密度与另一气体A的密度之比D(通常称作相对密度): D?
5
?(混)m(A)
?
?(A)n(A)
则?D?M(A)
5. 化学反应速率的计算公式
(1)某物质X的化学反应速率:
X的浓度变化量(mol?L?1)
v(X)?
时间的变化(量或smin)
(2)对于下列反应:
mA?nB?pC?qD
有v(A):v(B):v(C):v(D)?m:n:p:q 或
v(A)v(B)v(C)v(D)
???
mnpq
6. 化学平衡计算公式 对于可逆反应:
(1)各物质的变化量之比=方程式中相应系数比 (2)反应物的平衡量=起始量-消耗量 生成物的平衡量=起始量+增加量 表示为(设反应正向进行):
a b 起始量(mol)
nx变化量(mol) x(耗)
(耗)
c
d
m
平衡量(mol)
a?x
b?
nx m
px
(增) m
px c?mqx
(增) m
qx d?m
(3)反应达平衡时,反应物A(或B)的平衡转化率(%)
?
A(或B)的消耗浓度?mol/L?A(或B)的起始浓度?mol/L?
?100%?100%
?100%
?
?
A(或B)消耗的物质的量?mol?A(或B)起始的物质的量?mol?
气体A(或B)的消耗体积(mL或L)气体A(或B)的起始体积(mL或L)
说明:计算式中反应物各个量的单位可以是mol/L、mol,对于气体来说还可以是L或
mL,但必须注意保持分子、分母中单位的一致性。
(4)阿伏加德罗定律及阿伏加德罗定律的三个重要推论。 ①恒温、恒容时:比。
②恒温、恒压时:比。
p1n1
?,即任何时刻反应混合气体的总压强与其总物质的量成正p2n2
V1n1
?,即任何时刻反应混合气体的总体积与其总物质的量成正V2n2
Mr?1? ③恒温、恒容时:,即任何时刻反应混合气体的密度与其反应混合气体的?2Mr
12
平均相对分子质量成正比。 (5)混合气体的密度?混?
混合气体的总质量m(总)
容器的体积V
(6)混合气体的平均相对分子质量Mr的计算。 ①Mr?M(A)?a%?M(B)?b%?…
其中M(A)、M(B)……分别是气体A、B……的相对分子质量;a%、b%……分别是气体A、B……的体积(或摩尔)分数。 ②Mr?
混合气体的总质量(g)混合气体总物质的量(mol)
7. 溶液的pH值计算公式 (1)pH??lgc(H)
若c(H)?10mol/L,则pH?n
若c(H)?m?10mol/L,则pH?n?lgm
?
(2)任何水溶液中,由水电离产生的c(H)与cOH
?
?
?
?
?
??n
??n
?
?
?总是相等的,即:
c水(H)?c水(OH) (3)常温(25℃)时: c(H)?cOH
?
?
?
??1?10
?14
(4)n元强酸溶液中c(H)?n?c酸;n元强碱溶液中cOH
?
?
?
??n?c
碱
8. 有关物质结构,元素周期律的计算公式
8.1 原子核电荷数、核内质子数及核外电子数的关系 核电荷数=核内质子数=原子核外电子数
注意:阴离子:核外电子数=质子数+所带的电荷数 阳离子:核外电子数=质子数-所带的电荷数 8.2 质量数(A)、质子数(Z)、中子数(N)的关系 A?Z?N
8.3 元素化合价与元素在周期表中的位置关系
(1)对于非金属元素:最高正价+|最低负价|=8(对于氢元素,负价为-1,正价为+1)。
(2)主族元素的最高价=主族序数=主族元素的最外层电子数。
9. 烃的分子式的确定方法 (1)先求烃的最简式和相对分子质量,再依(最简式相对分子质量)n=相对分子质量,求得分子式。
烃的相对分子质量
(2)商余法:?商为C原子数,余数为H原子数。
12
注意:一个C原子的质量=12个H原子的质量
10. 依含氧衍生物的相对分子质量求算其分子式的方法 CxHyOz?
M?z?16
,所得的商为x,余数为y。
12
注意:1个CH4原子团的式量=1个O原子的相对原子质量=16
?除尽……酚(商为碳原子数)
M?10? ?余6……醛(商为碳原子数)
14?
?余8……醇或羧酸(羧酸比商少一个碳原子)
第三篇:个人学习和工作情况总结
大学四年,于我而言是人生中非常重要的四年。在领导的关心和照顾下,我不断进步成长,在学习,工作,生活中都收获颇丰。现将我大学四年的学习和工作总结如下。
学习方面
我深知21世纪是知识爆炸的时代,知识改变命运,因此,我从未放松过自己对学习的要求。在学习上,我不断提高自己的学习自制力和自主性,使自己无论处于什么环境,都能拒绝诱惑,积极认真地投入到学习中。我也非常注重学习经验和方法的总结。我认为好的方法可以帮助我们达到事半功倍的效果。所以,我在时间的安排上遵循科学规律,使学习达到效率最大化。大学是富含学习资源的地方,所以我积极阅读涉猎知识,扩大自己的知识面。我坚持独立思考,提高自己的逻辑思维能力,这可以让我们受用一生。
正是凭借这这份对学习的热爱与认真,我大学四年都获得了优异的学习成绩。平均绩点在3.5以上。20xx~20xx学年度,我获得了校级二等奖学金 及“三好学生”称号。20xx~20xx学年度,我获得了“学习优秀生”称号。在英语氛围不浓的生物专业背景下,我通过自己的努力,过了大学英语六级。生命不息,学习不止。
工作方面
从大一刚进大学校园,我便积极投入到校园工作中。很荣幸地,我被吸收成为系文娱部的一名干事。从此开始了我长达三年的学生会工作历程。20xx年,我参与部长竞选,成为了系文娱部部长,组织构建部门文化,培训指导部门成员,多次组织系内大小型文艺汇演活动,歌唱比赛,舞蹈比赛等,丰富同学们的课余生活。这极大地培养和提高了我的组织能力,创新能力及独立思考的能力。
20xx年x月,我从多个竞选者中脱颖而出,成为我系学生会团总支书记。除了协助辅导员完成各类通知和工作的上传下达,我还积极协调学生会各部门的关系,加强部门与部门间的合作与交流,提升学生会的整体凝聚力和集体荣誉感。
除了学生会的职务,我还是班里的一名班干部。20xx年,在同学们的推选下,我成为了班里的文娱委员,负责班级里的文娱活动,策划并组织班级出游活动、各类知识技能竞赛;参与班级综合测评工作,和其他班干部良好互动,共同提高班级凝聚力。
大学四年,我既努力让自己成为一名优秀大学生,也不断尝试走出校园,体验社会带给我们的洗礼。这其中,包括各种志愿者工作,学校实习和支教工作。
20xx年的广东省运动会和20xx年的世界大学生运动会,我都是大学生志愿者中的一员。在志愿者的队伍中,我兢兢业业,认真负责地做好自己岗位上的事情,也因此,我被评为“省运会优秀志愿者”和“大运会优秀志愿者”称号。我将会坚定不移地走在志愿者的道路上,用自己的微薄之力帮助他人。
20xx年,我积极参与学校发起的义教活动,深入偏远地区的小学进行教学。尽管每个星期都要走一段很长很长的路去上课,但内心是快乐充实的,没有什么比看到小孩的笑脸更让人满足的了!
20xx年,我有幸成为一名生物实习教师。我认真向富有教学经验的教师学习,请教,他们也非常乐意地为我指点,传授教学经验。尽管只有短短的两个月,但我的教学技能和教学理论水平都得到了极大的提高!我希望,在教育领域,我可以越走越远,越走越宽广!
思想方面
在思想政治方面,我认真学习贯彻“三个代表”重要思想,坚定不移拥护中国共产党,努力提高思想政治觉悟以及自身修养。20xx年x月,经过一年的考核期,我成为了一名正式党员,从此,我以更高的标准要求自己,时刻提醒自己作为一名党员该有的素养。
以上是我对自己大学四年基本情况的总结。在这即将毕业的时刻,我要以崭新的姿态,走进明天,走向未来!
总结者:
年月日
-
个人学习和工作情况总结
大学四年,于我而言是人生中非常重要的四年。在领导的关心和照顾下,我不断进步成长,在学习,工作,生活中都收获颇丰。现将我大学四年的学…
-
大一学习总结
春去秋来,日复一日,大一学年生活,虽然短暂,但我过得充实而快乐。转眼间,在大学已经呆了一年多了。记得刚进大学时对大学充满了各种憧憬…
-
学习总结
无人旋翼机学习总结第一部分笔记整理无人机基础知识固定翼固定翼机英文Fixedwingaircraft泛指比空气重有动力装置驱动机翼…
-
个人学习总结
我是20xx春乡镇企业管理专业的一名学生,在平湖电大三年的学习时间即将结束。在这里学习的学生基本上都是利用业余时间来进修的,每天除…
-
学习总结
20xx年高考一轮研讨学习总结与反思一瞠目结舌的变局我称之为瞠目结舌或许带有强烈的个人感情色彩但是对突然要面对20xx年全新的高考…
-
高二下学期期中总结家长会班主任发言稿
高二(1)班班主任发言稿班主任:王伟各位家长:首先我代表所有任课老师向各位家长的到来表示热烈的欢迎和衷心的感谢。今天你们能够在百忙…
-
周强个人工作总结
个人年终工作总结额苏木党政助理周强(二○一一年十二月二十四日)20xx年x月,我被分配到额仁淖尔苏木工作,任党政办助理。在参加工作…
-
校领导小组听课总结
为了解、检查我校教师的授课情况,并对每位教师的授课质量作出实事求是的评价,学校领导小组自2xx年x月x日起,分两组对我校的任课教师…
-
20xx年度工作总结
今年以来,在大队行政及党支部的正确领导下,紧紧围绕大队“1136”工作目标,结合单位实际,深入贯彻学习实践科学发展观活动,确定以“…
-
见习期个人园林工作总结
实习个人总结自从我七月份报到到现在,已有近一年时间。期间,在各位前辈和师傅们的指导下,在领导及同事们的帮助下,通过自身的坚持不懈的…