高中选修4 电化学基础知识点总结
电化学基础知识点总结
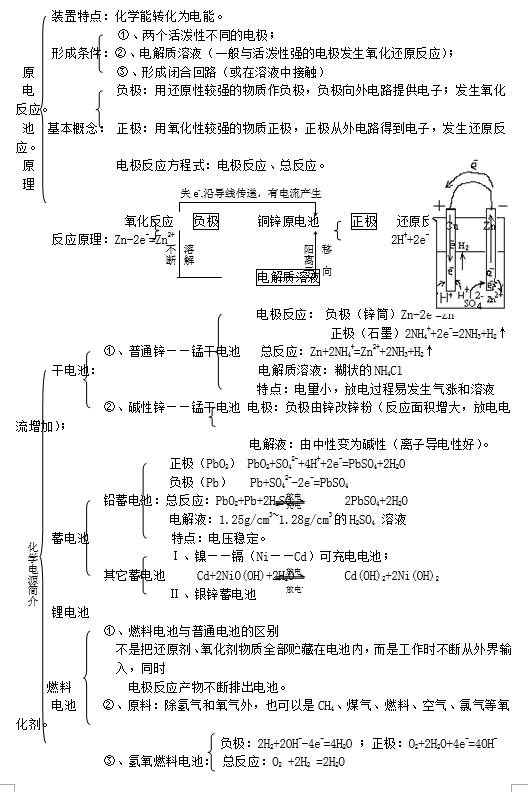

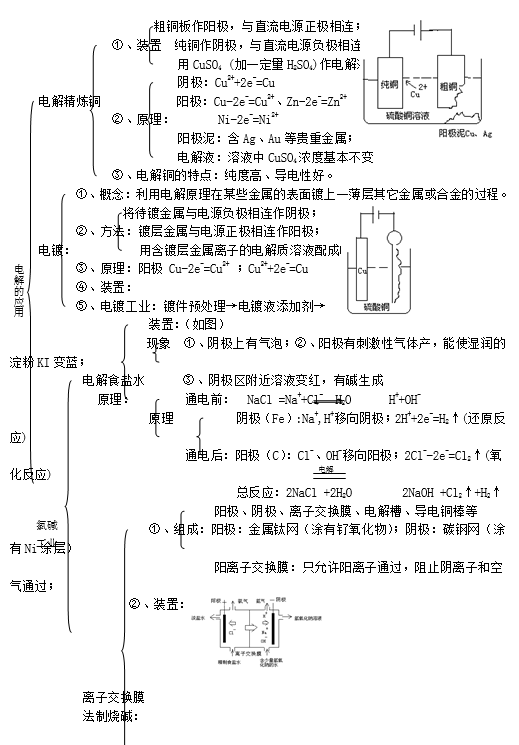
原电池,化学电池,电解池
氧化还原反应与原电池的异同点?
原电池是将化学能转化为电能的装置。
电解池是将电能转化为化学能的装置。
原电池与电解池的异同点:
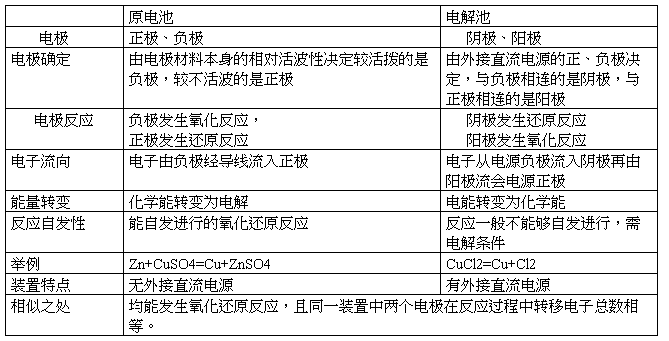
原电池与电解池的判断:
原电池、电解池、电镀池判定规律:若无外接电源,是原电池,然后依据原电池的形成条件分析判定;若有外接电源,
两极插入电解质溶液中,则可能是电解池或电镀池。当阳极金属与电解质溶液中的金属阳离子相同则为电镀池,其余情况为电解池。
电解池中阴离子去向阳极被还原。阳离子去向阴极被氧化。
金属腐蚀
化学腐蚀:金属与接触到的干燥气体(如:氧气,氯气,二氧化硫等)或非电解质(如石油)等直接接触发生化学反应而引起的腐蚀叫化学腐蚀。例如,铁与氯气直接反应而腐蚀,钢管被原油中的含硫化合物服饰等。化学腐蚀的速度随温度升高而加快。
不纯的离子在电极附件失去电子或者得到电子,发生氧化还原反应,这个过程叫放电。
金属腐蚀是金属与周围的气体或液体物质发生氧化还原反应而引起损耗的现象。由于与金属接触金属与电解质溶液接触时,会发生原电池反应,比较活波的金属失去电子而被氧化,这种腐蚀叫做电化学腐蚀。钢铁在潮湿的空气中生锈,就是电化学腐蚀最典型的例子.
三、钢铁的电化学腐蚀
(1)析氢腐蚀
(钢铁表面吸附水膜酸性较强时)
阳极(Fe):Fe-2e-=Fe2+ Fe2++2H2O=Fe(OH)2+2H+
阴极(杂质):2H++2e-=H2
电池反应: Fe+2H2O=Fe(OH)2+H2↑
由于有氢气放出,所以称之为析氢腐蚀。
(2)吸氧腐蚀(钢铁表面吸附水膜酸性较弱时)
阳极(Fe):Fe—2e-=Fe2+
阴极:O2+2H2O+4e-=4OH-
总反应:2Fe+O2+2H2O=2Fe(OH)2
由于吸收氧气,所以也叫吸氧腐蚀。析氢腐蚀与吸氧腐蚀生成的
Fe(OH)2被氧所氧化,生成Fe(OH)3脱水生成Fe2O3 铁锈。钢铁制品在大气中的腐蚀主要是吸氧腐蚀。
Fe+2H2O=Fe(OH)2+H2↑
O2+2H2O+4e-→4OH-
2Fe+O2+2H2O=2Fe(OH)2 +2H++2e-→H2
析氢腐蚀主要发生在强酸性环境中,而吸氧腐蚀发生在弱酸性或中性环境中。
化学腐蚀和电化学腐蚀的区别和联系:

(四)、金属的防护
1、牺牲阳极的阴极保护法
正极:要保护的金属
负极:比要保护金属活泼的金属
2、外加电流的阴极保护法(比组成原电池防护更好)
阴极:被保护的金属
阳极:惰性电极
两者均存在于电解质溶液中接上外接直流电源。
3、覆盖保护膜及其他保护方法
覆盖保护膜(涂油漆,电镀,钝化等)
改变金属的内部结构(钢→不锈钢,在钢中加入镍和铬)
化学腐蚀电化学腐蚀条件金属与氧化剂直接接触不纯金属或合金与电解质溶液接触现象无电流产生有微弱电流产生本质金属被氧化的过程较活泼金属被氧化的过程相互联系化学腐蚀和电化学腐蚀往往同时发生
第二篇:高中化学选修4第四章电化学基础
高中化学选修4第四章电化学基础
第三节 电解池教学设计
教学目标:
1、了解电解池的工作原理,能写出电极反应和电池反应方程式。
2、能写出电解池中的电极反应和电解的总反应。
3、使学生了解氯碱工业、电镀工业、电冶金工业的化学原理。
教学重点 、难点:
1、电解原理
2、离子的放电顺序
3、电解原理的应用
教学工具:小烧杯、玻璃棒、碳棒、导线、电流表、直流电源。
课型及课时:新授课、第一课时
教学方法:实验探究、启发讨论法
教学过程:
[复习提问]原电池的构成条件?原电池正、负极判断?谁能举例说明原电池是怎样的能量转化装置?
[学生]学生回答:"两极一液成回路";负极:相对活泼的金属,正极:相对不活泼
的金属或可导电的非金属;原电池是把化学能转变成电能的装置。
[导入新课]那么电能能不能转化为化学能呢?这就是本节课的内容--电解池。 [板书] 第三节 电解池
一、电解原理
1、电解原理
[教师]我们已经知道,金属和电解质溶液都能导电,金属的导电过程是物理变化,电解质溶液的导电过程是否与金属的导电过程相同呢?
[学生实验]学生以学习小组为单位完成[实验4-2](将U型管改为小烧杯),并观察、记录实验现象。教师巡回指导。
[学生总结]实验现象:
阴极:碳棒上逐渐覆盖了一层红色物质。
阳极:生成有刺激性气味、能使湿润的碘化钾淀粉试纸变蓝的气体。
[教师引导]请大家根据实验现象和氯化铜溶液的组成成分以及原有知识分析推断两极
生成物的名称。
[学生回答]两极产物: 阴极--铜 阳极--氯气
[教师提问]氯化铜溶液在电流的作用下为什么会生成Cu和Cl2呢? [教师讲解]CuCl2在水溶液中完全电离生成Cu2+和Cl-
[板书] 电解方程式: CuCl2 =Cu2++2Cl-
[教师讲解]通电前,Cu2+和Cl-在溶液里自由运动;通电后,在电场的作用下,带负电的Cl-移向阳极,并失去电子被氧化成氯原子,进而结合成Cl2放出,带正电的Cu2+移向阴极,并得到电子被还原成铜原子,覆盖在阴极上。 [板书] 阴极: Cu2++2e-=Cu (还原反应)
阳极: 2Cl--2e-=Cl2↑(氧化反应)
[小结]电解质溶液在导电过程中有新物质产生,是化学变化。
[板书]使电流通过电解质溶液而在阴、阳两极上引起氧化还原反应的过程叫做电解。
把电能转变为化学能的装置叫做电解池或电解槽。
[教师]让学生独立书写电解CuCl2溶液的化学反应方程式。(可以请1-3名学生到黑板上书写)
[板书] CuCl2 Cu+Cl2↑
[过渡]下面我们再分析电解池的两个电极。
[板书]2、电解池的两极
[讲述]电解池的两极是由与之相连的电源电极决定的。
[板书]阴极:与电源负极相连的电极。(发生还原反应)
阳极:与电源正极相连的电极。(发生氧化反应) [教师]电解质溶液是如何将电路沟通的呢?
[板书]3、电解池中的电子的移动方向
[学生]请学生讨论、总结并回答上面提出的问题。
[板书]电源负极→电解池阴极→电解液中的阳离子(被还原)
电解池中阴离子(被氧化)→电解池阳极→电源正极
[讲述]由上面分析可知:电解质溶液的导电过程必须有阴阳离子的参与,如果溶液中的离子不参加反应,电路就不能沟通,所以电解质溶液 的导电过程就是电解质溶液的电解过程。
[教师]在上述分析过程中,我们始终回避了一个重要的问题--水的电离。 [教师]CuCl2溶液中存在的离子有哪些?
[学生]Cu2+、Cl-、OH-、H+
[教师]为什么电解时,只有Cu2+和Cl-放电呢?这要涉及到离子的放电顺序问题。
[板书]离子的放电顺序
[教师讲解]各种离子得失电子的能力不同,因此,电解时离子放电难易也不同。 阳离子:Ag+>Hg2+>Cu2+>Fe2+>Zn2+>H+>Al3+>Na+>K+
阴离子:S2->I->Br->Cl->OH->含氧酸根
电解电解质溶液时,在阴阳两极上首先发生放电反应的离子分别是溶液里最容易放电的阳离子和最容易放电的阴离子。
[小结]本节课我们学习了电解的原理,认识了电解池的功能,下面请同学们在总结本节知识以及回忆前面所学的原电池知识的前提下,填写课前所发放的表格,并注意比较。
【教师】原电池和电解池知识总结比较表:
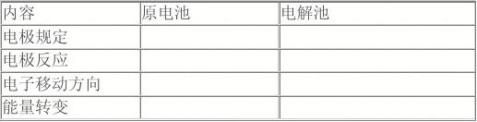
[板书设计]第一节 电解原理
一、电解原理
1、电解原理
CuCl2 =Cu2++2Cl-
阴极: Cu2++2e-=Cu (还原反应)
阳极: 2Cl--2e-=Cl2↑(氧化反应)
使电流通过电解质溶液而在阴、阳两极上引起氧化还原反应的过程叫做电解。 把电能转变为化学能的装置叫做电解池或电解槽。
CuCl2 Cu+Cl2↑
2、电解池的两极
阴极:与电源负极相连的电极。(发生还原反应)
阳极:与电源正极相连的电极。(发生氧化反应)
3、电解池中的电子的移动方向
电源负极→电解池阴极→电解液中的阳离子(被还原)
电解池中阴离子(被氧化)→电解池阳极→电源正极
[课堂练习]:
1.如下图所示两个装置中,溶液体积均为200 mL,开始时电解质溶液的浓度均为0.1 mol·L-1,工作一段时间后,测得导线上通过0.02 mol电子,若不考虑盐水解和溶液体积的变化,则下列叙述正确的是
A.产生气体的体积:①>②
B.电极上析出固体的质量:①>②
C.溶液的pH变化:①增大,②减小
D.电极反应式:①阳极:4OH--4e-===2H2O+O2↑②阴极:2H++2e-===H2↑
2.甲、乙两个电解池均以Pt为电极,且互相串联,甲池盛有AgNO3溶液,乙池中盛有一定量的某盐溶液,通电一段时间后,测得甲池中电极质量增加2.16 g,乙池中电极上析出0.64 g金属,则乙池中溶质可能是
A、CuSO4 B、MgSO4 C.、 Al(NO3)3 D、Na2SO4
3.用石墨电极电解100 mL H2SO4与CuSO4的混合溶液,通电一段时间后,两极均收集到2.24 L气体(标准状况),则原混合溶液中Cu2+的物质的量浓度为
A、1 mol·L-1 B、2 mol·L-1 C、3 mol·L-1 D、4 mol·L-1
4.用惰性电极电解V L MSO4的水溶液,当阴极上有m g金属析出(阴极上无气体产生)时,阳极上产生X L气体(标准状况),同时溶液的pH由原来的6.5变为2.0(设电解前后溶液体积不变)。则M的相对原子质量的表示式为
A、 B、 C、 D、
[作业]教材习题P89 5、6
-
高中化学选修4知识点总结
高考圈助你轻松跨过高考高中化学选修4知识点总结第1章化学反应与能量转化化学反应的实质是反应物化学键的断裂和生成物化学键的形成化学反…
-
高中化学选修4知识点归纳总结
高中化学选修4知识点归纳总结第一章化学反应与能量一、焓变反应热1.反应热:一定条件下,一定物质的量的反应物之间完全反应所放出或吸收…
-
高中化学选修4知识点总结
高中化学选修4知识点总结第1章化学反应与能量转化化学反应的实质是反应物化学键的断裂和生成物化学键的形成化学反应过程中伴随着能量的释…
-
高中化学选修4知识点总结
高中化学选修4知识点总结第1章化学反应与能量转化化学反应的实质是反应物化学键的断裂和生成物化学键的形成化学反应过程中伴随着能量的释…
-
高中化学选修4知识点总结填空
选修四复习学案化学反应与原理章节知识点梳理第一章化学反应与能量一焓变反应热1反应热一定条件下一定物质的量的反应物之间反应所放出或吸…
-
高一化学下册知识点总结
高一化学必修二知识点总结一、元素周期表★熟记等式:原子序数=核电荷数=质子数=核外电子数1、元素周期表的编排原则:①按照原子序数递…
-
高中化学电化学知识点总结
装置特点:化学能转化为电能。①、两个活泼性不同的电极;形成条件:②、电解质溶液(一般与活泼性强的电极发生氧化还原反应);原③、形成…
-
高中化学无机部分必备知识点总结大全
高中化学必背知识点归纳与总结一、现象:1、铝片与盐酸反应是放热的,Ba(OH)2与NH4Cl反应是吸热的;2、Na与H2O(放有酚…
-
高二化学上期知识点_总结
第一章氮族元素一氮族元素N氮P磷As砷Sb锑Bi铋二氮气N21分子结构电子式结构式NN分子里NN键很牢固结构很稳定2物理性质无色无…
-
高中化学必修一知识点总结
必修1全册基本内容梳理从实验学化学一化学实验安全11做有毒气体的实验时应在通风厨中进行并注意对尾气进行适当处理吸收或点燃等进行易燃…
-
高考电化学知识点总结
20xx届高考电化学知识点总结直击高考考点-电化学知识是理论部分的一个重要内容,也是历年高考考查的一个重点。电化学知识既可以综合学…