滴定法实验总结报告
蒸馏后碱滴定法
1. 原理 亚硫酸盐在酸性条件下用碱中和,加热,亚硫酸盐被过氧化氢吸收,用碱中和并滴定至终点,根据消耗标液用量计算其含量。
H2O2+H2SO3→H2SO4+H2O;
H2SO4+2NaOH→Na2SO4+2H2O;
2试剂:
盐酸1+1
过氧化氢1+10
氢氧化钠标准溶液 0.05moL/L
甲基红-亚甲基蓝指示剂
3.实验步骤
试样处理:在密闭容器中加1+1盐酸对试样进行酸化并加热蒸馏,释放出的SO2以四氯汞钠作为吸收液,定容至一体积,吸取一定量的试液分析。
试样处理:在密闭容器中加1+1盐酸对试样进行酸化并加热蒸馏,释放出的SO2以NaOH作为吸收液,用无色酚酞作指示剂,定容至一体积,再用HCL与过量NaOH中和,吸取一定量的试液分析。
另在接收器内加入过氧化氢(1+10)20mL,加指示剂1滴,用0.05moL/L NaOH标液中和至灰绿色终点,作为吸收液,蒸馏至一定体积后,取下吸收液,再加一滴指示剂,用0.05moL/L NaOH标液滴定至灰绿色为终点。
计算公式 X(g/kg)=C*V*32/m
X:样品中二氧化硫的含量, g/kg;
C: 0.05moL/L NaOH标液浓度;
V:滴定过氧化氢吸收液至终点时NaOH标液消耗毫升数;
32:与1mLNaOH标液相当的二氧化硫的毫克数;
4.干扰排除
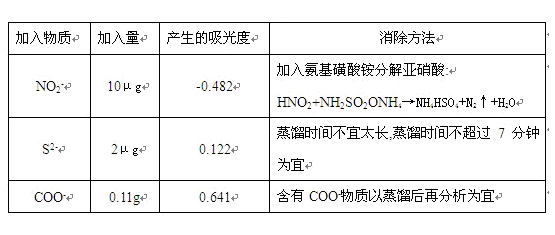
5.实验结果

6.试验总结
让人有点伤心,试验最后没有出现预订的全绿色,而是绿色中有一些淡淡的紫色,说实话,很不甘心,和试验老师商量了很多次,和指导老师讨论了很多次,淘汰了许多种方案,最终确定了下来,可是居然被无色酚酞打败了。
想着自己一次又一次得从三楼到一楼来来回回的跑,虽然没有结果,但这份不甘心,给了我动力,发誓一定要将无色酚酞这个问题解决了,相信离试验成功也不远了,不过,好在组内另一同学的光谱仪测法成功了,多少有点欣慰。不得不佩服高科技,操作简单,成功率高,但我依然坚定要用多方法测定同一食品添加剂,找到最好的。
虽然遇到了重重困难,但是我们依然坚持搜集到了数据,完成了结果。同时,我们对这种检测方法有了更加深刻的认识,对这个实验的利弊也更加清楚.。
20##年5月8日
黄苏祺
第二篇:中和滴定实验误差分析总结
问题1:量取液体体积时,能否用量筒代替滴定管?
答:不能。因为计量的精确度不同。量筒只能读至0.1ml,而滴定管可读至0.01ml。用滴定管的优点有:测定值的精确度较高,读数方便,操作简单
问题2:酸式滴定管能不能用来装碱?碱式滴定管能不能用来装酸?
答:都不能。酸式滴定管不能盛放碱性试剂。因为玻璃活塞主要成分SIO2与碱性试剂反应。碱式滴定管不能存放酸性试剂和能腐蚀橡胶管的强氧化试剂。
问题3:在加入反应液时,如果不用反应液润洗,结果会怎样?
答:管内壁附着的蒸馏水使反应液稀释,使溶液的浓度降低,影响测定结果。(偏高)
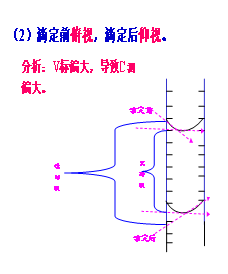
问题4:滴定前,滴定管下端有气泡,滴定后没气泡,结果会怎样?
对于气泡前有后无,会使V标偏大,致使C测偏大//////////1、因仪器润洗不当引起的误差
1)未用标准液润洗滴定管分析这时C标变小了而n测不变所以V标增大,导致C测增大
(2)锥形瓶用待测液润洗分析:这时n测偏大,使V标偏大,导致C测增大
(3)未用待测液润洗待测液滴定管分析:实际n测减小所以会使V标减小导致C测减小
4)锥形瓶洗净后瓶内还残留有少量蒸馏水无影响


 、
、
-
ERP实验报告 总结
ERP实验报告总结通过这次的实战演练,我真的是学到了很多。企业的发展其实就是在求生存,为了生存,为了能在高手林立,变幻莫测的商场中…
-
实验报告总结
实验报告书姓名:学号:专业:系部:指导教师:20xx年x月x日一、实验时间:20xx年x月—5月二、实验地点:三、实验目的:1、通…
-
无机实验报告总结
无机化学实验总结通过对传统无机化学中化合物的性质、合成、反应、分析等方面的接触,学习了很多相关内容,如热力学、动力学、波谱学等。同…
-
审计实验报告总结
审计作为应用性很强的一门学科、一项重要的经济管理工作,是加强经济管理,提高经济效益的重要手段,经济管理离不开审计,经济越发展审计工…
-
实 验 报 告 总 结
——在低年级加强写字指导的研究龙村镇第二小学温珺人类步入信息时代,文化的传播与交流方式产生了翻天覆地的变化。随着键盘敲击的速度越来…
-
大学化学实验 滴定分析基本操作 酸碱浓度的比较 实验报告
滴定分析基本操作及酸碱浓度的比较实验报告实验目的就不写出来了大家肯定都有一实验原理1酸碱指示剂有其变色范围pH甲基橙的变色范围是3…
-
分析化学实验报告(武汉大学第五版)
分析化学实验报告陈峻贵州大学矿业学院贵州花溪550025摘要熟悉电子天平的原理和使用规则同时可以学习电子天平的基本操作和常用称量方…
-
分析化学实验 碱度的测定 实验报告
实验报告姓名班级同组人项目碱度的测定课程分析化学学号一实验目的1掌握酸碱滴定法测定碱度的原理和方法2掌握碱度测定结果的计算3熟练滴…
-
分析化学实验 过氧化氢含量的测定 实验报告
实验报告姓名班级同组人项目过氧化氢含量的测定课程分析化学学号一实验目的1了解高锰酸钾标准溶液的配制方法和保存条件2掌握以Na2C2…
-
分析化学实验 磷酸盐的测定实验报告
实验报告姓名班级同组人项目磷酸盐的测定课程分析化学学号一实验目的1掌握钼蓝法测定磷酸盐含量的方法和原理2掌握分光光度计的使用方法二…
-
秋季供用电设施预防性试验总结报告
秋季供用电设施预防性试验和检修工作总结报告山西煤炭运销集团阳城四侯煤业有限公司20xx年x月x日供用电设施预防性试验和检修工作总结…