分析化学实验 磷酸盐的测定实验报告
实 验 报 告
姓名: 班级: 同组人:
项目 磷酸盐的测定 课程: 分析化学 学号:
一、实验目的
1、掌握钼蓝法测定磷酸盐含量的方法和原理。
2、掌握分光光度计的使用方法。
二、实验原理
在强酸性条件下,水样中的活性磷酸盐与钼酸铵反应,生成淡黄色的磷钼黄。磷钼黄被氯化亚锡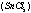 还原成蓝色的磷钼蓝。蓝色深浅与活性磷酸盐含量成正比,在690nm波长处有最大吸收值。通过比色法可测出水样中活性磷酸盐的含量。
还原成蓝色的磷钼蓝。蓝色深浅与活性磷酸盐含量成正比,在690nm波长处有最大吸收值。通过比色法可测出水样中活性磷酸盐的含量。
注意事项
(1)实验用玻璃器皿应用酸洗涤,不应用含有磷的洗涤,以免玻璃表面吸附作用而造成磷酸盐的污染和样品中磷酸盐的损失。
(2)若水样有明显颜色,则应在锥形瓶里的100ml水样中加400mg活性炭,摇动5min,用2~3张重叠滤纸过滤后做测定。定性滤纸和活性炭会带进微量磷酸盐,应用同样的活性炭做空白实验。
(3)显色后应在30min内测完溶液吸光值,30min后溶液的颜色将逐渐变浅。
(4)若对精确度要求较高时,应增加平行实验。
三、仪器和药品
仪器:
分光光度计722型或其他型号 吸管25ml、10ml、2.0ml、1.0ml
具塞比色管50ml6支 容量瓶100ml .烧杯250ml 小漏斗 量筒
试剂:
1.活性炭 粉末
2.硫酸溶液(1:1) 在不断搅拌下,将浓硫酸沿烧杯壁缓缓倒入同体积的蒸馏水中。
3.钼酸铵溶液(10%) 称取5g钼酸铵 溶解后稀释至50ml,到其澄清液,贮存于聚乙烯瓶中。
溶解后稀释至50ml,到其澄清液,贮存于聚乙烯瓶中。
4.氯化亚锡甘油溶液(2.5%) 称取2.5g 溶于100ml甘油中,温热搅拌使其溶解。贮存于棕色试剂瓶中。
溶于100ml甘油中,温热搅拌使其溶解。贮存于棕色试剂瓶中。
5.钼酸铵—硫酸混合试剂 将钼酸铵与硫酸按1:3的体积比混合,避光保存于聚乙烯瓶中。如果变蓝,须重新配制。
6.磷酸盐标准溶液
KH2PO4标准贮备溶液:将分析纯KH2PO4在115℃烘干1h,置于干燥器冷却后,称取1.3610g,溶于蒸馏水转移至1000ml容量瓶中稀释至刻度,混匀。加2ml氯仿,混匀。避光保存。
KH2PO4标准使用溶液:移取KH2PO4标准贮备溶液1.00ml于100 ml容量瓶中,用蒸馏水稀释至刻度,混匀。此溶液1.00ml含磷酸盐态磷(PO43---P)0.10μmol。使用前配制。
四、实验内容及步骤
1、水样的预处理 若水样混浊,用离心机,取清液使用。
2、配制铁标准色列及水样显色:
取6支50ml具塞比色管,编好序号,分别加入0.00、1.00、2.00、3.00、4.00、5.00ml…… KH2PO4标准使用溶液,用蒸馏水稀释至刻度,摇匀。分别加入2.0ml钼酸铵—硫酸混合试剂,摇匀。静置3min。分别加入氯化亚锡甘油溶液4滴,摇匀。静置10min。
移取50.00m或一定量澄清l水样于50ml具塞比色管中,分别加入2.0ml钼酸铵—硫酸混合试剂,摇匀。静置3min。分别加入氯化亚锡甘油溶液4滴,摇匀。静置10min。
3、测定标准溶液吸光度并制作吸收曲线
取上述标准比色列中浓度适当的溶液,在721型分光光度计上,用3cm比色皿,以试剂溶液为参比溶液,测定吸光度。以波长为横坐标,吸光度为纵坐标,绘制吸收曲线,从而选择测定磷的适宜波长。
4、测定标准溶液吸光度并绘制标准曲线
用3cm比色皿,以试剂溶液作参比,于690nm波长测定吸光度(A)。
以吸光度A为纵坐标, PO43--P含量(μmol/L)为横坐标绘制标准曲线。
5、测定水样的吸光值并计算水样中磷酸态磷(PO43--P)的含量(μmol /L)。
五、实验结果记录与计算

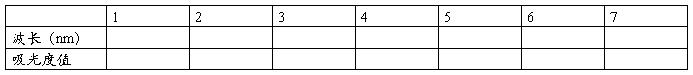
绘制吸收曲线
绘制标准曲线
磷酸态磷(PO43--P)的含量(μmol /L)=
六、思考题:
1、测定磷酸盐时应注意哪些事项?
2、标准曲线与工作曲线的区别?
教师评语:
年 月 日
第二篇:《环境分析化学实验》实验报告格式

《环境分析化学实验》
实验报告
专 业 环境科学
班 级 环科1201
姓 名 帕沙古丽
成 绩
东华大学环境科学与工程学院实验中心
二0一三年 月
诚信做人;数据真实;分析合理;富于创新


诚信做人;数据真实;分析合理;富于创新

6、固体KMnO 4
7、 500ml容量瓶,250 ml容量瓶,称量瓶,分析天平, 玻璃棒,棕色细口瓶,
25ml量筒,5ml 移液管 ,25ml移液管,洗瓶,
三、实验原理
? 水的硬度的测定可分为水的总硬度的测定和钙镁硬度的测定两种.总硬
度的测定是滴定Ca2+,Mg2+离子的总含量,并以Ca2+进行计算.通常以每升水中所含Ca2+离子的毫摩尔数表示,规定1升水中含1mmol Ca2+为1度.后一种是分别测定Ca2+和Mg2+的含量.测定水的总硬度,一般采用配位滴定法.最常用的配位剂是乙二胺四乙酸二钠盐,用Na2H2Y2H2O表示,习惯上称为EDTA,它在溶液中以Y4-的形式与Ca2+,Ma2+离子配位,形成1:1的无色配合物方程为 Ca2+ +Y4 =CaY2- Mg2++Y4=MgY2-
? 用EDTA滴定时,必须借助于金属指示剂确定滴定终点.常用的指示剂为铬黑
T,它在 pH=10的缓冲液中,以纯蓝色游离的HIn2-形式存在,与Ca2+,Mg2+离子形成酒红色的配合物,通式为:
? M2+ + HIn2=MIn-+ H+
(蓝色) (酒红色)
? Ca2+,Mg2+离子与EDTA及铬黑T形成配合物的稳定性不同,其稳定性大小的循
序序CaY2- >MgY2- >MgIn- >CaIn- ,用EDTA测定Ca、Mg时,通常在两个等分溶液中分别测定Ca量以及Ca和Mg的总量,Mg量则从二者所用EDTA量的差数求出。
? 在测定Ca时,先用NaOH调节溶液到pH=12~13,使Mg生成难溶的Mg(OH)
沉淀,然后加入钙指示剂与Ca配位呈红色。滴定时,EDTA先与游离Ca
2+2+2+2+22+2+2+2+2+2+2+配位,然后夺取已经和指示剂配位的Ca,使溶液的红色变成蓝色,达到终
点。从EDTA标准溶液的用量可计算Ca的含量。
滴定Ca、Mg总量时,在pH=9~10的缓冲溶液中,以铬黑T为指示剂,用EDTA滴定。因稳定性CaY> MgY>MgIn> CaIn,铬黑T先与部分Mg配位为MgIn(酒红色)。而当EDTA滴入时,EDTA首先与Ca和Mg配位,然后再夺取MgIn中的Mg,使铬黑T游离,因此到达终点时,溶液由酒红色变为天蓝色。从EDAT标准溶液的用量,即可以计算样品中的钙镁总量,然后换算为相应的硬度单位。
各国对水的硬度的表示方法各有不同。其中德国硬度是较早的一种,它以度
诚信做人;数据真实;分析合理;富于创新 2+2+2+2-2-2+2+2+2+

数计,1°表示1L水中含10mgCaO。为方便起见,我国也常以来mg/L表示。此实验中,我们采用CaCO的含量单位ppm来表 3
四、实验步骤
(一) 配制0.01MEDTA标准溶液
1、在分析天平上准确称取EDTA基准物质1.9g,于150ml的干净烧杯中。
2、加适量水溶解,用玻璃棒小心转移至500ml容量瓶中。
3、溶液全部转移到容量瓶中后,用洗瓶淋洗烧杯3~5次,淋洗液亦要小心沿玻璃棒转移入容量瓶中,不能有所损失。
4、加水至容量瓶刻度线以下,再改用小滴管滴加蒸馏水,准确至刻度线(液面最底处与刻度线相切),充分摇匀。
5、计算所配制的EDTA溶液的准确浓度,用标签标示于容量瓶上。
注意
配制EDTA标准溶液时,溶液的转移是浓度准确与否的关键。烧杯中的溶液要沿玻璃棒及容量瓶壁小心倒入,玻璃棒要从原路小心放回烧杯中,以防溶液流失。烧杯要用蒸馏水充分润洗,淋洗液应全部小心转入容量瓶中。
(二) Ca、Mg总量的测定
1、从指导教师处领取未知水样,定容于250ml容量瓶中,摇匀。
2、用未知水样润洗25ml移液管3次,注意擦干外壁,吹干内壁。
3、准确吸取25ml水样于250ml锥形瓶中,加蒸馏水50ml,加NH·HO-NHCl3242+2+缓冲溶液5ml,调节溶液pH=9~10。
4、加铬黑T指示剂3滴,摇匀。
5、用EDTA溶液滴定,当溶液由酒红色变为纯蓝色时,即为终点。记下所用体积V。 1
6、用同样方法平行测定三份。
(三) Ca的测定
1、用移液管准确吸取水样25ml于250ml锥形瓶中,加蒸馏水50ml,加6M NaOH
诚信做人;数据真实;分析合理;富于创新 2+

诚信做人;数据真实;分析合理;富于创新

w .1000 M EDTA=
mEDTA .500
?
=0.01018mol/L
诚信做人;数据真实;分析合理;富于创新

思考题
1、如果只有铬黑T指示剂,能否测定Ca的含量?如何测量? 答:如果只有铬黑2+T指示剂能。测定Ca2+含量时,用移液管移取水样25.00ML于锥形瓶中,加入2ML40g.L-1NAOH,调节溶液PH为12~13,使Mg2+生成Mg(OH)2沉淀,再加3~4滴铬黑T,用EDTA标准溶液滴定至溶液由酒红色变为纯蓝色为终点,记取EDTA耗用的体积
2、 Ca、Mg与EDTA的配合物,哪一个稳定?为什么滴定Mg时要控制pH=9~10,而Ca则需控制pH=12~13? 2+2+2+2+
答: Ca2+,Mg2+离子与EDTA及铬黑T形成配合物钙离子配合物稳定性大 其稳定性大小的循序序CaY2- >MgY2- >MgIn- >CaIn-
3、若测定的水样中Mg含量过高,对终点会有什么影响?如何消除其影响? 答:氢氧化镁的溶度积大约是10^-11;PH>10后容易沉淀。就测不出来了。2+即PH不得大于10。否则沉淀。氢氧化钙的溶度积大约是10^-6,-6/3+14=12,即PH=12也不会沉淀。可以测定。严格的计算结果是:氢氧化镁沉淀的最小PH=10.42;氢氧化钙沉淀的最小PH=12.24。显然,当PH>=13时,钙会沉淀,不能准确测定钙
诚信做人;数据真实;分析合理;富于创新

1
诚信做人;数据真实;分析合理;富于创新

诚信做人;数据真实;分析合理;富于创新

诚信做人;数据真实;分析合理;富于创新


诚信做人;数据真实;分析合理;富于创新
-
分析化学实验报告
分析化学实验报告20xx0218200858分类理工类标签字号大中小订阅盐酸和氢氧化钠标准溶液的配制和标定时间12月15号指导老师…
-
分析化学实验报告(武汉大学第五版)
分析化学实验报告陈峻贵州大学矿业学院贵州花溪550025摘要熟悉电子天平的原理和使用规则同时可以学习电子天平的基本操作和常用称量方…
-
分析化学实验报告
级名分析化学实验报吉林农业大学告班姓同组人实验酸碱标准溶液的配制和比较滴定实验目的实验原理实验步骤1酸碱标准溶液的配制101mol…
-
分析化学实验报告样本
实验名称游标卡尺的使用实验目的1掌握游标卡尺的使用方法2了解游标卡尺的结构原理3学习数据处理的相关内容4养成良好的写实验报告的习惯…
-
分析化学实验报告本模版
分析化学实验报告实验一电子分析天平的操作及称量练习学院专业班级姓名学号实验日期年月日教师评定实验目的掌握电子分析天平的基本操作和粉…
-
滴定法实验总结报告
蒸馏后碱滴定法1原理亚硫酸盐在酸性条件下用碱中和加热亚硫酸盐被过氧化氢吸收用碱中和并滴定至终点根据消耗标液用量计算其含量H2O2H…
-
大学化学实验 滴定分析基本操作 酸碱浓度的比较 实验报告
滴定分析基本操作及酸碱浓度的比较实验报告实验目的就不写出来了大家肯定都有一实验原理1酸碱指示剂有其变色范围pH甲基橙的变色范围是3…
-
分析化学实验报告(武汉大学第五版)
分析化学实验报告陈峻贵州大学矿业学院贵州花溪550025摘要熟悉电子天平的原理和使用规则同时可以学习电子天平的基本操作和常用称量方…
-
分析化学实验 碱度的测定 实验报告
实验报告姓名班级同组人项目碱度的测定课程分析化学学号一实验目的1掌握酸碱滴定法测定碱度的原理和方法2掌握碱度测定结果的计算3熟练滴…
-
分析化学实验 过氧化氢含量的测定 实验报告
实验报告姓名班级同组人项目过氧化氢含量的测定课程分析化学学号一实验目的1了解高锰酸钾标准溶液的配制方法和保存条件2掌握以Na2C2…
-
无机与分析化学实验总结
无机与分析化学实验总结一个学期的化学实验了,通过十几个化学实验,我收获很多。我最喜欢做的是结晶的试验,看着从溶液中析出的各种形状的…