超详细人教版必修一化学第四章非金属及其化合物化学方程式总结
第四章 非金属及其化合物方程式总结
----------加粗的是对应的离子方程式
一、硅及其化合物
1、硅单质
物理性质:有金属光泽的灰黑色固体,熔点高,硬度大,质地脆,导电性介于导体和绝缘体之间。
化学性质:常温下化学性质稳定
硅的还原性:Si(粉)+O2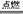 SiO2
SiO2
粗硅的制取:2C+SiO2 Si+2CO(制得粗硅)
Si+2CO(制得粗硅)
粗硅的提纯:Si(粗)+2Cl2 SiCl4 SiCl4+2H2=Si(纯)+4HCl
SiCl4 SiCl4+2H2=Si(纯)+4HCl
硅与强碱的反应:Si+2NaOH+H2O =Na2SiO3+2H2↑ 2OH-+ Si+H2O =SiO32–+H2↑
硅与氢氟酸反应:4HF+Si=SiF4↑+2H2↑
硅的用途:硅可制造集成路、电子芯片、太阳能电池板等。
2、二氧化硅及硅酸
存在:结晶形和无定形。通称硅石。
性质:化学性质稳定,除氢氟酸外,一般不与其他酸反应,可以与强碱、碱性氧化物发生反应,属酸性氧化物。
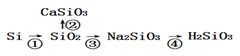 用途:SiO2是光导纤维的主要原料,以SiO2为主要原料的物质大多都有石英某某、水晶某某;玛瑙某某。
用途:SiO2是光导纤维的主要原料,以SiO2为主要原料的物质大多都有石英某某、水晶某某;玛瑙某某。
①Si(粉)+O2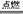 SiO2
SiO2
②与碱性氧化物反应: SiO2+CaO CaSiO3
CaSiO3
③与碱的反应: SiO2+2NaOH=Na2SiO3+H2O OH-+SiO2=SiO32–+H2O
④硅酸盐与酸生成硅酸的反应:
Na2SiO3+2HCl=H2SiO3(胶体)+NaCl SiO32-+2H+=H2SiO3(胶体)
Na2SiO3+CO2+2H2O=H2SiO3↓+Na2CO3 SiO32-+CO2+H2O=H2SiO3↓+CO32-
⑤与氢氟酸反应:SiO2+4HF =SiF4↑+2H2O
硅酸易受热分解:H2SiO3  SiO2↓+H2O
SiO2↓+H2O
3、硅酸盐
硅酸盐是由硅、氧和金属组成的化合物的总称,在自然界分布极广,种类极多,是一类结构复杂的固体物质,大多不溶于水,化学性质很稳定。
硅酸钠:(最简单的硅酸盐)
可溶于水,其水溶液俗称水玻璃,可做粘合剂和防火剂,是制备硅胶和木材防火剂等的原料。
制备途径:SiO2+2NaOH=Na2SiO3+H2O OH-+SiO2=SiO32–+H2O
 (贮存NaOH溶液的试剂瓶要用橡胶塞)
(贮存NaOH溶液的试剂瓶要用橡胶塞)
常见的硅酸盐产品:陶瓷、玻璃、水泥
二、氯及其化合物
1、氯气(Cl2)
Cl2的制取:原理:4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
4H++2Cl–+MnO2 Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
发生装置:固液加热型 实验装置:(见右图)
气体收集装置:向上排空气法(或排饱和食盐水法)
尾气处理装置:用碱液(NaOH)吸收
物理性质:①黄绿色 ②气体 ③有刺激性气味 ④有毒 ⑤密度比空气大
⑥2:1体积溶于水 ⑦易液化
化学性质:a、与水(H2O)的反应:Cl2 + H2O = HCl + HClO Cl2 + H2O = H++Cl—+ HCl
用途:可用于自来水的杀菌、消毒
新制氯水中的粒子:Cl2;H2O;HClO;H+;Cl-;ClO-;OH-(少量)
久置氯水中的粒子:H+;Cl-;H2O;OH-(少量)
b、与碱反应:氯气+碱==氯酸盐+次氯酸盐+水
(此反应中氯气既作氧化剂又作还原剂)
与NaOH反应:Cl2+2NaOH=NaCl+NaClO+H2O Cl2+2OH–=Cl–+ClO–+H2O
(产物NaClO:漂白液的主要成分)
与Ca(OH)2反应:Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O Cl2+2OH–=Cl–+ClO–+H2O
(产物Ca(ClO)2:漂白粉、漂白精的主要成分)
注:漂白粉产生作用的原因:Ca(ClO)2+CO2+H2O= 2HClO +CaCO3↓
且次氯酸易分解(现制现用):2HClO 2HCl+O2↑
2HCl+O2↑
c、与金属的反应:
与Na的反应:2Na+ Cl2 2NaCl 现象:有黄光,燃烧,产生白烟
2NaCl 现象:有黄光,燃烧,产生白烟
与Fe的反应:3Cl2+2Fe 2FeCl3 现象:燃烧,产生棕黄色的烟
2FeCl3 现象:燃烧,产生棕黄色的烟
与Cu的反应:Cu + Cl2 CuCl2 现象:燃烧,产生棕黄色的烟
CuCl2 现象:燃烧,产生棕黄色的烟
d、与非金属的反应:与H2的反应:H2+Cl2 2HCl 现象:H2在Cl2中燃烧,产生苍白色火焰
2HCl 现象:H2在Cl2中燃烧,产生苍白色火焰
2、氯离子(Cl-)的检验
原理:Ag++Cl- = AgCl ¯
试剂:AgNO3溶液和稀硝酸(HNO3)
操作:(加稀硝酸的作用是除去干扰离子:CO32-)
方法一:在被检验的溶液中加入稀硝酸酸化,再滴入AgNO3溶液,若产生白色沉淀,则被检液中含有Cl-。方法二:在被检验的溶液中滴入AgNO3溶液,若产生白色沉淀,再加入稀硝酸,沉淀不溶,则被检液中含有Cl-。
3、附加:氯气的强氧化性:氯气将非金属最低价离子氧化为单质
氯气与溴化钠反应Cl2+2NaBr=2NaCl+Br2 Cl2+2Br—=2Cl—+Br2
氯气与碘化钾反应Cl2+2KI=2KCl+I2 Cl2+2I-=2Cl-+I2
氯气与硫化钠反应Cl2+Na2S=2NaCl+S↓ Cl2+S2–=2Cl–+S↓
氯气与硫化氢反应Cl2+H2S=2HCl+S↓ Cl2+H2S=2H++2Cl–+S↓
 三、硫及其化合物
三、硫及其化合物
1、硫单质(S)
物理性质:黄色晶体;质地脆;易研成粉末;不溶于水;微溶于酒精;易溶于二硫化碳(CS2)
化学性质:易与氧气反应:S + O2 SO2
SO2
2、二氧化硫(SO2)
物理性质:无色;有刺激性气味;有毒;气体;密度比空气大;易液化;易溶于水
化学性质:㈠ 与氧气反应:2SO2+O2 2SO3
2SO3
注意:此反应是可逆反应(指在相同条件下,既能向正反应方向进行,又能向逆反应方向进行的反应,通常用“ ”来代替“===”)
”来代替“===”)
以下㈡㈢㈣条均体现了SO2是一种酸性氧化物,具有酸性氧化物的通性
㈡ 与水的反应:SO2+H2O H2SO3 (此反应也是可逆反应)
H2SO3 (此反应也是可逆反应)
㈢ 与碱性氧化物的反应:SO2+ CaO CaSO3↓
CaSO3↓
㈣ 与碱的反应:SO2+Ca(OH)2=CaSO3↓+H2O SO2+Ca2++2OH-=CaSO3↓+H2O
㈤ 具有一定的还原性:SO2+2H2S=3S↓+2H2O (SO2作氧化剂;H2S作还原剂)
SO2+Cl2+2H2O=H2SO4+2HCl Cl2+SO2+2H2O=4H++SO42–+2Cl-
3、三氧化硫(SO3):是固体
㈠ 与水的反应:SO3+H2O=H2SO4 SO3+H2O=2H++SO42–
注:三氧化硫是一种酸性氧化物,具有酸性氧化物的通性,它溶于水生成硫酸,工业上利用这一原理生产硫酸
㈡ 与碱性氧化物的反应:SO3+ CaO === CaSO4
㈢ 与碱的反应:SO3+Ca(OH)2=CaSO4+H2O (此反应中SO3是固体;CaSO4是微溶物)
4、亚硫酸(H2SO3)
因为亚硫酸中硫元素不是最高价,所以它具有一定的还原性易被氧化成硫酸
㈠ 与氧气的反应:2H2SO3+ O2=2H2SO4
㈡ 不稳定,受热易分解:H2SO3 H2O+SO2↑
H2O+SO2↑
5、硫酸
稀、浓硫酸都具有酸的通性:
①与指示剂的反应:遇紫色石蕊试液:由紫变红
遇无色酚酞试液:不变色
②金属+酸==盐+H2↑:Zn+ H2SO4==ZnSO4+ H2↑ Zn+2H+==Zn2+ + H2↑
③酸性氧化物+酸==盐+H2O:CuO+ H2SO4==CuSO4+ H2O CuO+ 2H+==Cu2+ + H2O
④碱+酸==盐+H2O:2NaOH+H2SO4==Na2SO4+ 2H2O OH-+H+== H2O
⑤部分盐+酸==新酸+新盐:BaCl2+ H2SO4==BaSO4↓+2HCl Ba2++SO42-== BaSO4↓
浓硫酸的三点特性:
① 吸水性:有水分子存在,常用作干燥剂,干燥酸性或中性气体
② 脱水性:没有水分子存在,只是按2:1的比例脱去氢原子和氧原子
可使木条,纸张,蔗糖等有机物变黑:C12H22O11(蔗糖)  12C+11H2O
12C+11H2O
③ 强氧化性:与铜反应:2H2SO4(浓)+Cu CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(现象:生成可是品红褪色的气体(SO2),溶液由无色变蓝色)
与碳反应:2H2SO4(浓)+C CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
(现象:能使蔗糖脱水形成的碳糊,体积膨胀的原因)
由于其强氧化性,冷的浓硫酸、浓硝酸可使铝和铁发生钝化,表面生成致密氧化膜。
四、氮及其化合物

1、氮的氧化物:一氧化氮(NO);二氧化氮(NO2)
一氧化氮(NO):物理性质:无色,不溶于水的有毒气体。
化学性质:①制备:N2+O2  2NO
2NO
②易与氧反应:2NO+O2=2NO2(气体由无色变为棕红色)
二氧化氮(NO2):物理性质:红棕色;有刺激性气味气体;有毒;密度比空气大;易液化
化学性质:易溶于水:3NO2+H2O=2HNO3+NO
(气体体积减少2/3,由红棕色变为无色)
注:若想让NO、NO2全溶于水,通氧气的量:4NO2+O2+2H2O=4HNO3 4NO+3O2+2H2O=4HNO3
2、氨:(常见用途:氨是氮肥工业,有机合成工业及制造硝酸,铵盐的原料,氨还常用作制冷剂)
物理性质:无色,有刺激性气味;气体;极易溶于水且溶解极快(1::700)
化学性质:①制备:N2+3H2 2NH3
2NH3
②溶于水的产物:NH3+H2O  NH3·H2O
NH3·H2O NH4++OH-
NH4++OH-
【氨水中的粒子:NH3,H2O,NH3·H2O,NH4+,OH-,H+(少量)】
③氨水易受热分解:NH3·H2O NH3↑+H2O
NH3↑+H2O
④与酸的反应:NH3+HCl =NH4 Cl
⑤具有还原性:4NH3+5O2 4NO+6H2O
4NO+6H2O
3、铵盐:三大性质:均易溶于水;受热易分解;与碱反应时放出氨气。
受热易分解:NH4Cl NH3↑+HCl NH3+HNO3=NH4NO3
NH3↑+HCl NH3+HNO3=NH4NO3
NH4HCO3 NH3↑+H2O+CO2↑
NH3↑+H2O+CO2↑
与碱反应放出氨气:NaOH+NH4NO3 NaNO3 +NH3↑+H2O
NaNO3 +NH3↑+H2O
Ca(OH)2+2NH4Cl 2CaCl2+2NH3↑+2H2O (实验室制取NH3的方法)
2CaCl2+2NH3↑+2H2O (实验室制取NH3的方法)
NaOH+NH4Cl NaCl+NH3↑+H2O
NaCl+NH3↑+H2O
4、硝酸:(不管浓稀硝酸,除具有酸性外,都具有氧化性)
㈠ 铜与浓硝酸的反应:4HNO3(浓)+Cu= Cu (NO3)2+2NO2↑+2H2O
4H++2NO3-+ Cu = Cu 2++2NO2↑+2H2O
㈡ 铜与稀硝酸的反应:8HNO3(稀)+3Cu= 3Cu (NO3)2+2NO↑+4H2O
8H++2NO3-+ 3Cu = 3Cu 2++2NO↑+4H2O
㈢ 碳与浓硝酸的反应:4HNO3(浓)+C CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
㈣ 硝酸见光易分解:4HNO3 4NO2↑+O2↑+2H2O
4NO2↑+O2↑+2H2O
当反应物或反应条件不同时,硝酸被还原得到的产物也不同
(浓HNO3的产物:NO2;稀HNO3的产物:NO)
第二篇:必修1第四章 非金属化学方程式总结 人教版
第4章非金属及其化合物方程式
(硅及其化合物性质反应)
1、二氧化硅与氢氧化钠溶液反应 1、SiO2 +2NaOH=Na2SiO3 +H2O
2、二氧化硅与氢氟酸反应 2、SiO2 +4HF =SiF4 ↑+2H2O
3、高温下二氧化硅与氧化钙反应 3、SiO2 +CaO
高温 CaSiO3
4、高温下二氧化硅与碳酸钙反应 4、SiO2+CaCO3 高温 CaSiO3 +CO2↑
5、高温下二氧化硅与碳酸钠反应 SiO2+ Na2CO3 高温 Na2SiO3 +CO2↑
6、硅酸钠溶液与二氧化碳反应 Na2SiO3 +H2O +CO2=H2SiO3 ↓+Na2CO3
7、硅酸受热分解 7、H2SiO3 SiO2 +H2O
8、硅与氧气加热反应 8、Si + O2 △ SiO2
9、二氧化硅与碳高温反应 9、SiO2+2C 高温 Si+2CO↑
10、硅与氢氧化钠溶液反应10、Si +2NaOH +H2O = Na2SiO3 +2H2↑ (氯及其化合物性质反应)
1、实验室制氯气 MnO2 +4HCl(浓) △ MnCl2 +Cl2 ↑+2H2O
2、钠在氯气中燃烧 2Na + Cl2
3、铁在氯气中燃烧 2Fe + 3 Cl2
4、铜在氯气中燃烧 Cu + Cl2
5、氢气在氯气中燃烧 H2 + Cl2 2 NaCl 2 FeCl3 CuCl2 2HCl △
6、氯气与水反应 Cl2 + H2O == HClO +HCl
1
7、次氯酸光照分解 2HClO =
2HCl +O2↑
8、氯气与氢氧化钠溶液反应 Cl2+2NaOH = NaCl+NaClO+H2O
9、工业上制漂白粉 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
10、检验Cl-的反应 HCl +Ag NO3 =Ag Cl ↓+HNO3 (硫的氧化物、氮的氧化物反应)
1、硫和氧气反应 1、S + O2
SO2
2、硫与铁粉加热 2、S +Fe △ FeS
3、铜与硫加热 3、S +2Cu △ Cu2S
4、二氧化硫与水反应 4、SO2 +H2O === H2SO3
5、二氧化硫催化氧化 2 SO2 +O2 催化剂
△ 2SO3
6、溴水中通入二氧化硫褪色 SO2 + Br2 + 2 H2O = H2SO4 + 2HBr
7、二氧化硫与氢氧化钠溶液反应 7、SO2 +2NaOH =Na2SO3 +H2O
8、二氧化硫通入石灰水变浑浊 8、SO2 +Ca(OH)2 =CaSO3 ↓+H2O
9、一氧化氮与氧气反应 9、2NO +O2 =2NO2
10、二氧化氮与水反应 10、3NO2 +H2O =2HNO3 + NO
11、二氧化硫与氯水
SO2+Cl2+2H2O=H2SO4+2HCl(离子方程式)
12、二氧化硫与溴水
SO2+Br2+2H2O=H2SO4+2HBr(离子方程式)
13、二氧化硫与碘水
SO2+I2+2H2O=H2SO4+2HI(离子方程式)
14、二氧化硫通入氯化铁溶液
2
2FeCl3 + SO2 + 2H2O = 2FeCl2 + H2SO4 + 2HCl
15、二氧化硫通入酸性高锰酸钾溶液
5SO2 +2MnO4- +2H2O ==5SO42- +2Mn2+ +4H+
(氨气性质反应)
1、高温高压催化剂氮气和氢气反应
2、氨气溶于水溶液呈碱性
3、氨水加热分解 NH3·H2O△ NH3↑+H2O
4、氨气与氯化氢相遇产生白烟 NH3 + HCl = NH4Cl (固)
5、氨气与硝酸反应 NH3 +HNO3 = NH4NO3
催化剂
6、氨气催化氧化 4NH3 +5O2 △ 4NO + 6H2O
7、碳酸氢铵受热分解 NH4HCO3 △ NH3 ↑+CO2↑ +H2O
8、氯化铵与氢氧化钠反应 NH4Cl +NaOH △ NaCl +NH3 ↑+H2O
9、实验室制氨气 Ca(OH)2 +2NH4Cl △ CaCl2 +2NH3↑ +2H2O
10、铵离子的检验 NH4+ + OH- △ NH3 ↑+ H2O (硫酸和硝酸反应)
1、浓硫酸与铜加热反应
2H △
2SO4(浓 CuSO4+SO2↑+2H2O
2、浓硫酸与碳加热反应
2H(浓 △
2SO4 CO2 ↑ +2SO2+2H2O
3、稀硝酸与铜反应
3Cu +8HNO △
3Cu(NO3)2 +2NO ↑+4H2O
3
4、浓硝酸与铜反应 Cu +4HNO3 ==Cu(NO3)2 + NO2 ↑+ 2H2O
5、浓硝酸与碳反应 4HNO3(浓)+C==CO2↑+4NO2↑+2H2O
6、浓硝酸光照分解 4HNO3=4NO2↑+O2↑+2H2O(见光或受热分解)
7、铁与浓硫酸加热
6H(浓)+2Fe △
2SO4 Fe2(SO4)3+3SO2↑+6H2O
4
-
金属化学方程式总结
关于Na的1.钠跟氧气的反应在常温时4Na+O2=2Na2O(白色)在点燃时2Na+O2=Na2O2(淡黄色)过氧化钠比氧…
-
金属化学方程式总结
钠元素钠在空气中变质4NaO22Na2ONa2OH2O2NaOH2NaOHCO2Na2CO3H2O由钠制供氧剂2NaO2Na2O2…
-
超详细必修一化学第三章金属及其化合物化学方程式总结
第三章金属及其化合物方程式总结----------加粗的是对应的离子方程式1.金属钠的化学性质:钠露置空气中变暗:4Na+O2=2…
-
《金属及其化合物》化学方程式总结
金属及其化合物化学方程式1钠放置在空气中4NaO22Na2O2钠在空气中燃烧黄色的火焰2NaO2Na2O2淡黄色固体4LiO22L…
-
金属及非金属化学方程式总结
金属及非金属方程式总结按要求完成下列化学方程式是离子反应的写出离子方程式一钠及钠的化合物1钠在空气中缓慢氧化化学2钠在空气或氧气中…
-
超详细必修一化学第三章金属及其化合物化学方程式总结
第三章金属及其化合物方程式总结----------加粗的是对应的离子方程式1.金属钠的化学性质:钠露置空气中变暗:4Na+O2=2…
-
第三章金属及其化合物化学方程式总结
第三章金属及其化合物方程式总结1.金属钠的化学性质:钠露置空气中变暗:4Na+O2=2Na2O(白色)钠的燃烧:2Na+O2Na2…
-
高一化学知识总结:3 几种重要的金属化合物
第二节几种重要的金属化合物第一课时教学目标1.让学生掌握几种典型金属氧化物在水中的溶解性,与酸反应以及与碱反应的性质。2.让学生学…
-
20xx高中化学基础知识总结金属及其化合物部分
20xx高中化学基础知识总结《金属及其化合物部分》考点揭秘钠及其化合物:(一)、钠1.Na与水反应的离子方程式:命题角度为是否违反…
-
超详细人教版必修一化学第三章金属及其化合物化学方程式总结
第三章金属及其化合物方程式总结加粗的是对应的离子方程式1金属钠的化学性质钠露置空气中变暗4NaO22Na2O白色钠的燃烧2NaO2…
-
化学必修一 元素及化合物化学方程式总结
化学必修一元素及化合物化学方程式总结班级:姓名:得分:(每小题2.5分共100分)1.钠与氧气反应:2.钠在空气中燃烧:3.钠与水…