高中化学知识-原电池知识要点归纳
原电池知识要点归纳
(三)常见的电池介绍
(1)铜锌电池

(2)干电池
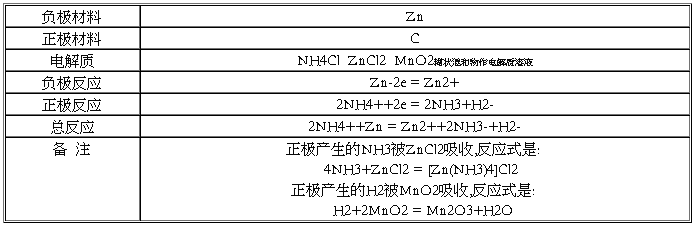
(3)银锌电池

(4)铅蓄电池
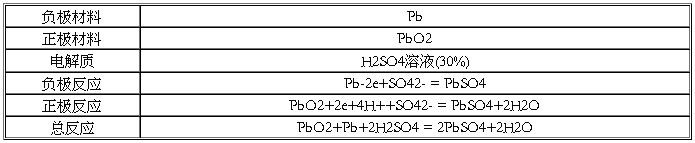
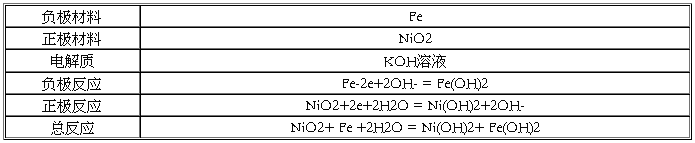
(5)爱迪生电池
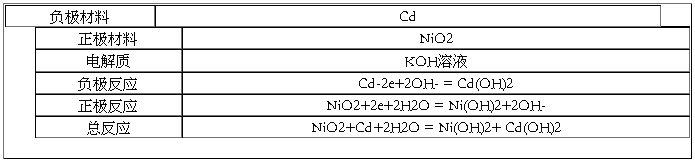
(6)镉镍电池
(7)铝—空气电池

(8)氢氧燃料电池

(9)其它燃料电池
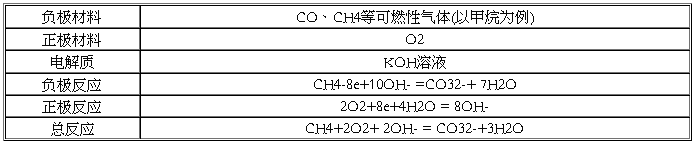
(10)心脏起搏电池1

(11)心脏起搏电池2

(11)热敷袋

第二篇:高中化学知识归纳(有机部分)
无机化学知识点归纳??
一、常见物质的组成和结构??
1、常见分子(或物质)的形状及键角??
(1)形状:V型:H2O、H2S 直线型:CO2、CS2 、C2H2 平面三角型:BF3、SO3 三角锥型:NH3 正四面体型:CH4、CCl4、白磷、NH4+ ??
平面结构:C2H4、C6H6??(2)键角:H2O:104.5°;BF3、C2H4、C6H6、石墨:120° 白磷:60°??NH3:107°18′ CH4、CCl4、NH4+、金刚石:109°28′??CO2、CS2、C2H2:180°??
2、常见粒子的饱和结构:??
①具有氦结构的粒子(2):H-、He、Li+、Be2+;??
②具有氖结构的粒子(2、8):N3-、O2-、F-、Ne、Na+、Mg2+、Al3+;??
③具有氩结构的粒子(2、8、8):S2-、Cl-、Ar、K+、Ca2+;??
④核外电子总数为10的粒子:??阳离子:Na+、Mg2+、Al3+、NH4+、H3O+;??阴离子:N3-、O2-、F-、OH-、NH2-;分子:Ne、HF、H2O、NH3、CH4??
⑤核外电子总数为18的粒子:??阳离子:K+、Ca 2+;??阴离子:P3-、S2-、HS-、Cl-;??分子:Ar、HCl、H2S、PH3、SiH4、F2、H2O2、C2H6、CH3OH、N2H4。??
3、常见物质的构型:??
AB2型的化合物(化合价一般为+2、-1或+4、-2):CO2、NO2、SO2、SiO2、CS2、ClO2、CaC2、MgX2、CaX2、BeCl2、BaX2、KO2等??
A2B2型的化合物:H2O2、Na2O2、C2H2等??
A2B型的化合物:H2O、H2S、Na2O、Na2S、Li2O等??
AB型的化合物:CO、NO、HX、NaX、MgO、CaO、MgS、CaS、SiC等??
能形成A2B和A2B2型化合物的元素:H、Na与O,其中属于共价化合物(液体)的是H和O[H2O和H2O2];属于离子化合物(固体)的是Na和O[Na2O和Na2O2]。??
4、常见分子的极性:??
常见的非极性分子:CO2、CS2、BF3、CH4、CCl4、、SF6、C2H4、C2H2、C6H6等?? 常见的极性分子:双原子化合物分子、H2O、H2S、NH3、H2O2、CH3Cl、CH2Cl2、CHCl3等??
5、一些物质的组成特征:??
(1)不含金属元素的离子化合物:铵盐??
(2)含有金属元素的阴离子:MnO4-、AlO2-、Cr2O72-??
(3)只含阳离子不含阴离子的物质:金属晶体
??二、物质的溶解性规律??
1、常见酸、碱、盐的溶解性规律:(限于中学常见范围内,不全面)??
①酸:只有硅酸(H2SiO3或原硅酸H4SiO4)难溶,其他均可溶;??
②碱:只有NaOH、KOH、Ba(OH)2可溶,Ca(OH)2微溶,其它均难溶。??
③盐:钠盐、钾盐、铵盐、硝酸盐均可溶;?? 硫酸盐:仅硫酸钡、硫酸铅难溶、硫酸钙、硫酸银微溶,其它均可溶;?? 氯化物:仅氯化银难溶,其它均可溶;?? 碳酸盐、亚硫酸盐、硫化物:仅它们的钾、钠、铵盐可溶。
④磷酸二氢盐几乎都可溶,磷酸氢盐和磷酸的正盐则仅有钾、钠、铵可溶。
⑤碳酸盐的溶解性规律:正盐若易溶,则其碳酸氢盐的溶解度小于正盐(如碳酸氢钠溶解度小于碳酸钠);正盐若难溶,则其碳酸氢盐的溶解度大于正盐(如碳酸氢钙的溶解度大于碳
酸钙)。??
2、气体的溶解性:??
①极易溶于水的气体:HX、NH3??
②能溶于水,但溶解度不大的气体:O2(微溶)、CO2(1:1)、Cl2(1:2)、??H2S(1:2.6)、SO2(1:40)??
③常见的难溶于水的气体:H2、N2、NO、CO、CH4、C2H4、C2H2??
④氯气难溶于饱和NaCl溶液,因此可用排饱和NaCl溶液收集氯气,也可用饱和NaCl溶液吸收氯气中的氯化氢杂质。??
3、硫和白磷(P4)不溶于水,微溶于酒精,易溶于二硫化碳。??
4、卤素单质(Cl2、Br2、I2)在水中溶解度不大,但易溶于酒精、汽油、苯、四氯化碳等有机溶剂,故常用有机溶剂来萃取水溶液中的卤素单质(注意萃取剂的选用原则:不互溶、不反应,从难溶向易溶;酒精和裂化汽油不可做萃取剂)。??
5、有机化合物中多数不易溶于水,而易溶于有机溶剂。在水中的溶解性不大:烃、卤代烃、酯、多糖不溶于水;醇、醛、羧酸、低聚糖可溶于水(乙醇、乙醛、乙酸等和水以任意比例互溶),但随着分子中烃基的增大,其溶解度减小(憎水基和亲水基的作用);苯酚低温下在水中不易溶解,但随温度高,溶解度增大,高于70℃时与水以任意比例互溶。??
6、相似相溶原理:极性溶质易溶于极性溶剂,非极性溶质易溶于非极性溶剂。??
三、常见物质的颜色:??
1、有色气体单质:F2(浅黄绿色)、Cl2(黄绿色)?、O3(淡蓝色)??
2、其他有色单质:Br2(深红色液体)、I2(紫黑色固体)、S(淡黄色固体)、Cu(紫红色固体)、Au(金黄色固体)、P(白磷是白色固体,红磷是赤红色固体)、Si(灰黑色晶体)、C(黑色粉未)??
3、无色气体单质:N2、O2、H2、希有气体单质
4、有色气体化合物:NO2??
5、黄色固体:S、FeS2(愚人金,金黄色)、、Na2O2、Ag3PO4、AgBr、AgI??
6、黑色固体:FeO、Fe3O4、MnO2、C、CuS、PbS、CuO(最常见的黑色粉末为MnO2和
C)??
7、红色固体:Fe(OH)3、Fe2O3、Cu2O、Cu??
8、蓝色固体:五水合硫酸铜(胆矾或蓝矾)化学式: ??
9、绿色固体:七水合硫酸亚铁(绿矾)化学式: ??
10、紫黑色固体:KMnO4、碘单质。??
11、白色沉淀: Fe(OH)2、CaCO3、BaSO4、AgCl、BaSO3、Mg(OH)2、Al(OH)3??
12、有色离子(溶液)Cu2+(浓溶液为绿色,稀溶液为蓝色)、Fe2+(浅绿色)、Fe3+(棕黄色)、MnO4-(紫红色)、Fe(SCN)2+(血红色)??
13、不溶于稀酸的白色沉淀:AgCl、BaSO4??
14、不溶于稀酸的黄色沉淀:S、AgBr、AgI[来源:高考%资源网 KS%5U]??
四、常见物质的状态??
1、常温下为气体的单质只有H2、N2、O2(O3)、F2、Cl2(稀有气体单质除外)??
2、常温下为液体的单质:Br2、Hg??
3、常温下常见的无色液体化合物:H2O H2O2??
4、常见的气体化合物: NH3、HX(F、Cl、Br、I)、H2S、CO、CO2、NO、NO2、SO2??
5、有机物中的气态烃CxHy(x≤4);含氧有机化合物中只有甲醛(HCHO)常温下是气态,
卤代烃中一氯甲烷和一氯乙烷为气体。??
6、常见的固体单质:I2、S、P、C、Si、金属单质;??
7、白色胶状沉淀[Al(OH)3、H4SiO4]??
五、常见物质的气味??
1、有臭鸡蛋气味的气体:H2S??
2、有刺激性气味的气体:Cl2、SO2、NO2、HX、NH3??
3、有刺激性气味的液体:浓盐酸、浓硝酸、浓氨水、氯水、溴水??
4、许多有机物都有气味(如苯、汽油、醇、醛、羧酸、酯等)??
六、常见的有毒物质??
1、非金属单质有毒的:Cl2、Br2、I2、F2、S、P4,金属单质中的汞为剧毒。??
2、常见的有毒化合物:CO、NO、NO2、SO2、H2S、偏磷酸(HPO3)、氰化物(CN-)、亚硝酸盐(NO2-);重金属盐(Cu、Hg、Cr、Ba、Co、Pb等);??
3、能与血红蛋白结合的是CO和NO??4、常见的有毒有机物:甲醇(CH3OH)俗称工业酒精;苯酚;甲醛(HCHO)和苯(致癌物,是家庭装修的主污染物);硝基苯。
??七、常见的污染物??
1、大气污染物:Cl2、CO、H2S、氮的氧化物、SO2、氟利昂、固体粉尘等;??
2、水污染:酸、碱、化肥、农药、有机磷、重金属离子等。??
3、土壤污染:化肥、农药、塑料制品、废电池、重金属盐、无机阴离子(NO2-、F-、CN-等)??
4、几种常见的环境污染现象及引起污染的物质:??①煤气中毒—— 一氧化碳(CO)??②光化学污染(光化学烟雾)——氮的氧化物??③酸雨——主要由SO2引起??④温室效应——主要是二氧化碳,另外甲烷、氟氯烃、N2O也是温室效应气体。??⑤臭氧层破坏——氟利昂(氟氯代烃的总称)、氮的氧化物(NO和NO2)??⑥水的富养化(绿藻、蓝藻、赤潮、水华等)——有机磷化合物、氮化合物等。??⑦白色污染——塑料。??
八、常见的漂白剂:
1、强氧化型漂白剂:利用自身的强氧化性破坏有色物质使它们变为无色物质,这种漂白一般是不可逆的、彻底的。??
(1)次氧酸(HClO):一般可由氯气与水反应生成,但由于它不稳定,见光易分解,不能长期保存。因此工业上一般是用氯气与石灰乳反应制成漂粉精:?? 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O??漂粉精的组成可用式子:Ca(OH)2?3CaCl(ClO)?nH2O来表示,可看作是CaCl2、Ca(ClO)2、Ca(OH)2以及结晶水的混合物,其中的有效成分是Ca(ClO)2,它是一种稳定的化合物,可以长期保存,使用时加入水和酸(或通入CO2),即可以产生次氯酸;Ca(ClO)2+2HCl=CaCl2+2HClO,Ca(ClO)2+CO2+H2O=CaCO3+2HClO。漂粉精露置于空气中久了会失效,因此应密封保存。??
(2)过氧化氢(H2O2):也是一种强氧化剂,可氧化破坏有色物质。其特点是还原产物是水,不会造成污染。??
(3)臭氧(O3)具有极强的氧化性,可以氧化有色物质使其褪色。??
(4)浓硝酸(HNO3):也是一种强氧化剂,但由于其强酸性,一般不用于漂白。??
(5)过氧化钠(Na2O2):本身具有强氧化性,特别是与水反应时新生成的氧气氧化性更强,可以使有机物褪色。??
2、加合型漂白剂:以二氧化硫为典型例子,这类物质能与一些有色物质化合产生不稳定的无色物质,从而达到漂白的目的,但这种化合是不稳定的,是可逆的。如SO2可以使品红试褪色,但加热排出二氧化硫后会重新变为红色。另外,此类漂白剂具有较强的选择性,只能使某些有色物质褪色。[中学只讲二氧化硫使品红褪色,别的没有,注意它不能使石蕊褪色,而是变红。]??
3、吸附型漂白剂:这类物质一般是一些具有疏松多孔型的物质,表面积较大,因此具有较强的吸附能力,能够吸附一些色素,从而达到漂白的目的,它的原理与前两者不同,只是一种物理过程而不是化学变化,常见的这类物质如活性炭、胶体等。??[注意]所谓漂白,指的是使有机色素褪色。无机有色物质褪色不可称为漂白。??
九、常见的化学公式:??
1、原子的相对原子质量的计算公式: ??
2、溶液中溶质的质量分数: ??
3、固体的溶解度: (单位为克)??
4、物质的量计算公式(万能恒等式): (注意单位)
5、求物质摩尔质量的计算公式:??
①由标准状况下气体的密度求气体的摩尔质量:M=ρ×22.4L/mol??
②由气体的相对密度求气体的摩尔质量:M(A)=D×M(B)??
③由单个粒子的质量求摩尔质量:M=NA×ma??
④摩尔质量的基本计算公式:
⑤混合物的平均摩尔质量: ??(M1、M2……为各成分的摩尔质量,a1、a2为各成分的物质的量分数,若是气体,也 可以是体积分数)
-
高中化学知识点总结人教版
化学一物理性质1有色气体F2淡黄绿色Cl2黄绿色Br2g红棕色I2g紫红色NO2红棕色O3淡蓝色其余均为无色气体其它物质的颜色见会…
-
高中化学选修一知识点总结
《选修1·化学与生活》第一章关注营养平衡第一节生命的基础能源—糖类1、糖类是绿色植物光合作用的产物。由C、H、O三种元素组成的一类…
-
高中化学必修一知识点总结
必修1全册基本内容梳理从实验学化学一化学实验安全11做有毒气体的实验时应在通风厨中进行并注意对尾气进行适当处理吸收或点燃等进行易燃…
-
高中化学选修3知识点全部归纳
高中化学选修3知识点全部归纳物质的结构与性质第一章原子结构与性质一认识原子核外电子运动状态了解电子云电子层能层原子轨道能级的含义1…
-
高中化学必修一知识点总结 精简版
第一章从实验学化学一化学实验安全11做有毒气体的实验时应在通风厨中进行并注意对尾气进行适当处理吸收或点燃等进行易燃易爆气体的实验时…
-
高中化学选修一知识点总结
《选修1·化学与生活》第一章关注营养平衡第一节生命的基础能源—糖类1、糖类是绿色植物光合作用的产物。由C、H、O三种元素组成的一类…
-
高中化学重点知识点总结
高中化学知识点总结必修一引言1、知道化学科学的主要研究对象和发展趋势2、能列举一些对化学科学发展有重大贡献的科学家及其成就3、知道…
-
高中化学必修一知识点总结 -4
24、烃①有机物a、概念:含碳的化合物,除CO、CO2、碳酸盐等无机物外b、结构特点:ⅰ、碳原子最外层有4个电子,一定形成四根共价…
-
高中化学必修一知识点总结
必修1全册基本内容梳理从实验学化学一化学实验安全11做有毒气体的实验时应在通风厨中进行并注意对尾气进行适当处理吸收或点燃等进行易燃…
-
高中化学选修4知识点归纳总结
高中化学选修4知识点归纳总结第一章化学反应与能量一焓变反应热1反应热一定条件下一定物质的量的反应物之间完全反应所放出或吸收的热量2…
-
选修四_电化学基础知识点总结20xx-11-20
电化学基础知识点总结1原电池及其应用11原电池原理111原电池装置构成两个活泼性不同的电极电解质溶液或熔融的电解质说明原电池的两极…