必修2第一章物质结构元素周期律知识点归纳与针对性练习
鑫榜教育高一必修2
第一章 物质结构 元素周期律知识点归纳与针对性练习
第一节 元素周期表
一.元素周期表的结构
周期序数=核外电子层数 主族序数=最外层电子数
原子序数 = 核电荷数 = 质子数 = 核外电子数
 短周期(第1、2、3周期)
短周期(第1、2、3周期)
 周期:7个(共七个横行)
周期:7个(共七个横行)
周期表 长周期(第4、5、6、7周期)
 主族7个:ⅠA-ⅦA
主族7个:ⅠA-ⅦA
族:16个(共18个纵行)副族7个:IB-ⅦB
第Ⅷ族1个(3个纵行)
零族(1个)稀有气体元素
【练习】
1.主族元素的次外层电子数(除氢)
A.一定是8个 B.一定是2个
C.一定是18个 D.是2个、8个或18个
2.若某ⅡB族元素原子序数为x,那么原子序数为x+1的元素位于
A.ⅢB族 B.ⅢA族 C.ⅠB族 D.ⅠA族
3.已知A元素原子的最外层电子数是次外层电子数的3倍,B元素原子的次外层电子数是最外层电子数的2倍,则A、B元素
A.一定是第二周期元素 B.一定是同一主族元素
C.可能是二、三周期元素 D.可以相互化合形成化合物
二.元素的性质和原子结构
(一)碱金属元素:
 1.原子结构 相似性:最外层电子数相同,都为_______个
1.原子结构 相似性:最外层电子数相同,都为_______个
递变性:从上到下,随着核电核数的增大,电子层数增多

 2.碱金属化学性质的相似性:
2.碱金属化学性质的相似性:
4Li + O2 Li2O 2Na + O2 Na2O2
2 Na + 2H2O = 2NaOH + H2↑ 2K + 2H2O = 2KOH + H2↑
2R + 2 H2O = 2 ROH + H2 ↑
产物中,碱金属元素的化合价都为+1价。
结论:碱金属元素原子的最外层上都只有_______个电子,因此,它们的化学性质相似。
3.碱金属化学性质的递变性:
递变性:从上到下(从Li到Cs),随着核电核数的增加,碱金属原子的电子层数逐渐增多,原子核对最外层电子的引力逐渐减弱,原子失去电子的能力增强,即金属性逐渐增强。所以从Li到Cs的金属性逐渐增强。
结论:1)原子结构的递变性导致化学性质的递变性。
2)金属性强弱的判断依据:与水或酸反应越容易,金属性越强;最高价氧化物对应的水化物(氢氧化物)碱性越强,金属性越强。
4.碱金属物理性质的相似性和递变性:
1)相似性:银白色固体、硬度小、密度小(轻金属)、熔点低、易导热、导电、有展性。
2)递变性(从锂到铯):
①密度逐渐增大(K反常) ②熔点、沸点逐渐降低
3)碱金属原子结构的相似性和递变性,导致物理性质同样存在相似性和递变性。
小结:碱金属原子结构的相似性和递变性,导致了碱金属化学性质、物理性质的相似性和递变性。
递变性:同主族从上到下,随着核电核数的增加,电子层数逐渐_______,原子核对最外层电子的引力逐渐________,原子失去电子的能力________,即金属性逐渐_______。
【练习】
4.关于碱金属元素的下列叙述中,错误的是( )
A.碱金属元素原子最外层都只有1个电子
B.依Li、Na、K、Rb、Cs,单质熔沸点升高,密度增大
C.随核电荷数递增,氢氧化物碱性增强
D.随电子层数增加,原子半径增大,金属还原性增强
5.关于钠和钾元素的比较中,不正确的是( )
A.钾原子失电子比钠原子容易 B.钾离子氧化性比钠离子强
C.钾与水反应比钠剧烈 D.KOH碱性比NaOH强
6.下列关于碱金属的叙述中正确的是( )
A.碱金属单质与水反应都能生成碱和H2
B.碱金属单质都是质软、熔点低、密度均小于1的轻金属
C.碱金属元素随原子半径增大,原子核吸引最外层电子的能力增强
D.碱金属单质在空气中燃烧都生成过氧化物
(二)卤族元素:
 1.原子结构 相似性:最外层电子数相同,都为_________个
1.原子结构 相似性:最外层电子数相同,都为_________个
递变性:从上到下,随着核电核数的增大,电子层数增多
2.卤素单质物理性质的递变性:(从F2到I2)
(1)卤素单质的颜色逐渐加深;(2)密度逐渐增大;(3)单质的熔、沸点升高
3.卤素单质与氢气的反应: X2 + H2 = 2 HX

卤素单质与H2 的剧烈程度:依次减弱 ; 生成的氢化物的稳定性:依次减弱
4.卤素单质间的置换
2NaBr +Cl2 =2NaCl + Br2 氧化性:Cl2________Br2 ; 还原性:Cl-_____Br-
2NaI +Cl2 =2NaCl + I2 氧化性:Cl2_______I2 ; 还原性:Cl-_____I-
2NaI +Br2 =2NaBr + I2 氧化性:Br2_______I2 ; 还原性:Br-______I-
结论: 
单质的氧化性:依次减弱,对于阴离子的还原性:依次增强
5. 非金属性的强弱的判断依据:
1. 从最高价氧化物的水化物的酸性强弱,或与H2反应的难易程度以及氢化物的稳定性来判断。
2. 同主族从上到下,金属性和非金属性的递变:
同主族从上到下,随着核电核数的增加,电子层数逐渐增多,原子核对最外层电子的引力逐渐________,原子得电子的能力________,失电子的能力________,即非金属性逐渐_______,金属性逐渐__________。
3. 原子结构和元素性质的关系:
原子结构决定元素性质,元素性质反应原子结构。
同主族原子结构的相似性和递变性决定了同主族元素性质的相似性和递变性。
【练习】
7.a、b、c、d四个集气瓶中装有Cl2、H2、HCl、HBr中的任一种气体,若a、d两瓶气体混合后强光照射下发生爆炸,a、b两瓶气体相混,瓶壁上出现红棕色液滴,则a、b、c、d四瓶中气体应是( )
A.Cl2、HBr、HCl、H2 B.Cl2、HCl、HBr、H2
C.H2、HBr、HCl、Cl2 D.H2、HCl、HBr、Cl2
8.某溶液中Cl-、Br-、I-三种离子物质的量之比是1︰2︰3,通入一定量Cl2充分反应后,该比值为3︰2︰1,则通入Cl2和原溶液中I-离子物质的量之比是( )
A.1︰1 B.1︰2 C.1︰3 D.1︰4
9.砹(At)原子序数85,与F、Cl、Br、I同族,推测砹或砹的化合物不可能具有的性质是( )
A.砹是有色固体 B.非金属性:At>I
C.HAt非常稳定 D.I2 可以At从At的可溶性的盐溶液置换出来。
三.核素
(一)原子的构成:
(1)原子的质量主要集中在原子核上。
(2)质子和中子的相对质量都近似为1,电子的质量可忽略。
(3)原子序数 = 核电核数 = 质子数 = 核外电子数
(4)质量数(A)=质子数(Z)+中子数(N)
 (5)在化学上,我们用符号
(5)在化学上,我们用符号
 X来表示一个质量数为
A,质子数为
Z的具体的X原子。
X来表示一个质量数为
A,质子数为
Z的具体的X原子。

【练习】
10.下列叙述中正确的是( )
A.氢有三种同位素,即有三种氢原子 B.所有元素的原子核均由质子和中子构成
C.具有相同的核外电子数的粒子,总称为元素 D. H是一种同位素
H是一种同位素
11.在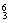 Li、
Li、 N、
N、 Na、
Na、 Mg、
Mg、 Li、
Li、 C中:
C中:
(1) 和 互为同位素。
(2) 和 质量数相等,但不能互称同位素。
(3) 和 的中子数相等,但质子数不相等,所以不是同一种元素。
(二)核素
核素:把具有一定数目的质子和一定数目的中子的一种原子称为核素。一种原子即为一种核素。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
或:同一种元素的不同核素间互称为同位素。
(1)两 同:质子数相同、同一元素
(2)两不同:中子数不同、质量数不同
(3)属于同一种元素的不同种原子
【练习】
12.在过氧化钠中含有
 ,各数字所表示的意义是:16 、8 、2- 、2 、-1 。
,各数字所表示的意义是:16 、8 、2- 、2 、-1 。
13.元素X的一种同位素 X,元素Y的一种同位素
X,元素Y的一种同位素 Y,已知a>c,b>d,则元素X和Y的相对原子质量的大小关系为( )
Y,已知a>c,b>d,则元素X和Y的相对原子质量的大小关系为( )
A.X>Y B.X=Y
C.X<Y D.不能确定
第二节 元素周期律
一.原子核外电子的排布
1.在多个电子的原子里,核外电子是分层运动的,又叫电子分层排布。

2.电子总是尽先排布在能量最低的电子层里。
3.核外电子的排布规律
(1)各电子层最多容纳的电子数是2n2(n表示电子层)
(2)最外层电子数不超过8个(K层是最外层时,最多不超过2个);次外层电子数目不超过18个;倒数第三层不超过32个。
(3)核外电子总是尽先排布在能量最低的电子层,然后由里向外从能量低的电子层逐步向能量高的电子层排布。
【练习】14.填写下表:

15.判断下列示意图是否正确?为什么?

16.填空
(1)当质子数(核电荷数)=核外电子数时,该粒子是 , 电性。
(2)当质子数(核电荷数)>核外电子数时,该粒子是 离子,带 电荷。
(3)当质子数(核电荷数)<核外电子数时,该粒子是 离子,带 电荷。
二.元素周期律:
1.核外电子层排布:
随着原子序数的递增,每隔一定数目的元素,会重复出现原子“最外层电子从_______个递增到_________个的情况(K层由1-2)而达到结构的变化规律。
2.最高正化合价和最低负化合价:
随着原子序数的递增,每隔一定数目的元素,会重复出现原子最高价由

 +1 +7,中部出现负价,由-4 -1 的变化规律。
+1 +7,中部出现负价,由-4 -1 的变化规律。
(1)O、F无正价,金属无负价
(2)最高正化合价:+1→+7 最低负化合价:-4→-1→0
(3)最高正化合价=最外层电子数=主族序数
(4)最高正化合价+∣最低负化合价∣=________
(5)最高正化合价+最低负化合价= 0 、2、 4、 6
最外层电子数= 4 5 6 7
【练习】
17.在下列元素中,最高正化合价数值最大的是( )
A.Na B.P C.Cl D.Ar
18.元素X原子的最外层有3个电子,元素Y原子的最外层有6个电子,这两种元素形成的化合物的化学式可能是( )
A.XY2 B.X2Y3 C.X3Y2 D.X2Y
19.下列各组指定原子序数的元素,不能形成AB2型化合物的是( )
A.6和8 B.16和8 C.12和9 D.11和6
 三.元素金属性和非金属性的递变:
三.元素金属性和非金属性的递变:
1.2Na + 2H2O =2NaOH + H2 ↑ (容易) Mg + 2 H2O 2Mg(OH)2 + H2 ↑(较难)
金属性:Na > Mg
2.Mg + 2HCl =MgCl2 + H2 ↑ (容易) 2Al + 6 HCl = 2AlCl3 +3H2 ↑(较难)
金属性:Mg > Al 根据1、2得出: 金属性 Na > Mg > Al
3.碱性 NaOH > Mg(OH)2> Al(OH)3 金属性:金属性 Na > Mg > Al
Na Mg Al
 金属性逐渐减弱
金属性逐渐减弱
 4.结论: Si P S Cl
4.结论: Si P S Cl
单质与H2的反应越来越容易 生成的氢化物越来越稳定
最高价氧化物对应水化物的酸性逐渐增强
故:非金属性逐渐增强。
Na Mg Al Si P S Cl
 金属性逐渐减弱,非金属性逐渐增强
金属性逐渐减弱,非金属性逐渐增强
同周期从左到右,金属性逐渐减弱,非金属性逐渐增强
5.随着原子序数的递增,元素的核外电子排布、主要化合价、金属性和非金属性都呈现周期性的变化规律,这一规律叫做元素周期律。
【练习】
20.用元素符号回答原子序数11~18号的元素的有关问题。
(1)最高价氧化物的水化物碱性最强的是____ 。
(2)最高价氧化物的水化物酸性最强的是 。
(3)最容易生成氢化物且最稳定的是 。
21.从原子序数11依次增加到17,下列所叙递变关系错误的是( )
A.电子层数逐渐增多 B.原子核吸引电子的能力逐渐增强
C.最高正价数值逐渐增大 D.从硅到氯负价从-4-1
22.已知X、Y、Z为三种原子序数相连的元素,最高价氧化物对应水化物的酸性相对强弱是:HXO4>H2YO4>H3ZO4。则下列说法不正确的是( )
A.气态氢化物的稳定性:HX>H2Y>ZH3 B.非金属活泼性:Y<X<Z
C.单质的氧化性:X2>Y2>Z2 D.原子最外电子层上电子数相等
23.稳定性强弱:HF HCl HBr HI NH3 HF NH3 PH3
24.碱性强弱:KOH NaOH Mg(OH)2
25.酸性强弱:HClO4 HBrO4 HNO3 H3PO4
四、同周期、同主族金属性、非金属性的变化规律是:
1. 周期表中金属性、非金属性之间没有严格的界线。在分界线附近的元素具有金属性又具有非金属性。
2. 金属性最强的在周期表的左下角是,Cs;非金属性最强的在周期表的右上角,是F。
3.元素化合价与元素在周期表中位置的关系。
4.元素周期表和元素周期律对我们的指导作用
①在周期表中寻找新的农药。②在周期表中寻找半导体材料。③在周期表中寻找催化剂和耐高温、耐腐蚀的合金材料。
第三节 化学键
一.离子键
1.离子键:阴阳离子之间强烈的相互作用叫做离子键。
相互作用:静电作用(包含吸引和排斥)
离子化合物:像NaCl这种由离子构成的化合物叫做离子化合物。
(1)活泼金属与活泼非金属形成的化合物。如NaCl、Na2O、K2S等
(2)强碱:如NaOH、KOH、Ba(OH)2、Ca(OH)2等
(3)大多数盐:如Na2CO3、BaSO4
(4)铵盐:如NH4Cl
小结:一般含金属元素的物质(化合物)+铵盐。(一般规律)
注意:酸不是离子化合物。
离子键只存在离子化合物中,离子化合物中一定含有离子键。
2.电子式
电子式:在元素符号周围用小黑点(或×)来表示原子的最外层电子(价电子)的式子叫电子式。
用电子式表示离子化合物形成过程:
(1)离子须标明电荷数; (2)相同的原子可以合并写,相同的离子要单个写; (3)阴离子要用方括号括起; (4)不能把“→”写成“=”; (5)用箭头标明电子转移方向(也可不标)。
【练习】
27.下列说法正确的是( )
A.含有金属元素的化合物一定是离子化合物
B.ⅠA族和ⅦA族原子化合时,一定生成离子键
C.由非金属元素形成的化合物一定不是离子化合物
D.活泼金属与活泼非金属化合时,能形成离子键
28.XY2是离子化合物,X和Y离子的电子层结构都与氖原子相同,则X、Y为( )
A.Ca和Cl B.K和S C.Ca和F D.Mg和F
二.共价键
1.共价键:原子间通过共用电子对所形成的相互作用叫做共价键。

用电子式表示HCl的形成过程:

2.共价化合物:以共用电子对形成分子的化合物叫做共价化合物。
 化合物 离子化合物
化合物 离子化合物
共价化合物 化合物中不是离子化合物就是共价化合物
3.共价键的存在:
 非金属单质:H2、X2 、N2等(稀有气体除外)
非金属单质:H2、X2 、N2等(稀有气体除外)
共价化合物:H2O、 CO2 、SiO2、 H2S等
复杂离子化合物:强碱、铵盐、含氧酸盐
4.共价键的分类:
非极性键:在同种元素的原子间形成的共价键为非极性键。共用电子对不发生偏移。
极性键:在不同种元素的原子间形成的共价键为极性键。共用电子对偏向吸引能力强的一方。
【练习】
29.下列说法中正确的是( )
A.含有离子键的化合物必是离子化合物 B.具有共价键的化合物就是共价化合物
C.共价化合物可能含离子键 D.离子化合物中可能含有共价键
30.下列物质中含有共价键的离子化合物是( )
A.Ba(OH)2 B.CaCl2 C.H2O D.H2
31.下列物质的电子式书写正确的是( )

三.电子式:
定义:在元素符号周围用小黑点(或×)来表示原子的最外层电子(价电子)的式子叫电子式。
1.原子的电子式:
2.阴阳离子的电子式:
 (1)阳离子 简单阳离子:离子符号即为电子式,如Na+、、Mg2+等
(1)阳离子 简单阳离子:离子符号即为电子式,如Na+、、Mg2+等
复杂阳离子:如NH4+ 电子式:_______________
 (2)阴离子 简单阴离子:
(2)阴离子 简单阴离子: 、
、
复杂阴离子:
3.物质的电子式:
(1)离子化合物:阴、阳离子的电子式结合即为离子化合物的电子式。
AB型:NaCl__________________,MgO_________________。
A2B型:如Na2O _______________
AB2型:如MgCl2 :_________________
(2)某些非金属单质:如:Cl2______ O2_________等
(3)共价化合物:如HCl_________、CO2_____________、NH3__________、CH4_________
4.用电子式表示形成过程:


【练习】
32.下列微粒电子式错误的是( )
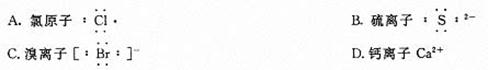
33.下列化合物电子式书写正确的是( )

34. 具有下列价电子数的原子,最难形成离子的是
A.L层6个 B.L层4个 C.M层2个 D.M层7个
35. XY2是离子化合物,X和Y离子的电子层结构都与氖原子相同,则X、Y为
A.Ca和Cl B.K和S C.Ca和F D.Mg和F
36. 下列离子化合物中,离子组成与Ne和Ar的电子层结构分别相同的是
A.NaCl B.LiI C.NaF D.CsI
37. 下列关于离子化合物的叙述正确的是
A.离子化合物中都含有离子键 B.离子化合物中的阳离子只能是金属离子
C.离子化合物如能溶于水,其水溶液一定可以导电
D.溶于水可以导电的化合物一定是离子化合物
38. 某化合物XY2中,各离子的电子层结构相同,且电子总数为54,则XY2的化学式为________________,电子式为________________。
39. X元素位于ⅡA族,原子核内有12个中子,它在最高价氧化物中的质量分数是60%,Y元素原子的原子核外有9个电子,X与Y能形成稳定化合物,该化合物的化学式是________,它是通过________键结合的,它形成过程的电子式为_____________。
40. A元素原子的L层比B元素原子的L层少3个电子,B元素原子核外电子数比A元素总电子数多5个,则A、B可形成
A.共价化合物B2A3 B.离子化合物B2A3 C.共价化合物B3A2 D.离子化合物B3A2
41. 下列4组原子序数的元素,彼此间能形成共价键的是
A.6和16 B.8和13 C.15和17 D.12和35
42. 下列化合物全部以共用电子对成键的是
A.NH3 B.Ba(OH)2 C.MgCl2 D.NH4Cl
43. 下列每组中各物质内既有离子键又有共价键的一组是
A.NaOH、H2SO4、(NH4)2SO4 B.MgO、Na2SO4、NH4HCO3
C.Na2O2、KOH、Na2SO4 D.HCl、Al2O3、MgCl2
44. 下列叙述中,不正确的是
A.共价化合物中不可能含有离子键
B.硫酸分子中有H+和SO 两种离子
两种离子
C.某元素原子的最外层只有一个电子,它跟卤素可能形成离子键,也可能形成共价键
D.离子键和共价键的实质都是电性的相互作用
45. 在CaCl2、KOH、CO2、H2SO4、Na2O2、Na2S中,只含有离子键的是_________,只含有共价键的是_________,既含有离子键又含有共价键的是________。 。
46. 按要求写出:
(1)一核10电子的原子的电子式_____________________________;
(2)一核10电子的阳离子的符号_____________________________;
(3)一核10电子的阴离子的电子式___________________________;
(4)两核10电子的共价化合物的化学式_______________________;
(5)三核10电子的共价化合物的电子式_______________________;
(6)四核10电子的阳离子的电子式___________________________;
(7)四核10电子的共价化合物的结构式_______________________;
(8)五核10电子的阳离子的电子式___________________________;
(9)五核10电子的共价化合物的结构式_______________________。
-
高中生物必修一第一章知识点总结
第一章走近细胞第一节从生物圈到细胞1病毒没有细胞结构,必须依赖(活细胞)才能生存和繁殖。生活方式:寄生在活细胞病毒分类:DNA病毒…
-
高中生物必修一第一章知识点总结
第一章走进细胞核心概念第一节从生物圈到细胞生物学事实一生命活动离不开细胞1单细胞生物草履虫就能完成各项生命活动2多细胞生物依赖各种…
-
高一生物必修一第一章知识点总结
第一章第一节从生物圈到细胞1细胞是生物体结构和功能的基本单位除了病毒以外所有生物都是由细胞构成的2生物的生命活动离不开细胞对于单细…
-
高中生物必修一知识点总结(20xx版)
高一生物考试重要知识点第一章走近细胞第一节从生物圈到细胞1病毒没有细胞结构但必须依赖活细胞才能生存寄生在活细胞中利用细胞里的物质结…
-
高一生物必修一知识点总结(整理版)
必修(1)知识点整理第一章走近细胞第一节从生物圈到细胞一、相关概念、细胞:是生物体结构和功能的基本单位。除了病毒以外,所有生物都是…
-
元素周期表知识点总结
第一章物质结构元素周期律第一节元素周期表知识回顾:1、原子的结构:???原子是由原子核和电子组成;原子核由质子和中子组成原子的质量…
-
元素周期律和元素周期表知识总结
考试大纲要求1.理解原子的组成及同位素的概念。掌握原子序数、核电荷数、质子数、中子数、核外电子数,以及质量数与质子数、中子数之间的…
-
原子结构元素周期律知识总结
原子结构元素周期律知识总结一、原子结构1.几个量的关系(X)质量数(A)=质子数(Z)+中子数(N)质子数=核电荷数=原子序数=原…
-
元素周期表与元素周期律知识点归纳
元素周期表与元素周期律知识点归纳1、元素周期表共有、类为、、。长周期包括、、。所含元素种类为、、。第七周期为不完全周期,如果排满的…
-
元素周期表知识点总结
第一章物质结构元素周期律第一节元素周期表一原子结构1原子核的构成核电荷数Z核内质子数核外电子数原子序数2质量数将原子核内所有的质子…
-
高一化学期末复习元素化合物知识总结
元素化合物知识总结一、写出下列主族元素的元素符号和名称:1、碱金属元素:2、卤族元素:3、氧族元素:4、碳族元素:5、氮族元素:二…