20xx年南平市中小学教师公开招聘考试无机化学推断题知识总结
20##年南平市中小学教师公开招聘考试无机化学推断题知识总结
(一)化学中物质的颜色种类较多,但分散在各个知识中,比较零碎,而在物质推断题中常常用到颜色进行分析和判断,为了便于查找和记忆,中公讲师刘子沛将规类总结如下:
1.黄色
黄色:AgI、Ag3PO4、P4(黄磷)、溴水(黄→橙)、FeS2、Al2S3、甲基橙在弱酸性、中性或碱性环境中、某些蛋白质加浓硝酸。
淡黄色:S、Na2O2、TNT、PCl5、AgBr、浓HNO3(混有NO2)、浓HCl(混有Fe3+)、(混有NO2)。
灰黄色:Mg3N2
棕黄色:FeCl3溶液、碘水(深黄→褐)。
2.黑色:CuS、Ag2S、Cu2S、HgS(黑色或红色)、FeS、FeO、Fe3O4、MnO2、CuO、Ag2O、I2(紫黑色)、Si(灰黑色)、C、Ag(粉末)、KMnO4(固体)、石油。
3.绿色:CuCl2溶液、Cu2(OH)2CO3、FeSO4·7H2O(浅绿色)、F2(淡黄绿色)、Cl2(黄绿色)、氯水(淡黄绿色)。
4.红色:Cu2O、Cu、甲基橙在酸性环境中、紫色石蕊试液在酸性环境中、酚酞在碱性环境中、品红试液、Fe(SCN)2+、Br2(深红棕)、红磷(暗红)、Br2的CCl4溶液(紫红)、苯酚被空气氧化(粉红)。
5.棕色:固体FeCl3、固体CuCl2、NO2(红棕)、Fe2O3(红棕)。
6.紫色:KMnO4溶液、I2的CCl4溶液。
7.灰色:As、Sn、Fe3C。
8.褐色:碘酒、2Fe2O3·3H2O、Fe(OH)3(红褐)。
9.蓝色:CuSO4·5H2O、Cu(OH)2、淀粉遇碘、紫色石蕊试液加碱、Cu2+的稀溶液。
(二)无机推断知识规律
1.同一元素的气态氢化物和气态氧化物反应,生成该元素的单质和水,元素可能是硫或氮。
2.同一元素的气态氢化物和最高价氧化物对应的水化物化合,生成盐的元素一定是氮。
3.两溶液混合生成沉淀和气体,这两种溶液的溶质可能分别是①Ba(OH)2与(NH4)2SO,;②可溶性铝盐与可溶性金属硫化物或可溶性碳酸盐或碳酸氢盐;③可溶性铁盐与可溶性碳酸盐或碳酸氢盐;④硫代硫酸盐与强酸(如盐酸、稀H2S04等)。
4.既能与酸反应,又能与碱反应的物质可能是Al、A1203,Al(OH)3,氨基酸,弱酸的铵盐、弱酸的酸式盐等。
5.既能与强酸反应放出气体又能与强碱反应放出气体,常见的物质有:AI,弱酸的铵盐[如(NH4)2C03、NH4HC03、(NH4)2SO3、(NH4)2S、NH4HS等]。
6.在水中分解生成气体和难溶物或微溶物的物质可能是A12S3、Mg3N2、CaC2等。
7.与水接触放出气体的常见物质有:Li、Na、K、Na202、F2等。
8.A物质加到B物质中,先生成沉淀,后沉淀又溶解,A、B可能分别是CO2与Ca(OH)2、NaOH与铝盐、NH3与AgN03、HCI与NaAl02、稀盐酸与Fe(OH)2胶体等。
9.使溴水褪色的物质有H2S、SO2、不饱和烃类、活泼金属、碱类等。
10.特殊的实验现象
①H2在C12中燃烧呈苍白色火焰。
②钠元素焰色反应为黄色;钾元素焰色反应为紫色(透过蓝色钴玻璃)。
③遇酚酞变红的气体必是氨气。
④在空气中迅速由无色变为红棕色的气体是NO。
⑤使品红褪色的气体可能是C12或S02,物质可能是次氯酸盐NaCIO、Ca(CIO)2、氯水、Na202等。
⑥在C12中燃烧生成白色烟雾的是磷。
(三)常见无机推断20“眼”
1.紧紧围绕几个常见
常见非金属:H2、02、C、Si、N2、P、S、C12
常见金属:Na、Mg、Al、Fe
2.10电子
10电子分子:NH3、CH4、HF、H20
10电子阴离子:OH一、NH2-、F一、02-、N3—
10电子阳离子:NH4+、H30+、Na+、Mg2+、A13+
3.18电子
18电子分子:PH3、SiH4、H2S、HCl、C2H6、H202、F2、CH3OH、CH3F
18电子离子:Cl一、S2一、K+、Ca2+、HS一
4.三个常温液态
唯一的非金属液体单质:Br2唯一的液态金属:Hg
常温下的液态化合物H20、H2S04、HNO3等
5.常见物质的颜色
白色:Fe(OH)2、Mg(OH)2、Al(OH)3、AgCl、BaS04、CaCO3、BaCO3
其中AgCl、BaS04不溶于硝酸。
黑色物质:C、CuO、MnO2、FeO、Fe3O4、铁粉,其中Fe3O4是黑色晶体。
淡黄色:S、NO2、AgBr(沉淀)、AgI(沉淀)
红褐色:Fe(OH)3,蓝色:Cu(OH)2,可溶性Fe2+浅黄绿色,可溶性Fe3+黄色,可溶性Cu2+蓝色,Fe(SCN)3血红色,KMnO4紫黑色。
6.5个催化。
(1)氨的合成;(3)氨的催化氧化;(3)S02氧化成SO3;(4)H2O2的分解;(5)KClO3的受热分解。
7.7个高温
(1)合成氨;(2)水煤气;(3)铁与水(气);(4)还原性物质(H2、CO、C)与金属氧化物、非金属氧化物(C02、SiO2);(4)CaCO3的受热分解;(5)煅烧硫铁矿;(6)铝热反应;(7)硅酸盐工业。
8.4个化工
(1)硫酸的工业制法;(2)合成氨工业;(3)氯碱工业;(4)硅酸盐工业。
9.气体
(1)有刺激性气味的气体:HCI、HBr、NH3、SO2、H2S、NO、NO2
(2)无色无味的气体:H2、O2、N2、CO2、CO、CH4、C2H2
(3)有颜色有刺激性气味的气体:C12、NO2
(4)使品红褪色、加热后恢复的是SO2
(5)使湿润的红色石蕊试纸变蓝的是NH3
(6)使湿润的Pb(Ac)2试纸变黑的是H2S
(7)在空气中燃烧呈蓝色的气体有:H2、H2S、CH4、CO
(8)能与水反应的是C12、F2、NO2
10.钠元素的焰色反应呈黄色;钾元素的焰色反应呈紫色。
11.受热分解成三种物质的有:碳酸氢盐、碳酸铵、KMnO4、Cu2(OH)2CO3、铜之后的硝酸盐。
12.既能溶于强酸又能溶于强碱的是:
(1)单质:Al、Zn、Be
(2)氧化物:A12O3、ZnO、BeO
(3)氢氧化物:Al(OH)3、Zn(OH)2、Be(OH)2
(4)酸式弱酸强碱盐
(5)弱酸的铵盐
13.只溶于强碱不溶于强酸的是:Si
14.二个电解:电解氯化钠、电解熔融的氧化铝。
15.不溶于强酸的是:AgCl、BaSO4、H2SiO3、CuS。
16.加过量盐酸后得到胶状沉淀的是硅酸盐。
17.先加盐酸沉淀,后又溶解的是NaAlO2;先加NaOH沉淀,后又溶解的是A1C13
18.溶于水生成一种沉淀、一种气体的有Mg3N2、A12S3、双水解彻底的弱酸弱碱盐;两种化合物的水溶液反应产生一种沉淀、一种气体的是:盐酸与Na2S2O3;(NH4)2SO4与Ba(OH)2。
19.存在,说明存在着可变价态,一般而言是Fe2+→Fe3+的变化;或C、N、S、P氧化物或氯化物之间的转化。
20.使淀粉溶液变蓝的是I2,能使湿润的KI一淀粉试纸变蓝的气体是Cl2、Br2蒸气、NO2。
中公教育南平分校官网:http://nanping.offcn.com/
第二篇:无机化学推断题规律总结
高考化学推断题解题步骤与答题技巧
一、无机推断题
无机推断题的形式通常有文字描述推断、文字描述与反应式结合推断和框图题等。无机推断题是集元素化合物知识、基本概念和基本理论于一体,且综合性强、考查知识面广、思维容量大、题型多变、能力要求高、推理严密,既能检查学生掌握元素化合物的知识量及熟练程度,又能考查学生的逻辑思维能力,在历年高考中频频出现,且体现出很好的区分度和选拔功能。无机推断题考查内容及命题主要呈现如下趋势:
1. 限定范围推断:主要适用于气体或离子的推断,该类题目的主要特点是在一定范围内,根据题目给出的实验现象(或必要的数据)进行分析,作出正确判断。解题关键:①审明题意,明确范围,注意题目所给的限定条件;②紧扣现象,正确判断;③要注意数据对推断结论的影响。
2. 不定范围推断:常见元素化合物的推断。该题目的主要特点是:依据元素化合物之间相互转化时所产生的一系列实验现象,进行推理判断,确定有关的物质。题目往往综合性较强,具有一定的难度。从试题形式来看,有叙述型、图表型等。解题关键:见题后先迅速浏览一遍,由模糊的一遍“扫描”,自然地在头脑中产生一个关于该题所涉及知识范围等方面的整体印象,然后从题中找出特殊现象或特殊性质的描述,作为解题的突破口,进而全面分析比较,作出正确判断。
3. 给出微粒结构等的微粒(或元素)推断题。解题关键:①熟记元素符号,直接导出;②掌握几种关系,列式导出;③利用排布规律,逐层导出;④弄清带电原因,分析导出;⑤抓住元素特征,综合导出;⑥根据量的关系,计算导出。
4. 给出混合物可能组成的框图型(或叙述型)推断题。解题关键:解框图型(或叙述型)推断题一般是根据物质的转化关系,从其中一种来推知另一种(顺推或逆推),或找出现象明显、易于推断的一种物质,然后左右展开;有时需试探求解,最后验证。
5. 给出物质间转化关系的代码型推断题。解题关键:此类推断题的特点是用代号表示各物质的转化关系,要求“破译”出各物质的分子式或名称等,看起来较复杂,其实在解题时,只要挖掘题眼,顺藤摸瓜,便可一举攻克。
6. 给出物质范围的表格型推断题。解题关键:列表分析,对号入座;直观明快,谨防漏解。 总之,解无机推断题的步骤是:首先,读审——仔细读题、审清题意。即弄清题意和要求,明确已知和未知条件,找出明显条件和隐蔽条件。其次,找突破口或“题眼”——通过分析结构特征、性质特征、反应特征和现象特征及特征数据等等,确定某一物质或成分的存在,以此作解题突破口。第三,推理——从突破口向外扩展,通过顺推法、逆推法、假设法得出初步结论,最后作全面检查,验证推论是否符合题意。
二、有机推断题
有机推断和合成题可以全面考查学生对有机物的结构、性质、合成方法、反应条件的选择等知
识掌握的程度和应用水平,又能考查学生的自学能力、观察能力、综合分析能力、逻辑思维能力,同时可与所给信息紧密结合,要求迁移应用,因此成为高考的热点。有机推断是一类综合性强,思维容量大的题型,其一般形式是推物质,写用语,判性质。当然,有的只要求推出有机物,有的则要求根据分子式推同分异构体,确定物质的结构;有的还要求写出有机化学方程式。由于有机化学中普遍存在同分异构现象,而有机物的分子式不能表示具体的物质,因此用语中特别强调写出有机物质的结构简式。
有机推断题所提供的条件有两类,一类是有机物的性质及相互关系(也可能有数据),这类题要求直接推断物质的名称,并写出结构简式;另一类则通过化学计算(也告诉一些物质性质)进行推断,一般是先求出相对分子质量,再求分子式,根据性质确定物质,最后写化学用语。有机推断应以特征点为解题突破口,按照已知条件建立的知识结构,结合信息和相关知识进行推理、计算、排除干扰,最后做出正确推断。一般可采用顺推法、逆推法、多法结合推断,顺藤摸瓜,问题就迎刃而解了。其解题思路为:
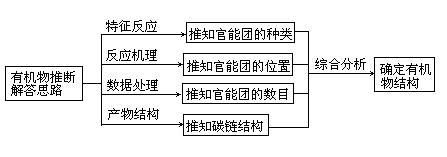
无机化学推断题知识汇总
(一)化学中物质的颜色种类较多,但分散在各个知识中,比较零碎,而在物质推断题中常常用到颜色进行分析和判断,为了便于查找和记忆,规类总结如下:
1.黄色
黄色:AgI、Ag3PO4、P4(黄磷)、溴水(黄→橙)、FeS2、Al2S3、甲基橙在弱酸性、中性或碱性环境中、某些蛋白质加浓硝酸。
淡黄色:S、Na2O2、TNT、PCl5、AgBr、浓HNO3(混有NO2)、浓HCl(混有Fe3+)、有NO2)。
灰黄色:Mg3N2
棕黄色:FeCl3溶液、碘水(深黄→褐)。
2.黑色:CuS、Ag2S、Cu2S、HgS(黑色或红色)、FeS、FeO、Fe3O4、MnO2、CuO、Ag2O、I2(紫黑色)、Si(灰黑色)、C、Ag(粉末)、KMnO4(固体)、石油。
3.绿色:CuCl2溶液、Cu2(OH)2CO3、FeSO4〃7H2O(浅绿色)、F2(淡黄绿色)、Cl2(黄绿色)、氯水(淡黄绿色)。
(混
4.红色:Cu2O、Cu、甲基橙在酸性环境中、紫色石蕊试液在酸性环境中、酚酞在碱性环境中、品红试液、Fe(SCN)2+、Br2(深红棕)、红磷(暗红)、Br2的CCl4溶液(紫红)、苯酚被空气氧化(粉红)。
5.棕色:固体FeCl3、固体CuCl2、NO2(红棕)、Fe2O3(红棕)。 6.紫色:KMnO4溶液、I2的CCl4溶液。 7.灰色:As、Sn、Fe3C。
8.褐色:碘酒、2Fe2O3〃3H2O、Fe(OH)3(红褐)。
9.蓝色:CuSO4〃5H2O、Cu(OH)2、淀粉遇碘、紫色石蕊试液加碱、Cu2+的稀溶液。 (二)、无机推断知识规律
1.同一元素的气态氢化物和气态氧化物反应,生成该元素的单质和水,元素可能是硫或氮。 2.同一元素的气态氢化物和最高价氧化物对应的水化物化合,生成盐的元素一定是氮。 3.两溶液混合生成沉淀和气体,这两种溶液的溶质可能分别是①Ba(OH)2与(NH4)2SO,;②可溶性铝盐与可溶性金属硫化物或可溶性碳酸盐或碳酸氢盐;③可溶性铁盐与可溶性碳酸盐或碳酸氢盐;④硫代硫酸盐与强酸(如盐酸、稀H2S04等)。
4.既能与酸反应,又能与碱反应的物质可能是Al、A1203,Al(OH)3,氨基酸,弱酸的铵盐、弱酸的酸式盐等。
5.既能与强酸反应放出气体又能与强碱反应放出气体,常见的物质有:AI,弱酸的铵盐[如(NH4)2C03、NH4HC03、(NH4)2SO3、(NH4)2S、NH4HS等]。
6.在水中分解生成气体和难溶物或微溶物的物质可能是A12S3、Mg3N2、CaC2等。 7.与水接触放出气体的常见物质有:Li、Na、K、Na202、F2等。
8.A物质加到B物质中,先生成沉淀,后沉淀又溶解,A、B可能分别是CO2与Ca(OH)2、NaOH与铝盐、NH3与AgN03、HCI与NaAl02、稀盐酸与Fe(OH)2胶体等。
9.使溴水褪色的物质有H2S、SO2、不饱和烃类、活泼金属、碱类等。 10.特殊的实验现象
①H2在C12中燃烧呈苍白色火焰。
②钠元素焰色反应为黄色;钾元素焰色反应为紫色(透过蓝色钴玻璃)。 ③遇酚酞变红的气体必是氨气。
④在空气中迅速由无色变为红棕色的气体是NO。
⑤使品红褪色的气体可能是C12或S02,物质可能是次氯酸盐NaCIO、Ca(CIO)2、氯水、Na202等。
⑥在C12中燃烧生成白色烟雾的是磷。 (三)常见无机推断30“眼”
1.紧紧围绕几个常见
常见非金属:H2、02、C、Si、N2、P、S、C12 常见金属:Na、Mg、Al、Fe 2.10电子
10电子分子:NH3、CH4、HF、H20
10电子阴离子:OH一、NH2-、F一、02-、N3— 10电子阳离子:NH4+、H30+、Na+、Mg2+、A13+ 3.18电子
18电子分子:PH3、SiH4、H2S、HCl、C2H6、H202、F2、CH3OH、CH3F 18电子离子:Cl一、S2一、K+、Ca2+、HS一 4.三个常温液态
唯一的非金属液体单质:Br2 唯一的液态金属:Hg 常温下的液态化合物H20、H2S04、HNO3等 5.常见物质的颜色
白色:Fe(OH)2、Mg(OH)2、Al(OH)3、AgCl、BaS04、CaCO3、BaCO3
其中AgCl、BaS04不溶于硝酸。
黑色物质:C、CuO、MnO2、FeO、Fe3O4、铁粉,其中Fe3O4是黑色晶体。 淡黄色:S、NO2、AgBr(沉淀)、AgI(沉淀)
红褐色:Fe(OH)3, 蓝色:Cu(OH)2, 可溶性Fe2+浅黄绿色,可溶性Fe3+黄色,可溶性Cu2+蓝色. Fe(SCN)3血红色, KMnO4紫黑色。 6.5个催化。
(1)氨的合成;(3)氨的催化氧化;(3)S02氧化成SO3;(4)H2O2的分解;(5)KClO3的受热分解。 7.7个高温
(1)合成氨;(2)水煤气;(3)铁与水(气);(4)还原性物质(H2、CO、C)与金属氧化物、非金属氧化物(C02、SiO2);(4)CaCO3的受热分解;(5)煅烧硫铁矿;(6)铝热反应;(7)硅酸盐工业。 8.4个化工
(1)硫酸的工业制法;(2)合成氨工业;(3)氯碱工业;(4)硅酸盐工业。 9.气体
(1)有刺激性气味的气体:HCI、HBr、NH3、SO2、H2S、NO、NO2
(2)无色无味的气体:H2、O2、N2、CO2、CO、CH4、C2H2 (3)有颜色有刺激性气味的气体:C12、NO2
(4)使品红褪色、加热后恢复的是SO2 (5)使湿润的红色石蕊试纸变蓝的是NH3 (6)使湿润的Pb(Ac)2试纸变黑的是H2S
(7)在空气中燃烧呈蓝色的气体有:H2、H2S、CH4、CO (8)能与水反应的是C12、F2、NO2
lO.钠元素的焰色反应呈黄色;钾元素的焰色反应呈紫色。
11.受热分解成三种物质的有:碳酸氢盐、碳酸铵、KMnO4、Cu2(OH)2CO3、铜之后的硝酸盐。 12.既能溶于强酸又能溶于强碱的是: (1)单质:Al、Zn、Be (2)氧化物:A12O3、ZnO、BeO
(3)氢氧化物:Al(OH)3、Zn(OH)2、Be(OH)2 (4)酸式弱酸强碱盐 (5)弱酸的铵盐
13.只溶于强碱不溶于强酸的是:Si
14.二个电解:电解氯化钠、电解熔融的氧化铝。 15.不溶于强酸的是:AgCl、BaSO4、H2SiO3、CuS。
16.不溶于氨水但溶于NaOH或不溶于CO2但 溶于盐酸的是Al(OH)3。
17.加过量盐酸后得到胶状沉淀的是硅酸盐。
18.先加盐酸沉淀,后又溶解的是NaAlO2;先加NaOH沉淀,后又溶解的是A1C13
19.溶于水生成一种沉淀、一种气体的有Mg3N2、A12S3、双水解彻底的弱酸弱碱盐;两种化合物的水溶液反应产生一种沉淀、一种气体的是:盐酸与Na2S2O3;(NH4)2SO4与Ba(OH)2。
O2O2??B???C,说明存在着可变价态,一般而言是Fe2+→Fe3+的变化;或C、N、20.存在A?
S、P氧化物或氯化物之间的转化。
21.两种化合物反应生成一种单质的有:SO2和H2S;CO2或H2O与Na2O2的反应。从总体而言,上述反应不是归中就是歧化。
22.遇到NaOH产生气体的化合物是铵盐。
23.三种物质反应有气体产生的是:硝酸盐、金属、硫酸;氯酸盐、盐酸盐、硫酸;MnO2、NaCl(金属氯化物)、H2SO4。
24.常见原子晶体有:金刚石、石墨、Si、SiO2、SiC。
25.通常情况下若有两种元素组成同时符合A2B2和A2B不是钠与氧就是氢与氧。 26.互为同素异形体的有:O2、O3;白磷、红磷;金刚石、石墨、C60;S2、S4、S6、S8。
27.原子核中无中子的是H。
28.结构规律:
(1)最外层电子数等于次外层电子数的元素:Be、Ar;
(2)最外层电子数是次外层电子数2倍的元素是:C;3倍的是O;4倍的是Ne;
(3)电子层数与最外层电子数相等的元素:H、Be、Al;
(4)电子总数为最外层电子数2倍的元素:Be;
(5)次外层电子数是最外层电孚数2倍的元素:Si。
29:具有漂白性的是:O3、H2O2、C1O2、Na2O2、HCIO、SO2、C(活性碳)。
30.使淀粉溶液变蓝的是I2,能使湿润的KI一淀粉试纸变蓝的气体是Cl2、Br2蒸气、NO2。
(四)无机框图推断题的“题眼”
无机框图推断题是高考试卷中的主流题型之一,旨在考察考生的知识系统性和思维灵活性。解此类题必须具备扎实的基础知识网络结构,更重要的是要善于捕捉解题的突破口即“题眼”,善于从众多的信息中“切中要害”再“顺藤摸瓜”解题。常见的十类“题眼”可归纳如下:

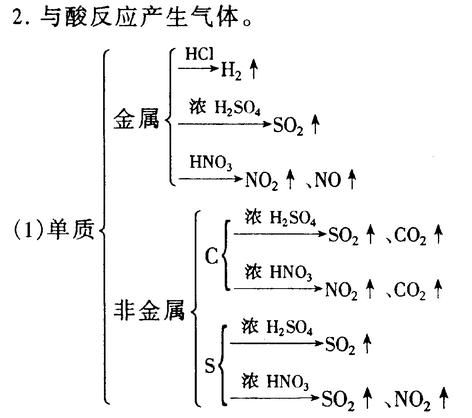



5

.典型置换反应
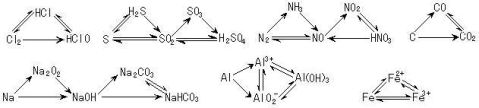
6.三角转化
7.受热分解产生2种或3种气体的反应:
Δ?NH4HCO3[(NH4)2CO3]???NH3??CO2??H2O?Δ(1)铵盐?NH4HSO3[(NH4)2SO3]???NH3??SO2??H2O
?ΔNHHS[(NH)S]???NH3??H2S?442?
Δ???2CuO?4NO2??O2??2Cu(NO3)2?(2)硝酸盐? Δ???2Ag?2NO2??O2??2AgNO3?
8.特征网络:
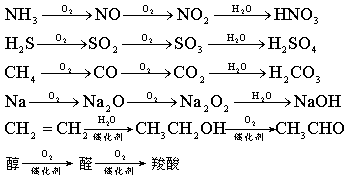
O2O22O(1)A???B???C?H???D(酸或碱)
O2O2H2O①NH(气体)???NO???NO????HNO3 32
O2O22O②H2S((气体???SO2???SO3?H???H2SO4
O2O22O③C((固体???CO???CO2?H???H2CO3
O2O22O④Na(固体)???Na2O???Na2O2?H???NaOH
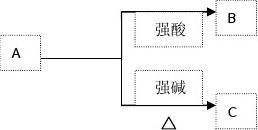
强酸???气体B???(2)A—?强碱 ???气体C???
A为弱酸的铵盐:(NH4)2CO3或NH4HCO3;(NH4)2S或NH4HS;(NH4)2SO3或NH4HSO3
(3)无机框图中常用到催化剂的反应:
2KClO??2,Δ
3?MnO??2KCl?3O2?
2H2O2?MnO??2?2H2O?O2?
2SO催化??剂化剂
2?O2???2SO3
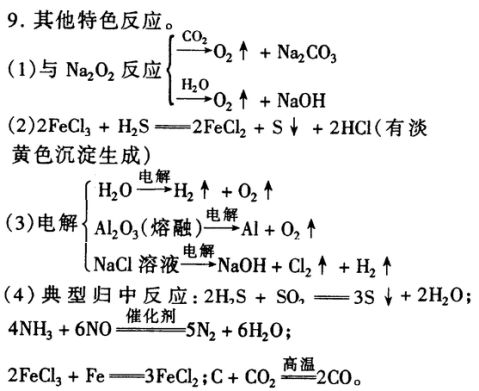
4NH?5O剂化剂
32?催化????4NO?6H2O
N??剂化剂
2?3H2?催化??2NH3


(7)遇HCl生成沉淀,可能是:S2O32-、Ag+、 SiO32-、AlO2- (8)遇H2SO4生成沉淀,可能是:Ba2+、Ca2+、S2O32-、SiO32-、AlO2-
遇BaCl2生成不溶于硝酸的白色沉淀,可能是:SO42-、Ag+、 SO32-
(9)具有臭鸡蛋气味的气体H2S,与H2S反应生成淡黄色沉淀的气体有Cl2、O2、SO2、NO2 (10)能使品红溶液褪色的气体可能是:Cl2、SO2,物质可能有:NaClO、Ca(ClO)2等次氯酸盐、氯水、过氧化钠、过氧化氢、活性碳等 (五)无机推断中的“框式语”
O2O2O2??B???C???D(酸、碱、羧酸或醇) 1.框式语A?
破译 该框式语说明A中的某元素能连续被氧化,A一般为含有可变化合价元素的物质。符合此条件的常见物质有:
2.框式语
破译 该框图表明A既能与酸反应,又能与碱反应。符合此条件的A常见的有AlO、Al(OH)等两性物质、弱酸的酸式盐、弱酸的铵盐、氨基酸、蛋白质等。
若B、C均为气体,则A必为挥发性弱酸的铵盐,如(NH4)2CO3或NH4HCO3;(NH4)2S或NH4HS;(NH4)2SO3或NH4HSO3等。若B、C均为H2时,A必为Al。
3.框式语:A(或A和B)C(C和D)
破译 该框式语的主要特征是催化剂,中学教材中符合此条件的反应主要有:

4.框式语:A→B+C+D 破译 符合该框式语的反应有

5.框式语:化合物甲+单质A
化合物乙+单质B
破译 该框式语表示物质间发生了置换反应。置换反应的常见类型有: (1)金属单质置换出金属单质,如:Fe+CuSO4=Cu+FeSO4 (2)非金属单质置换出非金属单质,如:Cl2+2KI=2KCl+I2 (3)金属单质置换出非金属单质,如:2Na+2H2O=2NaOH+H2 2Mg+CO2=2MgO+C (4)非金属单质置换出金属单质,如:H2+CuO=Cu+H2O 6.框式语 化合物甲+化合物乙→单质A+化合物丙 破译 符合该框式语的主要反应类型有:

7.框式语 化合物A+化合物B→气态化合物C+化合物D 破译 符合该框式语的反应有:
(1)Mg3N2、Al2S3、CaC2等与水的反应,如Al2S3+6H2O=2Al(OH)3+3H2S (2)Al3+、Fe3+和HCO3-(CO32-)、HS-(S2-)等双水解反应,如:
Al3++3HCO-=Al(OH)3+3CO2
(3)铵盐与强碱共热制NH3的反应。如:2NH4Cl+Ca(OH)2=CaCl2+2NH3+2H2O
(4)难挥发性酸制易挥发性酸的反应,如:NaCl+H2SO4(浓)=NaHSO4+HCl
-
中考化学总复习基础知识详细总结
一基本概念和基本理论一物质的变化和性质1物质的变化物理变化没有生成其他物质的变化化学变化生成了其他物质的变化化学变化和物理变化常常…
-
初三化学知识点总结归纳(完整版)
初中化学知识点全面总结完整版第1单元走进化学世界1化学是研究物质的组成结构性质以及变化规律的基础科学2我国劳动人民商代会制造青铜器…
-
中考化学知识点总结归纳(完整版)
中考化学知识点全面总结完整版第1单元走进化学世界1化学是研究物质的组成结构性质以及变化规律的基础科学2我国劳动人民商代会制造青铜器…
-
中考化学总复习基础知识详细总结
一基本概念和基本理论一物质的变化和性质1物质的变化物理变化没有生成其他物质的变化化学变化生成了其他物质的变化化学变化和物理变化常常…
-
中考化学总复习基础知识详细总结
一基本概念和基本理论一物质的变化和性质1物质的变化物理变化没有生成其他物质的变化化学变化生成了其他物质的变化化学变化和物理变化常常…
-
小学五年级英语期中考试反思与总结
刘建华考试是检验学生近期学习成绩的一种手段,也是督促教师进行教学反思提高教学质量的前提条件。期中考试已经结束,以下是我对上半学期和…
-
小学期中考试总结会教务处发言稿
各位老师、各位同学下午好:本学期在校长室的正确领导、各位老师辛勤工作下,20xx年春学期期中考试已顺利结束,在这次考试中有许多同学…
-
小学生期中考试总结大会学生发言稿3
尊敬的领导、老师,亲爱的同学们,大家上午好!紧张的期中考试已经结束了,我的心情非常激动。虽然我取得了令人满意的成绩,但是这次成绩的…
-
小学五年级数学期中考试总结
这学期,我执教五年级两个班的数学,五(2)班的总参考人数是57人。五(3)班总参考人数57人。对于这次期中考核成绩,可以说是相当不…
-
小学五年级英语期中考试反思与总结
小学五年级英语开学调考反思与总结白芳梅考试是检验学生近期学习成绩的一种手段,也是督促教师进行教学反思提高教学质量的前提条件。期中考…