微生物实习报告
实 习 报 告

邵 阳 学 院
20##年12月10日
一、实验时间与地点
时间: 20##年下学期第13--15周
地点:邵阳学院李子园校区生物与化学工程系微生物实验室
二、实习过程概述
11.18下午在2栋教学楼204室举行动员大会
11.18至12.19查找资料并设计实验方案。
11.20上午提交实验方案并通过了,下午再去领实验器材,清洗实验器材,烘干,包扎。
11.21 配制牛肉膏蛋白胨培养基,做无菌检查
11.22 样品中细菌的检测进行十倍稀释、接种
11.23 细菌菌落的观察及计数
11.24 配制察氏培养基,做无菌检查
11.25 样品中酵母菌的检测进行十倍稀释、接种
11.26—11.28 观察酵母菌落及计数
11.29 配制察氏培养基,做无菌检查
11.30样品中霉菌的检测进行十倍稀释、接种
12.01--12.05观察霉菌菌落及计数
12.06 配制乳糖发酵培养基,做产气实验
12.07 观察产气情况
12.08—12.10数据的处理分析,完成实习报告。
三、实习内容
(一)香干中细菌含量的测定:
Ⅰ、实验材料
(1)、实验器材及试剂
设备:电热恒温培养箱37℃±1℃、电磁炉、电子天平、PH试纸、吸管1ml、10ml 6个、烧杯(1000ml)一个、三角瓶(500ml、250ml)各一个、培养皿(直径90mm)9个、试管9个、试管架、酒精灯、研钵、剪刀、灭菌镊子、75%酒精棉球、量筒(500ml)、玻棒、牛角匙、高压蒸汽灭菌锅、棉花、牛皮纸、记号笔、麻绳、纱布
试剂:75%乙醇、生理盐水、1mol/L氢氧化钠溶液
(2)、牛肉膏蛋白胨培养基
配方:牛肉膏 3g、蛋白胨 10g、 NaCl 5g、琼脂 15—20g、无菌水 1000ml、pH 7.4—7.6
配置步骤:
① 称量
② 溶化
③ 调pH
④ 分装
⑤ 加塞
⑥ 包扎
⑦ 灭菌
⑧ 倒平板
(3)、检样稀释及培养
① 以无菌操作,将检样豆干25g剪碎、研磨以后,放于盛有225ml无菌水的三角瓶内,并在三角瓶中放入玻璃珠,经充分振摇做成1:10的均匀稀释液。
② 用1ml无菌吸管吸取1:10稀释液1ml,沿管壁缓慢注入含有9ml无菌水的无菌试管内,振摇试管混合均匀,做成1:100的匀液。
③ 另取1ml的灭菌吸管,按上项操作顺序作10倍递增稀释液,如此每递增稀释一次,即换用1支1ml灭菌吸管。
④ 根据食品卫生标准要求或对检样污染情况的估计,选择3个适宜稀释度,分别在作10倍递增稀释的同时,即以吸取该稀释度的吸管移0.3ml稀释液于无菌培养皿内,每个稀释度作三个培养皿。同时做好空白对照组。
⑤ 稀释液移入培养皿后,应及时用涂布器在培养基表面将样品均匀涂布。
⑥ 等琼脂凝固后,翻转培养皿,置(36±1)℃恒温箱内培养24h取出,计算平板内菌落数目乘以倍数,即得1g样品所含菌落总数。
Ⅱ、菌落计算方法
(1)菌落计数方法
做平板菌落计数时,可用肉眼观查,必要时用放大镜检查,以防遗漏。在记下各平板的菌落数后,求出同稀释度的各平板平均菌落总数。
(2)菌落计数的报告
① 平板菌落数的选择
选取菌落数在30~100之间的平板作为菌落总数测定标准。一个稀释度使用三个平板,应采用三个平板平均数,其中一个平板有较大片状菌落生长时,则不宜采用,而应以无片状菌落生长的平板作为该稀释度的菌落数,若片状菌落不到平板的一半,而其余的一半中菌落分布又很均匀,即可计算半个平板后乘2以代表全皿菌落数。平皿内如有链状菌落生长时(菌落之间无明显界线),若仅有一条链,可视为一个菌落数;如果有不同来源的几条链,则应将每条链作为一个菌落计。
② 稀释度的选择
应选择平均菌落数在30~100之间的稀释度,乘以稀释倍数报告之。若所有稀释度平均菌落数均大于100,则应按稀释度最高的平均菌落数乘以稀释倍数报告之。
若所有稀释度的平均菌落数均小于30,则应按稀释度最低的平均菌落数乘以稀释倍数报告之。
若所有稀释度均无菌落生长,则以小于1乘以最低稀释倍数报告之。
若所有稀释度的平均菌落数均不在30~100之间,其中一部分大于100或小于30时,则以最接近30或100的平均菌落数乘以稀释倍数报告之。
(3)、实验具体流程如下
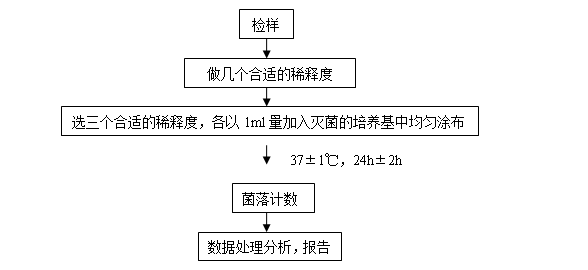
(4)、下表为实验时记录的豆干中细菌的含量数据:
样品中细菌的含量

注:每个平板加入0.3ml的稀释液
其中,细菌菌落全为白色。
(二)豆干中酵母菌含量检测
Ⅰ、实验材料
(1)、实验器材及试剂
设备:恒温培养箱、电子天平、锥形瓶容量( 500 mL、250 mL )各一个、无菌吸管1 mL、10 mL 6个、无菌培养皿9个、无菌试管20个、试管架、酒精灯、研钵、剪刀、灭菌镊子、75%酒精棉球、牛皮纸袋、塑料
试剂:蔗糖3g、NaN03 0.3g、 K2HP04 0.1g、KCl 0.05g、MgSO4·7H2O 0.05 g、FeS04 0.001 g、琼脂1.5-2g、无菌水1000ml
(2)察氏培养基
配方:蔗糖30g、NaN03 3g、 K2HP04 0.1g、KCl 0.5g、MgSO4·7H2O 0.5 g、FeS04 0.01 g、琼脂15-20g、无菌水1000ml、自然pH
配制步骤:
① 称量及溶化 量取所需水量约2/3左右加入到烧杯中,分别称取蔗糖、NaNO3 、K2HP04 、KCl、MgSO4。依次逐一加入水中溶解。按每100 ml培养基加入1ml 0.1%的FeS04溶液。
② 定容 待药品全部溶解后,将溶液倒入量筒中,加水至所需体积。
③ 加琼脂 加入所需量琼脂,加热融化,补足失水。
④ 分装、加塞、包扎。
⑤ 高压蒸汽灭菌 0.103 MPa,121°C灭菌20 min。
⑥ 倒平板
Ⅱ、操作步骤
(1)、样品的稀释
① 样品预处理:以无菌操作,将检样香干25g剪碎、研磨以后,放于盛有225ml无菌水的三角瓶内,经充分振摇做成1:10的均匀稀释液。
② 取1 mL 1:10稀释液注入含有9 mL无菌水的试管中, 另换一支1 mL无菌吸管反复吹吸,此液为1:100 稀释液。
③ 按上步操作程序,制备 10 倍系列稀释样品匀液。每递增稀释一次,换用 1次 1 mL 无菌吸管。
④ 根据对样品污染状况的估计,选择3 个适宜稀释度的样品匀液(液体样品可包括原液),在进行 10 倍递增稀释的同时, 每个稀释度分别吸取0.3 mL 样品匀液于 3 个无菌平皿内。 同时作好空白对照。
⑤ 稀释液移入培养皿后,应及时用涂布器在培养基表面将样品均匀涂布。
⑥ 等琼脂凝固后,翻转培养皿,置(28±1)℃恒温箱内培养3—5天取出,计算平板内菌落数目乘以倍数,即得1g样品所含菌落总数。
Ⅲ、结果与报告
(1)、计算两个平板菌落数的平均值,再将平均值乘以相应稀释倍数计算。
① 若所有平板上菌落数均大于 150 CFU,则对稀释度最高的平板进行计数,其他平板可记录为多不可计,结果按平均菌落数乘以最高稀释倍数计算。
② 若所有平板上菌落数均小于 10 CFU,则应按稀释度最低的平均菌落数乘以稀释倍数计算。
③ 若所有稀释度平板均无菌落生长,则以小于 1 乘以最低稀释倍数计算;如为原液,则以小于 1计数。
(2)、报告
① 菌落数在 100 以内时,按“四舍五入”原则修约,采用两位有效数字报告。
② 菌落数大于或等于 100 时,前 3 位数字采用“四舍五入”原则修约后,取前 2 位数字,后面用0 代替位数来表示结果;也可用 10 的指数形式来表示,此时也按“四舍五入”原则修约,采用两位有效数字。
③ 称重取样以 CFU/g 为单位报告,体积取样以 CFU/mL 为单位报告,报告酵母数。
实验具体流程如下:
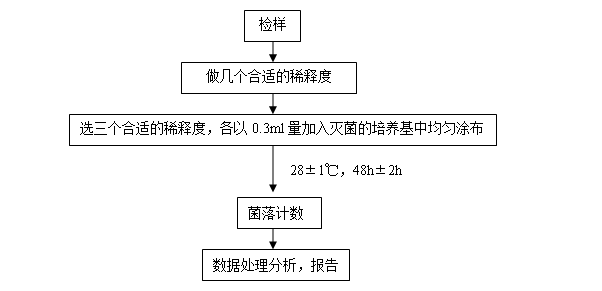
下表为实验时记录的香干中酵母菌的含量数据:
样品中酵母菌的含量
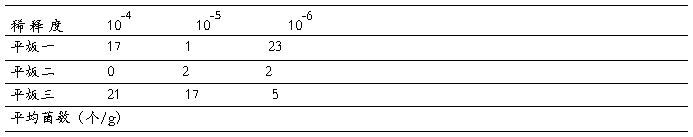
注:每个平板加入0.3ml的稀释液
酵母菌菌落呈白色,且表面很潮湿。
(三)豆干中霉菌霉菌含量检测
Ⅰ、实验材料
(1)、实验器材及试剂
设备:恒温培养箱、电子天平、锥形瓶容量( 500 mL、250 mL )各一个、无菌吸管1 mL、10 mL 6个、无菌培养皿9个、无菌试管20个、试管架、酒精灯、研钵、剪刀、灭菌镊子、75%酒精棉球、牛皮纸袋、塑料
试剂:蔗糖30g、NaN03 3g、 K2HP04 1g、KCl 0.5g、MgSO4·7H2O 0.5 g、FeS04 0.01 g、琼脂15-20g、无菌水1000ml
(2)察氏培养基
配方:蔗糖30g、NaN03 3g、 K2HP04 1g、KCl 0.5g、MgSO4·7H2O 0.5 g、FeS04 0.01 g、琼脂15-20g、无菌水1000ml、自然pH
配制步骤:
① 称量及溶化 量取所需水量约2/3左右加入到烧杯中,分别称取蔗糖、NaNO3 、K2HP04 、KCl、MgSO4。依次逐一加入水中溶解。按每1000 ml培养基加入10ml 0.1%的FeS04溶液。
② 定容 待药品全部溶解后,将溶液倒入量筒中,加水至所需体积。
③ 加琼脂 加入所需量琼脂,加热融化,补足失水。
④ 分装、加塞、包扎。
⑤ 高压蒸汽灭菌 0.103 MPa,121°C灭菌20 min。
⑥ 倒平板
(3)、检样稀释及培养
① 以无菌操作,将检样香干25g剪碎、研磨以后,放于盛有225ml无菌水的三角瓶内,并在三角瓶中放入玻璃珠,经充分振摇做成1:10的均匀稀释液。
② 用1ml无菌吸管吸取1:10稀释液1ml,沿管壁缓慢注入含有9ml无菌水的无菌试管内,振摇试管混合均匀,做成1:100的匀液。
③ 另取1ml的灭菌吸管,按上项操作顺序作10倍递增稀释液,如此每递增稀释一次,即换用1支1ml灭菌吸管。
④ 根据食品卫生标准要求或对检样污染情况的估计,选择3个适宜稀释度,分别在作10倍递增稀释的同时,即以吸取该稀释度的吸管移0.3 ml稀释液于无菌培养皿内,每个稀释度作三个培养皿。同时做好空白对照组。
⑤ 稀释液移入培养皿后,应及时用涂布器在培养基表面将样品均匀涂布。
⑥ 等琼脂凝固后,翻转培养皿,置(28±1)℃恒温箱内培养5—7天取出,计算平板内菌落数目乘以倍数,即得1g样品所含菌落总数。
实验具体流程如下:

下表为实验时记录的豆干中霉菌的含量数据:
样品中霉菌的含量

注:每个平板加入0.3 ml的稀释液
霉菌菌落有菌丝,菌落较大,有白色、黄色、黑色的菌落。
(四)、香干中大肠杆菌的检测
大肠菌群系指一群能发酵乳糖、产酸产气、需氧和兼性厌氧的革兰氏阴性无芽胞杆菌。该菌主要来于人畜粪便,故以此作为粪便污染指标来评价食品的卫生质量,推断食品中有否污染肠道致病菌的可能。
食品中大肠菌群数系以100mL(g)检样内大肠菌群最可能数(MPN)表示。
Ⅰ、实验材料
(1)、实验器材及试剂
设备:恒温箱(36±1℃)、电子天平、乳钵、试管 20个、吸管(1 mL、10 mL)6个、三角烧瓶(500ml、250ml)各一个、酒精灯、试管架、烧杯(1000ml)一个、杜氏小管
试剂:结晶紫1克、95%乙醇20ml、1%草酸铵水溶液 80ml、0.85%灭菌生理盐水、磷酸二氢钾34g 、1mol/L氢氧化钠175ml、无菌水5000ml、蛋白胨30g、乳糖25g、2% 伊红水溶液 20ml、0.5%美蓝水溶液 13ml、胰蛋白胨20g、3号胆盐 1.5g、磷酸氢二钾 2g、氯化钠100g、琼脂20g、0.65%美蓝溶液10ml、0.04%溴甲酚紫水溶液25ml、猪胆盐 5g、0.4%溴甲酚紫水溶液 2.5ml
Ⅱ、操作步骤
(1)、检样稀释
以无菌操作将检样25 g放于有225mL无菌水的灭菌玻璃瓶内(瓶内予置适当数量的玻璃珠),经充分振摇或研磨做成1:10的均匀稀释液。
(2)乳糖发酵试验
分别取 1ml 1:10的均匀稀释液于9个乳糖胆盐发酵管内,置36±1℃ 温箱内,培养24±2h,如所有乳糖胆盐发酵管都不产气,则可报告为大肠菌群阴性,如有产气者,则按下列程序进行。
(3)、分离培养
将产气的发酵管分别转种在伊红美蓝琼脂平板上,置36±1℃ 温箱内,培养18-24h,然后取出,观察菌落形态,并做革兰氏染色和证实试验。
(4)、证实试验
在上述平板上,挑取可疑大肠菌群菌落1-2个进行革兰氏染色,同时接种乳糖发酵管,置 36±1℃温箱内培养24±2h,观察产气情况。凡乳糖管产气、革兰氏染色为阴性的无芽胞杆菌,即可报告为大肠菌群阳性。
(5)、报告
根据证实为大肠菌群阳性的管数,查MPN检索表,报告每100mL(g)大肠菌群的MPN值。
实验具体流程如下:
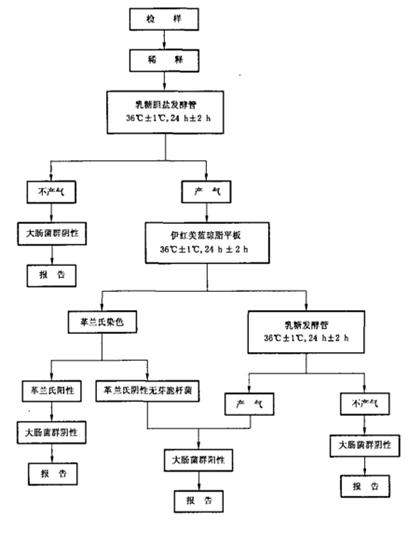
Ⅲ、结果报告
乳糖胆盐发酵管现象
4只试管都不产生气泡(注:每只试管加入1ml稀释液,产气的现象为杜氏小管中有气泡产生。)
试验结论:香干中无大肠杆菌群
四、实验经验与心得总结
(一)、实习体会
1.团队的重要性,一个人是不可能在三星期内完成实习内容的,必须在多人共同努力下才能完整的完成实验,才能很好的完成实验。
2.实验前必须有详细的实习计划书,熟话说的好,万事开头难,好的开始是成功的一半。制定详细的计划书可以很好的帮助我们后面实验的过程,为我们节约了很多时间。合理的规划了我们的时间.
3.实验前资料查阅的重要性,没有好的指导,就不可能做出好的结果。只有明确了我们需要做什么,我们需要什么样的培养基,什么样的试剂以及仪器。只有在准备充分的前提下才能有条不紊的进行试验。
4.组长的重要性,如果狼群没有狼王,那就没有任何威慑力。组长合理的分配了各个组员的任务,使大家分工明确,知道该做什么,要做什么,这样就不会出现有组员打酱油的情况发生,也不会让组员感觉无聊。让大家都参与进来,为实验做自己的一点贡献,做出实验成果时,都能有一定的收获。一分耕耘,一分收获。组长还可以协调组员有时发生的矛盾。
5.自己动手的重要性。看着别人做,好像很简单的样子,可是当自己做的时候就不是那么回事了,没有想象中的简单。实践出真知。
6.不要怕失败,没做实验前感觉实验还挺简单的,安排那么多时间,纯粹是浪费。后来自己做了后才知道,事情并不是想象中的那么简单。不仅耗时,而且耗力。不知道失败了多少次后才做出了实验结果。坚持到最后的都是英雄。
7.做事要有始有终,不能刚开始满腔热情,但是还没开始一半就半途而废了。微生物实验不要想做一次就能成功的。一般是要多次才能成功。所以要坚持做完。
8.操作一定要标准,微生物实验室一项精密的实验,稍微有点疏忽或者操作不当,可能实验就报废了,得重新来过。
9.细节的重要性,细节决定成败。每次试验完后,实验桌一定要整理干净,实验药品一定要放回原处,以方便下次做实验以及另外组做实验
(二)、试验中存在的不足与建议:
1、实验室的样品试剂需好好保存,每次用完后都需盖好放回原处好好保存,防止变质。
2、样品在研磨时,要研磨充分。
3、在做细菌的实验时,我们组做了两次,第一次是因为涂布器没有完全冷却就涂布,导致细菌被烫死,实验没有现象。
4、在做大肠菌群的测定时,杜氏小管需用注射器注满培养基,再倒置后缓缓放入试管中,切忌不可垂直丢入,这样很可能会导致试管破裂,杜氏小管注射培养基时,需注满,不然,放入试管后会导致小管内出现气泡,影响实验结果!
总的来说,这次的微生物课程实习,让我学到了很多,比如怎样设计实验方案、团队合作精神的重要性以及操作时操作技术日渐成熟等等。而且,这次的课程实习,让我对自己的实验动手能力有了一个新的认识和提高,能更深刻的认识到自己实验过程中不足的一方面,意识到自己的理论知识还不够扎实,动手能力还不够成熟。让自己在日后的学习中能更好地运用操作实验,对自己日后的发展打下了坚实的基础
五、课后思考题
1、用滤膜法检测大肠菌群有什么优点?
答:(1)与直接法比较可以检测大量的样品。
(2)浓缩效应使微生物的检测结果提高。
(3)带有菌落的滤膜可作为检测的永久记录存档。
(4)可见的菌落与样品量直接对应,得出定量结果。
2、检查豆制品中的大肠菌群有何意义?
答:主要是以该菌群的检出情况来表示豆制品中有否粪便污染。大肠菌群数的高低,表明了粪便污染的程度,也反映了对人体健康危害性的大小。粪便是人类肠道排泄物,其中有健康人粪便,也有肠道患者或带菌者的粪便,所以粪便内除一般正常细菌外,同时也会有一些肠道致病菌存在(如沙门氏菌、志贺氏菌等),因而食品中有粪便污染,则可以推测该食品中存在着肠道致病菌污染的可能性,潜伏着食物中毒和流行病的威胁,必须看作对人体健康具有潜在的危险性。
-
微生物课程实习报告
微生物课程实习报告10生物技术2班李XX1090XXXXX目录实习一2一实习概况2二实习内容2三实习收获与体会3实习二5一实习概况…
-
微生物实习总结
岁月如梭,光阴似箭,不知不觉在微生物室实习的时间已经结束了,但收获颇丰。通过积极协助老师完成细菌学方面检验项目的同时,自己的基础操…
-
微生物实习总结
华南农业大学20**《微生物学》教学实习总结专业:植物保护(微生物工程方向)指导老师:**课程名称:微生物教学实习班级:09植保微…
-
微生物实习报告
林业与生物技术学院实习报告学生姓名:娄钧翼学号:20xx01220327专业名称:生物科学—微生物班级:生物科学102班指导教师:…
-
微生物实习报告
引言一实习时间20xx67612二实习地点食品发酵实验室化学楼119123食品学院实习基地三实习目的1学习自制酸奶的方法熟悉从酸奶…
-
食品微生物检验总结
1.食品微生物检验是应用微生物学的理论与方法,研究外界环境和食品中微生物的种类、数量、性质、活动规律、对人和动物健康的影响及其检验…
-
食品微生物学实验报告
常见微生物的分离培养与观察一,实验目的1,掌握显微镜的使用方法,操作原理。2,了解培养基的制备并掌握制备方法3,掌握杀菌锅杀菌方法…
-
微生物实验报告
金黄色葡萄球菌的分离提纯和鉴定实验一金黄色葡萄球菌的分离培养一实验目的1掌握BairdParker培养基的配制方法2掌握利用选择性…
-
微生物实验报告
实习报告XX学校2015年1月13日1、实习时间、地点和实习单位2、实习目的通过食品微生物检验实习,掌握培养基的配制、包扎及灭菌;…
-
微生物检验实习报告
实习报告实习名称系别年级专业学生姓名指导老师食品微生物检验实习11级食品科学与工程专业王磊1140905035王瑶琼吴菲菲黄大川邵…
-
20xx年动物微生物教学实习报告
动物微生物实习报告任务一细菌性病原的实验室检查1、目的:熟悉细菌性病原的实验室检测程序、掌握其操作技能,学会其结果判定方法,能够对…