医院药品不良反应培训制度报告20xx1202
医院药品不良反应监测报告制度
为进一步加强我院药品不良反应的安全监管,保障病人用药安全,提高合理用药和医疗水平,规范我院药品不良反应报告和监测工作,根据《中华人民共和国药品管理法》和国家药品食品监督管理局与卫生部于2004 年4月14日联合颁布的《药品不良反应报告和监测管理办法》,结合我院实际,制定本制度。 药品不良反应(ADR)系指药品在正常用法用量情况下出现的与治疗目的无关的有害反应。药品不良反应的病例报告资料不得作为医疗纠纷、医疗诉讼的依据。为避免不必要的思想混乱,报告内容应予以保密。药品不良反应实行逐级、定期报告制度,必要时可以越级报告。
一、组织领导
药品不良反应监测工作领导小组:
组 长:周 珊
副组长:李富宏
联络员:白慧云
成 员:王永胜 王 莉 王咏梅 吴 萍 马仁忠
汪戈明 宋子敬 何镇德 盛玉华 马述奎
邵保东
药品不良反应监测领导小组办公室设在药剂科,从成立之日起,按上级相关部门要求履行职责,落实医院相关工作。同时,
各临床科室明确监测医生、护士各一名组成ADR监测小组,参与负责本部门药品不良反应上报和监测工作,组建全院ADR监测网络。
二、工作职责
1.发现可能与所用药品有关的不良反应应详细记录、调查、分析、评论、处理,填写《药品不良反应/事件报告表》,按规定上报,并采取有效措施,减少和防止药品不良反应的重复发生。
2.发现群体不良反应,应立即向酒泉市食品药品监督管理局、卫生局以及药品不良反应监测中心报告。
3.积极配合各级药品监督主管部门、卫生主管部门和药品不良反应监测机构做好有关品种的调查、分析和评价工作。
4.开展有关药品不良反应报告和监测的宣传、教育和培训工作,提高医、药、护人员对药品不良反应的重视程度和认知水平,应用各种形式向全院工作人员宣传ADR监测工作的重要性和必要性,指导临床合理用药。
5.积极开展药品不良反应监测方法的研究,进行药品不良反应监测领域的交流与合作。
6.对发现的药品不良反应/事件,尤其是新的、严重的药品不良反应/事件,及时告知药品的生产企业。
7.对所有药品不良反应死亡病例进行分析讨论,讨论结果上报酒泉市药品不良反应监测中心。
8.药品不良反应监测小组每年召开一次全院总结经验交流 2
会,总结工作经验,表扬先进单位和个人,提出ADR监察中存在的问题,找出工作差距,订出整改措施。
三、上报流程
见附件。
四、工作制度
(一)日常工作管理
1.药剂科设专人兼职负责药品不良反应报表的收集、分析、整理、上报工作。各临床科室设置药品不良反应监测员协助药品不良反应监测工作。
2.医院工作人员在工作中遇到任何药品不良反应事件,妥善处理后必须于2个工作日内上报药剂科。
3.医院工作人员在工作中遇到的紧急、严重、罕见的药品不良反应事件,妥善处理后必须于24小时内及时上报药剂科。死亡病例必须及时上报药剂科。
4.药剂科对普通药品不良反应报表随时上报酒泉市药品不良反应中心。
5.药剂科对紧急、严重、罕见的药品不良反应事件,在收到报告后,应立即上报酒泉市药监部门与市不良反应中心。
(二)ADR病例分析评价
1.药剂科应及时对全院药品不良反应发生的情况进行通报。
2.疑难病例可提交药品不良反应工作小组研究讨论。
3.药剂科具体承办对临床上报的药品不良反应报告表进行 3
收集整理、分析鉴别,向临床医师提供药品不良反应处理意见,负责汇总本院药品不良反应资料,向酒泉市药品不良反应监测中心报告,另外负责转发上级下发的药品不良反应信息材料。
4.药剂科内设药品不良反应监测分析小组,药师接到临床医师填写的药品不良反应报告表后,必须立即到病人床前询问情况、查阅病历,与医师一起共同进行因果关系评价,提出对药品不良反应的处理意见。填报的药品不良反应报告表由药剂科专人负责存档、上报。
5.药剂科对全院收集的药品不良反应案例,定期进行分析、评价,写出分析评价记录,通过简报、药讯等方式及时向临床公示、反馈。
(三)防止ADR漏报
1.药品不良反应上报原则:可疑必报!
2.护士、医生或者临床药师等一旦发现可疑的药品不良反应,应立即采取以下措施:
①报告病人的主管医生或其它相关小组、部门。
②在病历上记录相关的不良反应及采取的措施。
③填写《药品不良反应/事件报告表》。《药品不良反应/事件报告表》的填报内容应真实、完整、准确。
3.药剂科在收到药品不良反应报告电话后,应在24小时内前往科室调查、分析因果。
(四)考核制度
4
1.药剂科应加强临床药师查房工作,注意医护患的沟通,发现不良反应及时记录、上报。
2.临床各科室应充分重视药品不良反应监测工作,任何工作人员发现可能与用药有关的不良反应,应及时报告科室ADR小组。
3.奖励
①对于每份成功上报的药品不良反应报表,绩效考核时给予上报科室加分3分的奖励。
②对于上报积极的个人与集体,在年度总结会上给予一定的奖励。
4.罚则
①未按要求报告药品不良反应的,给予相应的处罚。 ②发现药品不良反应匿而不报的,给予相应的处罚。
附件:药物不良反应报告及处理程序
一般的ADR/ADE病例报告流程
5
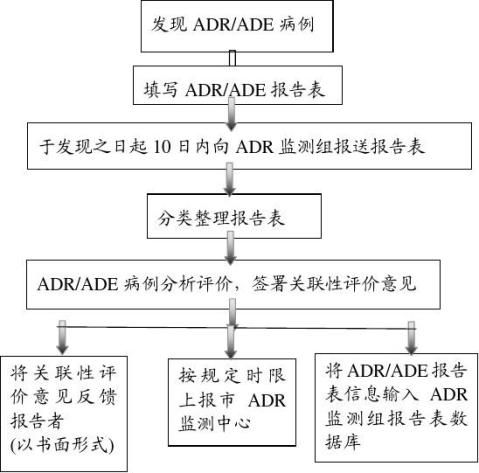
6
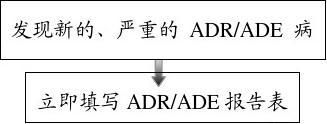
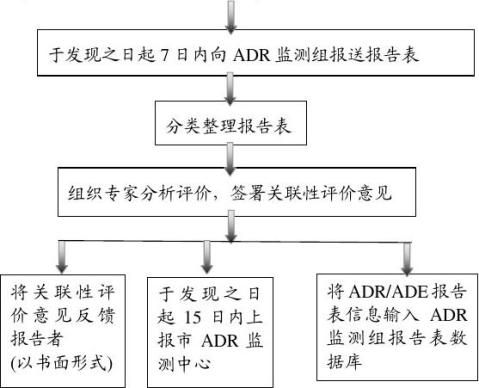
新的、严重的ADR/ADE病例报告流程
7
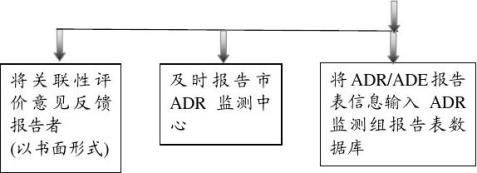
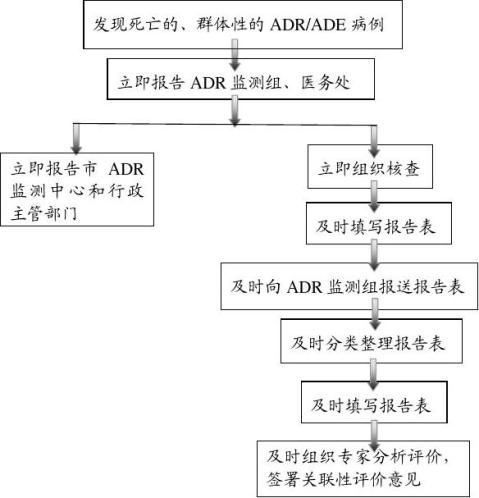
死亡的、群体性的ADR/ADE病例报告流程
8
第二篇:药品不良反应检测和报告制度
药品不良反应检测和报告制度
会议时间:
会议地点:
主持人:
参加人员:
根据国家药监局《药品不良反应(ADR)报告和监测管理办法实施细则》的有关规定,为加强药品监督管理,指导合理用药,建立药品不良反应报告体系,经药事管理委员会研究制定本制度。
一、组织领导
医院成立药品不良反应监测工作委员会,办公设在药学部临床药学室,药学部负责全院药品不良反应报告和监测管理。各科室成立药品不良反应报告和监测管理小组,由科主任、护士长及一名护士组成,具体负责药品不良反应报告。药品不良反应监测工作委员会的任务是组织、指导医院药品不良反应监测工作,对疑难、复杂的不良反应病例进行讨论复审,并向遂宁市药品不良反应监测中心报告。
二、药品不良反应监测管理及报告程序
1、药品不良反应是指合格药品在正常用法、用量下出现的与用药目的无关的或者意外的有害反应,包括输液反应、药物过敏、胃肠道反应等,不包括无意或有意超剂量用药引起的反应以及用药不当引起的反应。
2、积极开展药品不良反应报告和监测的宣传、教育和培训工作,使广大医务人员充分认识到药品不良反应是关系到广大患者的用药安全的重要问题,及时收集并反馈药品不良反应,对进一步提高用药安全,指导临床合理用药,保护患者利益具有极为重要的作用。
3、药品不良反应报告和监测是药品不良反应的发现、报告、评价和控制的过程。无论是单一用药还是多药联用,均应遵循“可疑就报”的原则,对难以确定因果关系的,只要不能完全排除的药品不良反应,均应作为药品不良反应或药品不良事件上报。
4、药品不良反应报告内容和统计资料是加强药品监督管理、实施合理用药的依据,不作为处理医疗事故、诉讼和药品质量事故的依据。
5、新的、严重的药品不良反应必须在15日内报告,死亡病例须及时报告。加强药品不良反应监测和再评价工作,重点对化学药品注射剂、中药注射剂、多组分生化注射剂和疫苗等药品不良反应进行重点监测和再评价,出现群发药品不良反应,应立即向县、市ADR监测中心或食品药品监督管理局报告。
6、临床药师在参与临床治疗过程中,应注意病人用药情况,及时发现药品不良反应并收集药品不良反应表报药学部。
7、各病区指定一名住院医师和护士长兼任药品不良反应联络员,负责收集本病区的药品不良反应报告表,并定期汇总到药学部。
8、我院药学部临床药学室为不良反应监测站,负责每月初向临床发放、收集药品不良反应报告表并整理,每季末提交院药品不良反应领导小组讨论,完成药品不良反应报告单位评价意见的填写,并上报药品不良反应监测中心。
9、医疗质量管理科负责检查落实情况,对漏报或隐匿不报的科室,扣除相应科室医疗质量分2分。
-
药品不良反应监测报告制度含流程图
药品不良反应监测报告制度和流程加强药品的安全监管严格药品不良反应监测工作的管理确保人体用药安全有效依据中华人民共和国药品管理法及药…
-
药品不良反应监测报告制度doc
黄冈市中心医院药剂科药品不良反应监测报告制度1根据国家食品药品监督管理局药品不良反应报告和监测管理办法制定本制度2药品不良反应监测…
-
药品不良反应监测与报告制度
安徽医科大学第二附属医院药品不良反应与药害事件监测报告管理制度责任人临床药学室负责人负责本单位药品不良反应与药害事件监测报告管理工…
-
药品不良反应监测报告制度含流程图
药品不良反应监测报告制度加强药品的安全监管严格药品不良反应监测工作的管理确保人体用药安全有效依据中华人民共和国药品管理法及药品不良…
-
药品不良反应报告与监测管理制度
药品不良反应报告与监测管理制度一本医疗机构指定专兼职人员负责本单位使用药品的不良反应报告和监测工作二药品不良反应报告的范围药品引起…
-
《药品不良反应报告和监测管理办法》(卫生部令第81号)
药品不良反应报告和监测管理办法卫生部令第81号20xx年05月04日发布中华人民共和国卫生部令第81号药品不良反应报告和监测管理办…
-
20xx年国家药品不良反应监测年度报告
20xx年国家药品不良反应监测年度报告20xx年05月31日发布药品不良反应是指合格药品在正常用法用量下出现的与用药目的无关的有害…
-
药品不良反应监测报告制度含流程图
药品不良反应监测报告制度加强药品的安全监管严格药品不良反应监测工作的管理确保人体用药安全有效依据中华人民共和国药品管理法及药品不良…
-
《药品不良反应报告和监测管理办法》(中华人民共和国卫生部令81号)
药品不良反应报告和监测管理办法中华人民共和国卫生部令81号第81号药品不良反应报告和监测管理办法已于20xx年12月13日经卫生部…
-
20xx年国家药品不良反应监测年度报告
20xx年国家药品不良反应监测年度报告药品不良反应是指合格药品在正常用法用量下出现的与用药目的无关的有害反应自19xx年我国试行药…
-
20xx年上半年医疗器械与药品不良反应的工作总结
XXX医院20xx年上半年药品与医疗器械不良反应报告分析20xx年上半年,全院共上报药品不良反应43例,医疗器械监测报表零报告。一…