元素推断题常考知识点总结
1号元素 氢:原子半径最小,同位素没有中子,密度最小的气体。
6号元素 碳:形成化合物最多的元素,单质有三种常见的同素异形体(金刚石、石墨、富勒烯)。
7号元素 氮:空气中含量最多的气体(78%),单质有惰性,化合时价态很多,化肥中的重要元素。
8号元素氧:地壳中含量最多的元素,空气中含量第二多的气体(21%)。生物体中含量最多的元素,与生命活动关系密切的元素,有两种气态的同素异形体。
9号元素 氟:除H外原子半径最小,无正价,不存在含氧酸,氧化性最强的单质。
11号元素 钠:短周期元素中原子半径最大,焰色反应为黄色。
12号元素 镁:烟火、照明弹中的成分,植物叶绿素中的元素。
13号元素铝:地壳中含量第三多的元素、含量最多的金属,两性的单质(既能与酸又能与碱反应),常温下遇强酸会钝化。
14号元素 硅:地壳中含量第二多的元素,半导体工业的支柱。
15号元素磷:有两种常见的同素异形体(白磷、红磷),制造火柴的原料(红磷)、化肥中的重要元素。
16号元素 硫:单质为淡黄色固体,能在火山口发现,制造黑火药的原料。
17号元素 氯:单质为黄绿色气体,海水中含量最多的元素,氯碱工业的产物之一。
19号元素 钾:焰色反应呈紫色(透过蓝色钴玻璃观察),化肥中的重要元素。
20号元素 钙:人体内含量最多的矿质元素,骨骼和牙齿中的主要矿质元素。
2.与元素的原子结构相关知识归纳
⑴最外层电子数等于次外层电子数的元素是Be、Ar;
最外层电子数是次外层电子数2倍的元素有C;
最外层电子数是次外层电子数3倍的元素有O;
最外层电子数是次外层电子数4倍的元素有Ne。
⑵次外层电子数是最外层电子数2倍的元素有Li、Si;
次外层电子数是最外层电子数4倍的元素有Mg。
⑶内层电子数是最外层电子数2倍的元素有Li、P;
电子总数是最外层电子数2倍的元素有Be。原子核内无中子的元素是11H。
3.元素在周期表中的位置相关知识归纳
⑴主族序数与周期序数相同的元素有H、Be、Al;
主族序数是周期序数2倍的元素有C、S;
主族序数是周期序数3倍的元素有O。
⑵周期序数是主族序数2倍的元素有Li、Ca;
周期序数是主族序数3倍的元素有Na。
⑶最高正价与最低负价的绝对值相等的元素有C、Si;
最高正价是最低负价的绝对值3倍的元素有S。
⑷上一周期元素所形成的阴离子和下一周期元素最高价态阳离子的电子层结构与上一周期零族元素原子的电子层结构相同。
4.元素的含量
地壳中质量分数最大的元素是O,其次是Si;
地壳中质量分数最大的金属元素是Al,其次是Fe;
氢化物中氢元素质量分数最大的是C;所形成的有机化合物中种类最多的是C。
5.元素所形成的单质及化合物的物理特性
① 颜色:常温下,单质为有色气体的元素是F、Cl;
单质为淡黄色固体的元素是S;
焰色反应火焰呈黄色的元素是Na,呈紫色的元素是K(通过兰色钴玻璃)。
② 状态:常温下,单质呈液态的非金属元素是Br;单质为白色蜡状固体的元素是P。
③ 气味:有臭鸡蛋气味的非金属元素是S。
④ 熔点:单质熔点最低的金属元素是Hg;熔点最高的金属元素是W。单质熔点最高的非金属元素是C(金刚石)。氢化物熔点最高的非金属元素是O。氧化物熔点最高的非金属元素是Si。
⑤ 硬度:单质为天然物质中硬度最大的元素是C。
⑥ 密度:单质最轻的金属元素是Li;单质最轻的非金属元素是H。
⑦ 溶解性:气态氢化物最易溶于水的元素是N。
⑧ 导电性:单质能导电的非金属元素是C;单质属于半导体材料的是Si。
6.元素所形成的单质及化合物的化学特性
① 无正价、无含氧酸的元素是F;
单质氧化性最强、其氢化物水溶液可雕刻玻璃的元素是F;
气态氢化物稳定性最强的元素是F;
最高价氧化物对应的水化物酸性最强的元素是Cl。
② 其两种同素异形体对人类生存都非常重要的元素是O(O3层被称为人类和生物的保护伞);气态氢化物与最低价氧化物能反应生成单质的是S。
③ 气态氢化物与最高价氧化物对应水化物能起化合反应的元素是N;
气态氢化物能使湿润的红色石蕊试纸变蓝的元素是N;
其中一种同素异形体在空气中能自燃的元素是P。
7.元素性质递变规律
①元素金属性强弱比较规律
1.依据元素周期表,同一周期中,从左到右,金属性逐渐减弱;
同一主族中,由上到下,金属性逐渐增强。
2.依据最高价氧化物的水化物碱性强弱,碱性越强,金属性越强。
3.依据金属活动性顺序(极少数例外)。
4.依据金属单质与酸或水反应的剧烈程度,反应越剧烈,金属性越强。
5.依据金属单质与盐溶液之间的置换反应。
6.依据原电池原理,原电池中作负极的金属比作正极的金属金属性强。
7.依据电解原理,电解时,阴极上后析出的金属比先析出的金属金属性强
②元素非金属性强弱比较规律
【1】.元素在周期表中的相对位置
①同周期元素,自左向右,元素的非金属性依次增强,
②同主族元素自上而下,非金属性依次减弱,
【2】.非金属单质与氢气化合的越容易,非金属性越强
【3】.气态氢化物的越稳定,非金属性越强
【4】.最高价氧化物对应的水化物的酸性越强,非金属性越强.
【5】.非金属性强的元素的单质能置换出非金属性弱的元素的单质。
【6】.非金属单质对应阴离子的还原性越强,该非金属元素的非金属性越弱。
常见阴离子的还原性由强到弱的顺序是S2->I->Br->Cl->F-,
【7】.与变价金属反应时,金属所呈价态越高,非金属性越强
如Cu+Cl2 →CuCl2;2Cu+S→ Cu2S,说明非金属性Cl>S。
【8】.几种非金属同处于一种物质中,可用其化合价判断非金属性的强弱
如HClO、HClO3中,氯元素显正价、氧元素显负价,说明氧的非金属性强于氯。
注意:
①常见非金属元素的非金属性由强到弱的顺序:
F、O、Cl、N、Br、I、S、P、C、Si 、H: (要求熟记)
②元素的非金属性与非金属单质活泼性是并不完全一致的:
如元素的非金属性:O>Cl,N>Br; 研究对象是原子
而单质的活泼性:O2 < Cl2,N2<Br2。 研究对象是分子(要考虑化学键)
8.微粒半径的比较

(1)电子层数相同的原子(即同周期):Z越大,r越小 Na > Mg >Al
(2)最外层电子数相同的原子(即同主族):电子层数越多,r越大 K > Na >Li
(3)核外电子排布相同的离子:Z越大,r越小 Na+>Mg2+ F->Na+ O2->F-
其中同一周期的原子所形成的离子的变化规律为:先减小,再减小
但是后面的最小要比前面的最大还要大
(4)核电荷数相同的粒子:电子数越多,r越大 Na >Na+ Cl->Cl
9.“10电子”、“18电子”的微粒现总结如下:
(一)“10电子”的微粒:

(二)“18电子”的微粒
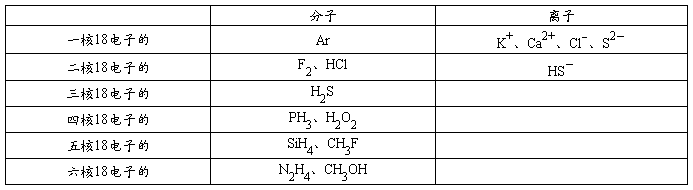
分子(9+9型):F2、H2O2、N2H4、C2H6、CH3OH、CH3NH2、CH3F、NH2OH
10.双元素形成的个数比列模型
①多种比例的情况:最常见的是两种原子以1:1和1:2(或2:1)的组成形成化合物的情况,此时首先应考虑H2O2和H2O或Na2O2和Na2O,此外还应注意CO和CO2、NO和NO2,再延伸到过渡金属可想到FeS和FeS2、CuO和Cu2O,甚至有机物中的C2H2和C2H4。
②XY2型化合物的可能情况:IIA族与VIIA族化合物:BeF2、BeCl2、MgF2、MgCl2、CaF2、CaC2、CaCl2等。氧化物与硫化物:CO2、NO2、SO2、SiO2、CS2等
③ XY3型化合物的可能情况:氢化物和卤化物:BF3、BCl3、AlF3、AlCl3、PCl3、 NH3、PH3 氧化物:SO3 氮化物:LiN3、NaN3
④其它情况:由于篇幅有限,X2Y、X3Y型化合物的情况就留给读者自己归纳了。此外,一定要注意题目的要求是“XY2”还是“X与Y以1:2组成”,如是后者,除了考虑到2:4的组成外,往往要还要考虑有机物(如1:2组成的烯烃)。
11.化学键与作用力
1.离子键
判断依据:熔融状态下能导电的化合物,带有离子键。
电子是转移的
活泼的金属与活泼的非金属之间(AlCl3和BeCl2不是)
有些非金属离子(NH4+)有离子键
2.共价键
电子是偏移的
非金属元素与非金属元素之间
往往有多对共用电子对(为了满足8电子稳定结构)
3.分子间作用力(范德华力)
分子间存在着将分子聚集在一起的作用力
分子间作用力要比化学键弱很多
是影响物质熔沸点和溶解性的重要因素之一
4.氢键
氢键不是化学键,是特殊的分子间作用力
含有O、F、N的物质有可能存在氢键,这三种元素一般在末端,以-OH,-NH2居多
氢键有分子内氢键(形成五元环,六元环),分子间氢键(H2O)
氢键的存在使物质的熔沸点升高(需要额外的能量破坏氢键)
氢键与温度有关,温度越高,氢键越少
12、晶体与熔沸点比较
1.分子晶体
分子之间依靠分子间作用力按一定规则排列形成的晶体
常见的分子晶体:气体单质、有些非金属单质、少部分金属元素与非金属元素组成的化合物(例如氯化铝、氯化铍),有机物,酸等。
2.离子晶体
离子化合物中阴阳离子按一定规则排列形成的晶体
常见离子化合物:大多数盐、强碱、金属氧化物
3.原子晶体
相邻的原子间以共价键结合形成空间立体网状结构的晶体
常见原子化合物:金刚石、晶体硅、石英(SiO2)、氮化硅(Si3N4)、金刚砂(SiC)、AlN
耐高温,高压,硬度大,熔沸点高
特别地:只有部分分子晶体的化学式是它的分子式
离子晶体中可以有共价键,共价化合物不能有离子键
非金属元素也能形成离子化合物,NH4NO3
晶体中可以只有阳离子而没有阴离子:金属晶体
熔沸点比较
①一般的: 原子晶体>金属晶体>离子晶体>分子晶体
②同种晶体之间
A.分子晶体:相对分子质量越大,熔沸点越高,对于有机物同分异构体而言,支链越多,熔沸点越低。特别地,要考虑氢键 HF >HBr>HCl
B.离子晶体:阳离子所带电荷越多,熔沸点越高。阴阳离子半径越小(即键长越短),熔沸点越高。 MgCl2 > NaCl
C.原子晶体:原子半径越小,熔沸点越高。C-C > Si-C >Si-Si
③一般地,熔点低于沸点:对于熔点高于沸点的物质,容易升华。
第二篇:元素推断题知识点
一 特殊颜色
1、常见淡黄色物质:AgBr Na2o2 Fes2
黄色物质 AgI、Ag3PO4
2 、常见黑色物质:C CuO Mno2 Feo Fe3o4 金属活动性顺序中铁以后的硫化物
3、其它颜色固体:红色Cu、 Fe(OH)3红褐色。
Fe(OH)2:白色沉淀,迅速地转变成灰绿色,最后变成红褐色沉淀。
白色 [Fe(0H)2、AI(OH)3 CaCO3、BaSO4、AgCl、BaSO3]
蓝色 [Cu(OH)2]
4、有色溶液:Fe(浅绿色)、Fe(黄色)、Cu(蓝色)、MnO4(紫色) Fe遇SCN呈血红色
5、有色气体:Cl2(黄绿色)、NO2(红棕色)NO(无色气体,遇空气变红棕色)
6、使品红溶液褪色的气体:SO2(加热后又恢复红色)、O3 ,Cl2(加热后不恢复红色) 使酚酞溶液变红的气体:NH3(加热煮沸后变为无色)
7、Cl2通入含Br-溶液中,会出现橙色;加入有机溶剂,在有机溶剂层出现橙红色。Cl2通入含I-的溶液中,会出现深黄色,加入有机溶剂,在有机溶剂层出现紫红色。I2遇淀粉溶液变蓝。
8、在含有S-的酸性溶液中,加入能与它反应的氧化剂(Cl2、O2、SO3、NO3、Fe等) 会出现黄色沉淀。
9、H2在Cl2中燃烧呈苍白色火焰。
10、钠元素的焰色反应为黄色,钾元素的焰色反应为浅紫色(透过兰色钴玻璃)。
二 特殊状态(气味,溶解性)
1、 常见气体单质:H2 N2 O2 F2 Cl2
2、常见液体单质:Br2(唯一的液态非金属单质) Hg(唯一的液态金属单质)
3、常见液态化合物:H2O H2O2 H2SO4
4、臭鸡蛋气味的气体; H2S
22--3+2+3+2+-3+-
三 特殊结构
1、满足10电子组成的物质有:Ne、Na、Mg、Al、NH4、H3O、O、F、OH、
+
2+
3+
+
+
2-
-
-
NH2-、CH4、NH3、H2O、HF。 2满足18电子的微粒有:SiH4 PH3 H2S HCl Ar H2O2 F2 S2- CI- K+ Ca2+
N2H4
2- 3、满足14电子的微粒有: N2 CO Si C2
++4+--2
4、核外电子总数及质子总数均相同的微粒 ① Na,H3O,NH, ② F,OH,NH-, ③CI-,HS- ④ N2,CO,C2H2
5 既能形成2:1又能形成1:1型化合物有: H2O H2O2 :Na2O Na2O2 6、具有正四面体结构的物质有:CH4 CCI4 P4 金刚石
7、具有三角锥形结构的分子有:NH3 平面三角形分子 BF3 BCI3
四 特殊反应形式
1 Na2S2O3与酸反应既产生沉淀又产生气体: S2O3+2H=S↓+SO2↑+H2O 2 既能酸反应,又能与碱反应
(1)单质:Al
(2)化合物:Al2O3、Al(OH)3、弱酸弱碱盐、弱酸的酸式盐、氨基酸。 3 生成多种产物
(1) 1→3:2KMnO4 == K2MnO4 + MnO2 + O2↑(加热) Cu2(OH)2CO3 == 2CuO + H2O + CO2↑(加热) NH4HCO3 == NH3↑ + H2O + CO2↑(加热) (2) 2→3: X2、S与碱液的反应: Cl2 + 2NaOH == NaCl + NaClO + H2O 3S + 6KOH(热) == 2K2S + K2SO3 + 3H2O
电解NaCl(KBr、Na2S等)、CuSO4、AgNO3水溶液:
例 2NaCl + 2H2O ==== 2NaOH + H2↑+ Cl2↑(条件:电解) 2FeCl3+H2S=2FeCl2+S↓+2HCl
(3)2→4:Na2S2O3 + H2SO4 == Na2SO4 + S↓ + SO2↑ + H2O 2KMnO4 + 16HCl == 2MnCl2 + 2KCl + 5Cl2↑ + 8H2O
(4)3→3:2Na2S + Na2SO3 + 3H2SO4 == 3Na2SO4 + 3S↓ +3H2O KIO3 + 5KI + 3H2SO4 == I2 + 3K2SO4 + 3H2O
KClO3 + 5KCl + 3H2SO4 == 3K2SO4 + Cl2↑ + 3H2O
(5)3→4:2NaCl + MnO2 + 2H2SO4 == Na2SO4 + MnSO4 + Cl2↑ + 2H2O Na2S + Na2SO3 + H2SO4 == Na2SO4 + S↓ + SO2↑+H2O(H2S) 4.14置换反应
(一)、按元素的性质归类,金属与非金属单质之间的置换。 1、金属单质置换金属单质
2Al+Fe2O3 Al2O3+2Fe Fe+CuSO4 FeSO4+Cu (Al还可与V2O5、CrO3、WO3、MnO2等发生置换)
2-+
2、金属单质置换非金属单质
2Na+2H2O = 2NaOH+H2↑ 2Mg+CO2 = MgO+C
3Fe+4H2O(g) = Fe3O4+4H2↑
3、非金属单质置换金属单质
H2+CuO = Cu+H2O C+FeO = Fe+CO
4、非金属单质置换非金属单质
2F2+2H2O = 4HF+O2 2C+SiO2 = Si+2CO
C+H2O = CO+H2 2H2+SiCl4 = Si+4HCl
(二)、按元素在周期表的位置归类,同族元素单质间的置换与不同族元素单质间的置换。
1、同主族元素单质间的置换
Na+KCl =NaCl+K 2Na+2H2O =2NaOH+H2 ↑
2H2S+O2 = 2S+2H2O 2C+SiO2 = Si+2CO
Cl2+2HI = 2HCl+I2
2、不同主族元素单质间的置换
Mg+2HCl = MgCl2+H2 2Mg+CO2 = 2MgO+C
2F2+2H2O =4HF+O2 3Cl2+8NH3 = 6NH4Cl+N2
H2S+Cl2 = S+2HCl 4NH3+3O2 = 2N2+6H2O
3、主族元素单质置换副族元素的单质
H2+CuO =Cu+H2O Na+TiCl4 = 4NaCl+Ti
4、副族元素的单质置换主族元素单质
2+3Fe+4H2O(g) = Fe3O4+4H2 Zn+2H+ Zn+H2
5、副族元素的单质置换副族元素的单质
Fe+CuSO4 =FeSO4+Cu
5 特殊反应条件
⑴
⑵ 2H2O2=2H2O+O2
⑶ 放电
⑷8Al+3Fe3O4 =4Al2O3+9Fe 3Fe+4H2O =Fe3O4+4H2
CO+H2O(气) = CO2+H2
6 重要的工业反应
⑴制玻璃 Na2CO3+SiO2=Na2SiO3+CO2 (高温)
CaCO3+SiO2=CaSiO3+CO2(高温)
⑵氯碱工业 2NaCl+2H2O = 2NaOH+H2↑+Cl2↑
⑶煅烧石灰石 CaCO3=CaO+CO2(高温)
⑷候氏制碱法NH3+H2O+NaCI+CO2=NaHCO3+NH4CI
⑸硫酸工业 4FeS2+11O2=2Fe2O3+8SO2 (煅烧)
H2O+SO3=H2SO4
⑹工业制硅 SiO2+2C=Si+2CO (高温)Si+2CI2
==SiCI4 SiCI4+2H2=Si+4HCI
⑺工业制铝 2AL2O3=4AL+3O2(电解)
⑻水煤气 C+H2O=CO+H2(高温)
⑼制硝酸 2NO+O2=2NO2 3NO2+H2O==2HNO3+NO
⑽合成氨
⑾高炉炼铁 Fe2O3+3CO=2Fe+3CO2(高温)
7 唯一性物质
①乙烯产量是一个国家石油工业发展水平的标志 ②硫酸产量是一个国家化学工业发展水平的标志 ③汞是唯一的液态金属和溴是唯一的液态非金属 ④铁是用量最大的金属材料 ⑤CH4含氢量最大的化合物 ⑥元素形成化合物种类最多的:C、H ⑦地壳中含量最大的金属是AL和非金属元素是O。⑧同一元素的气态氢化物和最高氧化物对应的水化物化合,生成盐的元素一定是氮。⑨非金属性最强,无正化合价的元素F。金属性最强的是Cs.
8 特殊数据
两物质元素组成相同但分子量相差16的物质,考虑O的原子量是16,可有这些物质(Na2O, Na2O2); (CO CO2); ( NO, NO2); (N2O ,N2O2);( SO2 ,SO3); (O2, O3); (H20,H2O2); (HClO, HClO2); (Na2SO3,Na2SO4); (NaHSO3 ,NaHSO4); (NaNO2, NaNO3); (HCHO, HCOOH);(HCOOH H2CO3);(HCI,HCIO)等。 式量相等的物质(N2,CO,C2H4);(H2S,PH3),(Na2S,Na2O2)(S,O2)
作这类习题,学生主要存在以下问题:一是对元素及其化合物的知识掌握不全面,不熟悉;二是学生的分析判断能力与逻辑推理能力欠缺;三是学生的化学用语掌握不够准确,书写不规范;四是学生对这种试题练习不够,有一种恐惧心理;因此,要想帮助学生解好框图题,首先帮助学生归纳整理重要元素及其化合物知识,如氮,硫,氯,碳,硅,钠,铁等。要让他们熟练掌握一些特殊的性质与变化,对常见题眼进行记忆。其次
是做专题训练,在专题训练的时候,让学生掌握常见的解题思路与方法,在练中不断提高。
-
氧族元素知识点归纳(精华)
臭氧和氧气是氧的同素异形体大气中臭氧层是人类的保护伞MnO22H2O22H2OO2过氧化氢不稳定分解可作氧化剂漂白剂归纳知识体系3…
-
高考化学氧族元素知识点详解归纳
17氧族元素1复习重点1氧族元素的物理性质和化学性质的递变规律2硫单质臭氧过氧化氢硫化氢的物理性质与化学性质3重点是硫的化学性质及…
-
高中化学氧族元素知识点
氧族元素难点聚焦1氧族元素的原子结构及性质的递变规律2臭氧和过氧化氢臭氧和氧气是氧的同素异形体大气中臭氧层是人类的保护伞过氧化氢不…
-
氧族元素的详细知识点
氧族元素的详细知识点1O2和O3的结构比较性质比较O3含量测定如何进行2H2O2结构制备性质3工业上如何除氯H2O2Na2SO34…
-
第六章 氧族元素 环境保护知识点及答案
第六章氧族元素环境保护知识点一氧族元素1氧族元素的名称和符号分别为2物理性质从上到下熔沸点逐渐密度逐渐是半导体能导电3结构与化学性…
-
离子共存与离子反应方程式的书写判断规律总结
离子共存与离子反应方程式的书写判断(09)12.下列离子方程式正确的是A.向盐酸中滴加氨水:H++OH-=H2OB.Fe(OH)3…
-
离子共存判断规律总结
1、因发生复分解反应而不能大量共存:(1)H?与OH(2)OH——、弱酸的酸式酸根离子不能大量共存;、NH?4与H?金属活动性顺序…
-
高中化学-高一化学-元素推断题目总结
元素周期表练习题目1.X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别…
-
初中化学常见的几种题型总结 (除杂、分离、鉴别、鉴定、推断)
初中化学常见的几种题型总结除杂分离鉴别鉴定推断知识要点1除杂题解答除杂质一类的题目时要注意三原则三要领五种常用的方法三原则不引入新…
-
初中化学常见的几种题型总结 (除杂、分离、鉴别、鉴定、推断)
初中化学常见的几种题型总结除杂分离鉴别鉴定推断知识要点1除杂题解答除杂质一类的题目时要注意三原则三要领五种常用的方法三原则不引入新…