高一化学必修一离子推断
离子推断
1.在FeCl3、CuCl2混合溶液中,加入一定量的铁屑,反应完全后将固体滤出,下列说法中正确的是
A.若滤出的固体中只有铜,则溶液中一定含有的阴离子是Fe2+,一定不含Cu2+
B.若滤出的固体中含有铁和铜,则溶液中一定含有的阳离子是Fe2+,一定不含Cu2+和Fe3+
C.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe2+,可能含有Cu2+和Fe3+
D.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe3+和Fe2+,一定不含Cu2+
2.对某酸性溶液(可能含有Br-,SO42-,H2SO3,NH4+)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;
③加入氯水时,溶液略显黄色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸
对于下列物质不能确认其在溶液中是否存在的是
A Br- B SO42- C H2SO3 D NH4+
3.某澄清溶液,可能含有Ca2+、Na+、Cl-、CO32-、I-中的一种或几种,现做如下实验:①通入足量氯气,溶液变为棕黄色,滴加淀粉溶液后溶液显蓝色
②加入BaCl2有白色沉淀生成,再加入足量盐酸后,沉淀完全溶解,并有气体生成。
下列关于该澄清溶液的说法中错误的是
A、一定含有I- B、一定含有CO32-
C、可能含有Cl- D、一定含有Ca2+
4.某钠盐溶液中可能含有NO2-、SO42-、SO32-、CO32-、Cl-、I-等阴离子。某同学取5份此溶液样品,分别进行了如下实验:
①用pH计测得溶液pH大于7
②加入盐酸,产生有色刺激性气体
③加入硝酸酸化的AgNO3溶液产生白色沉淀,且放出有色刺激性气体
④加足量BaCl2溶液,产生白色沉淀,在滤液中加入酸化的(NH4)2Fe(SO4)2溶液,再滴加KSCN溶液,显红色
该同学最终确定在上述六种离子中仅含NO2-、CO32-、Cl-三种阴离子。
请分析,该同学只需要完成上述哪几个实验,即可得出此结论。
A. ①②④⑤ B. ③④ C. ③④⑤ D. ②③⑤
5.今有一混合物的水溶液,含有以下离子中的若干种:Na+、NH+4、Cl—、Ba2+、HCO3—、SO42—,现取三份100mL该溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液,加热,收集到标准状况下的气体448mL
(3)第三份加足量Ba(OH)2溶液,得沉淀4.30g,再用足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,下列推测正确的是
A.Na+一定存在 B.100mL该溶液中含0.1mol HCO—3
C.Ba2+一定存在 D.Cl—一定不存在
6.A、B、C、D四种物质均为下列离子组成的可溶性化合物,组成这四种物质的离子(离子不能重复组合)有:

分别取四种物质进行实验,实验结果如下
①B溶液分别与C、D混合,均有白色沉淀生成
②将A溶液逐滴滴入C溶液中,有沉淀生成,继续滴加A溶液时,沉淀减少直至完全消失
③A与D两种固体混合有气体生成,该气体能使湿润的红色石蕊试液变蓝
④用石墨电极电解B溶液,在阳极上产生一种有刺激性气味的气体
回答下列问题
(1)A所含的阴离子的电子式是 B所含的阳离子是
(2)C的化学式是 D的化学式是
(3)以Pt为电极电解1L0.1mol/LB的水溶液,当电路中通过0.1mol电子时,溶液的pH为 (设电解过程溶液体积不变),阳极的电极反应式为
(4)写出②中沉淀溶解的离子方程式
7.某钠盐溶液可能含有阴离子NO3-,CO32-,SO42-,Cl-,Br3-,I-,为鉴定这些离子-,分别取少量溶液进行以下实验:
①测得混合液呈碱性;
②加HCl后,生成无色无味气体。该气体能使饱和石灰水溶液变浑浊;
③加CCl4,滴加少量氯水,振荡后,CCl4层未变色;
④加BaBl2溶液产生白色沉淀,分离,在沉淀中加人足量盐酸,沉淀不能完全溶解;
⑤加HN03酸化后,再加过量AgNO3,溶液中析出白色沉淀。
(1)分析上述5个实验,写出每一实验鉴定离子的结论与理由。
实验①______________________________________________________________;
实验②______________________________________________________________;
实验③______________________________________________________________;
实验④______________________________________________________________;
实验⑤______________________________________________________________;
(2)上述5个实验不能确定是否存在的离子___________________________________。
《离子推断》参考答案
1.B
2.B
3.D
4.B
5.AB
6.(1)[:O:H:]—;Ba2+
(2)Al2(SO4)3;(NH4)2CO3
(3)13;2Cl—-2e—=Cl2↑
(4)Al(OH)3+OH—=AlO2—+H2O
7.(1)①CO32-和SO32-可能存在,因它们水解呈碱性
②CO32-肯定存在,因产生的气体CO2;不SO32-存在,因为没有刺激性气味的气体产生
③Br-,I-不存在,因没有溴和碘的颜色出现
④SO42-存在,因BaSO4不溶于盐酸
⑤Cl-存在,因与Ag+形成白色沉淀
(2)NO3-
第二篇:高一化学必修一:离子共存、离子的检验和推断考点汇总
第3讲 离子共存、离子的检验和推断
[考纲要求] 1.应用离子反应发生的条件,正确判断常见离子在溶液中能否大量共存。2.利用离子的特征反应,能鉴别常见离子以及进行综合推断。
考点一 离子共存
1. 离子共存问题是离子反应条件和本质的最直接应用
所谓几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
2. 熟记常考离子的性质
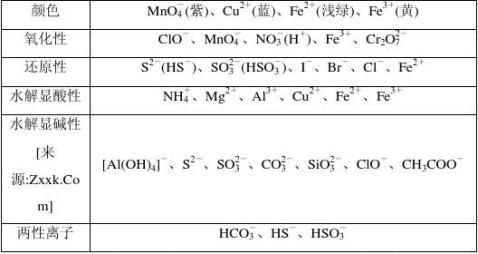
离子。
3. 常见溶液酸、碱性的判断
酸性溶液:pH<7(常温);能使pH试纸呈红色的溶液;能使甲基橙呈红色或橙色的溶液;能使石蕊试液呈红色的溶液。
碱性溶液:pH>7(常温);能使pH试纸呈蓝色的溶液;能使石蕊试液呈蓝色的溶液;能使酚酞试液呈红色的溶液。
呈酸性或碱性的溶液:和Al反应放出(HNO3除外);能使甲基橙呈黄色的溶液;c(H)水或c(OH)水等于10a mol·L1(a>7)的溶液。 +---
深度思考
(1)OH不能和________________________________________________________大量共存(填具体离子,下同)。
答案 H、NH4、Fe2、Fe3、Cu2、Zn2、Mg2、Al3、Cr3、HCO3、HS、HSO3 +++++++++----
(2)H不能和______________________________________________________大量共存。 +
222答案 OH、CO23(HCO3)、S(HS)、SO3(HSO3)、SiO3、[Al(OH)4]、ClO、F、-----------
CH3COO、NO2
(3)CO23不能和________________________________________________大量共存。 ---
答案 H、Mg2、Ba2、Ca2、Fe3、Al3、Fe2、Cu2 ++++++++
(4)SO23不能和__________________________________________大量共存。 -
答案 H、MnO4、NO3(H)、Mg2、Ba2、Fe3、Al3、Fe2、Cu2 +--+++++++
(5)Fe3不能和______________________________________________大量共存。] +
22答案 OH、I、SO23、ClO、CO3(HCO3)、S(HS)、[Al(OH)4]、SCN ----------
(6)Al3不能和______________________________________________大量共存。 +
22答案 OH、SO23、ClO、CO3(HCO3)、S(HS)、[Al(OH)4] --------
(7)I不能和____________________________________________大量共存。 答案 Fe3、NO3(H)、MnO4、ClO、Cr2O27 +-+----
(8)NO3(H)不能和______________________________________大量共存。
2222答案 CO23(HCO3)、SiO3、ClO、CH3COO、S(HS)、Fe、SO3(HSO3)、I -------+----+
反思归纳
判断一些常见离子能否和其他离子大量共存时,一般从以下几个方面考虑:
(1)CO23考虑生成气体和沉淀; -
(2)SO23考虑生成气体、沉淀和其还原性; -
(3)Fe3考虑生成Fe(OH)3、双水解及其氧化性; +
(4)Al3考虑生成Al(OH)3、双水解; +
(5)I只考虑其还原性;
(6)NO3(H)考虑酸性及NO3在酸性条件下的强氧化性。
题组一 无限制条件的离子大量共存的判断
1. 在水溶液中能大量共存的一组离子是
A.HCO3、H、NO3、Na
B.Na、Cu2、OH、SO24 ++---+-+-+-- ( )
C.Mg2、H、[Al(OH)4]、SO24 ++--
D.NH4、K、Br、NO3
答案 D
解析 A项,H与HCO3反应;B项,Cu2与OH反应;C项,H与[Al(OH)4]反应。 +-+-+-++--
2. 在水溶液中能大量共存的一组是
A.Ba2、Na、SO24、Cl ++-- ( )
B.MnO4、SO23、H、K --++
C.[Al(OH)4]、Mg2、K、HCO3
-
+
+
-
D.K、Na、NO3、SO24
+
+
-
-
答案 D
2解析 A项,Ba2与SO24反应;B项,MnO4、H、SO3发生氧化还原反应;C项,
+
-
-
+
-
[Al(OH)4]存在于强碱溶液中,Mg2、HCO3不能存在。
-
+
-
题组二 题干中有限制条件的离子大量共存的判断
3. 将足量的SO2通入下列各溶液中,所含离子还能大量共存的是
A.K、SiO23、Cl、NO3
+
-
-
-
( )
B.H、NH4、Al3、SO24
+
+
+
-
C.Na、Cl、MnO4、SO24
+
-
-
-
D.Na、CO23、CH3COO、HCO3
+
-
-
-
答案 B
2解析 A中SiO23能与SO2反应;C中MnO4能与SO2发生氧化还原反应;D中CO3、
-
-
-
CH3COO、HCO3均能与SO2反应。
4. 在酸性溶液中,下列各组离子能大量共存且溶液为无色透明的是
A.Na、K、OH、Cl B.Na、Cu2、SO24、NO3
+
+
-
-
+
+
-
-
--
( )
C.Mg2、Na、SO24、Cl
+
+
-
-
D.K、Na、NO3、CO23
+
+
-
-
答案 C
解析 A项,H与OH反应;B项,Cu2有颜色;D项,H与CO23反应。
+
-
+
+
-
题组三 选项中有限制条件的离子大量共存的判断
5. 下列各组离子在指定的溶液中,能大量共存的打“√”,不能大量共存的打“×”
(1)含有大量Fe3的溶液:Na、SCN、Cl、I
+
+
-
-
-
+
+
-
-
( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( )
(2)含有大量NO3的溶液:H、Fe2、Cl、SO24
-
-
(3)常温下,pH=12的溶液:K、Cl、SO24
+
-
-
-
(4)c(H)=0.1 mol·L
+-1
2
的溶液:Na、NH4、SO24、S2O3
+
+
+
-
+
-
(5)使pH试纸显蓝色的溶液:Cu2、NO3、Fe3、SO2 4
-
+
+
-
(6)与铝粉反应放出H2的无色溶液:NO3、Al3、Na、SO24
2
(7)使红色石蕊试纸变蓝的溶液:SO24、CO3、Na、K
-
-
+
+
+
c?H?-12+--+ (8)常温下的溶液:K、[Al(OH)4]、CO2-1×103、Nac?OH?(9)中性溶液:Fe3、Al3、NO3、SO24
+
+
-
-
+
+
-
-
2(10)使甲基橙变红色的溶液:Mg2、K、SO24、SO3
(11)c(H)水=10+-12 mol·L-12的溶液:Na、K、CO23、SO4 ++--
+++-
( ) ( ) ( ) (12)使酚酞变红色的溶液:Na、Cu2、Fe2、NO3 (13)0.1 mol·L-1 + 的Na2CO3溶液:Al3、SO24、Cl、K+--
答案 (1)× (2)× (3)√ (4)× (5)× (6)×
(7)√ (8)√ (9)× (10)× (11)× (12)× (13)× 反思归纳
警惕题干中的常见“陷阱”
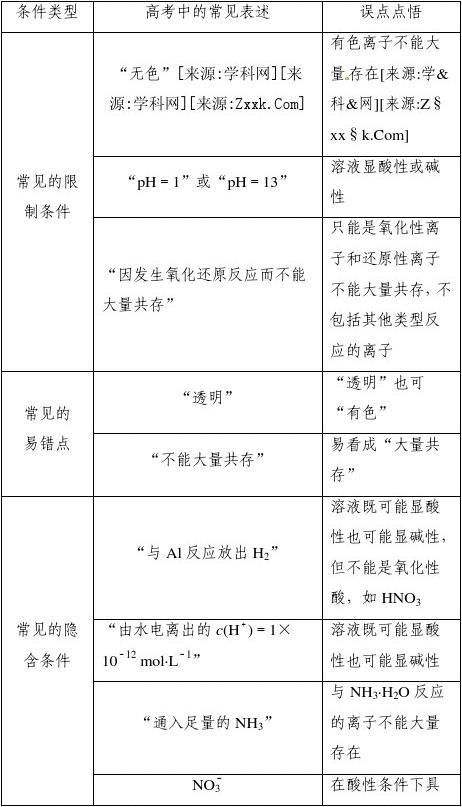

考点二 离子的检验和推断
1. 常见离子的检验方法
根据离子性质不同而在实验中所表现出的现象不同,可把检验离子的方法归纳为三种类型:①生成沉淀;②生成气体;③显现特殊颜色。
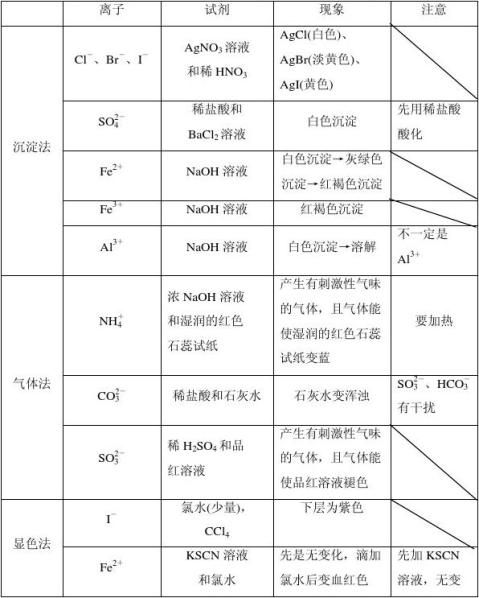
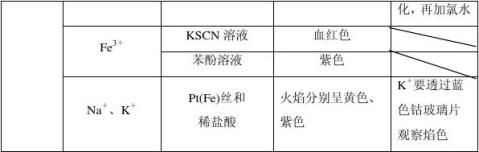
2常见的溶液中有颜色的离子有MnO4——呈紫色, Cu2——呈蓝色,Fe2——呈浅绿色,Fe3——呈黄色。
+
+
+
-
沉淀的颜色:Cu(OH)2——蓝色沉淀,Fe(OH)3——红褐色沉淀。 解题时特别注意题干条件是“无色透明”还是“澄清透明”。 深度思考
1. 向某溶液中加入BaCl2溶液,有白色沉淀生成,再加入稀盐酸,沉淀不消失,能否判断
溶液中存在SO2 4?
-
答案 不能,若溶液中存在Ag,也有相同的现象发生。
2. 向某溶液中加入Ca(OH)2溶液,有白色沉淀生成,能否判断溶液中一定存在CO23?
-
+
答案 不能,若溶液中存在SO23、HCO3,也有相同的现象。
-
-
3. 向某溶液中滴入稀盐酸,产生能使澄清石灰水变浑浊的气体,能否判断溶液中一定存在
CO23?
-
答案 不能,若溶液中存在HCO3、SO23、HSO3,也有相同的现象。
-
-
-
4. 向某溶液中滴入BaCl2溶液,产生白色沉淀,再加入稀HNO3,白色沉淀不溶解,能否
确定溶液中一定存在SO24?
-
答案 不能,若溶液中存在SO23或Ag,也有相同现象。
-
+
5. 向某溶液中加入稀NaOH溶液,把湿润无色酚酞试纸放在试管口,试纸不变红,则溶
液中一定不存在NH4,该判断是否正确?为什么?
答案 判断错误,检验NH4时,应加入浓NaOH溶液,并加热,且用湿润的红色石蕊试纸。
6. 向某溶液中滴加氯水,再加入KSCN溶液,溶液变血红色,则溶液中一定存在Fe2,
+
+
+
该判断是否正确?为什么?
答案 判断错误,检验Fe2时,应先加KSCN,再加氯水,否则,Fe3干扰结果的判断。
+
+
7. 做某溶液的焰色反应实验,火焰呈黄色,则溶液中一定存在钠元素,不存在钾元素,该
判断是否正确?为什么?
答案 判断错误,钾的焰色反应必须透过蓝色钴玻璃片才能观察到。
题组一 排除干扰,确定离子
1. 关于某无色溶液中所含离子的鉴别,下列判断正确的是
-
( )
A.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不溶解时,可确定有Cl存在 B.通入Cl2后,溶液变为深黄色,加入淀粉溶液后溶液变蓝,可确定有I存在 C.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸后沉淀不溶解时,可确定有SO24存
-
-
在
D.加入稀盐酸,生成的气体能使澄清石灰水变浑浊,可确定有CO23存在
-
答案 B
解析 Cl、SO24均能与Ag形成不溶于稀盐酸的白色沉淀,A错;I2遇淀粉变蓝,通
-
-
+
入Cl2后,溶液变为深黄色,加入淀粉溶液后溶液变蓝,则溶液中有I存在,B对;SO23
-
+
-
-
与Ba(NO3)2反应形成BaSO3沉淀,加入稀盐酸后在H、NO3的作用下可转化为BaSO4
2沉淀,C错;能使澄清石灰水变浑浊的CO23、HCO3、SO3或HSO3,D错。
-
-
-
-
2. 向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是
( )
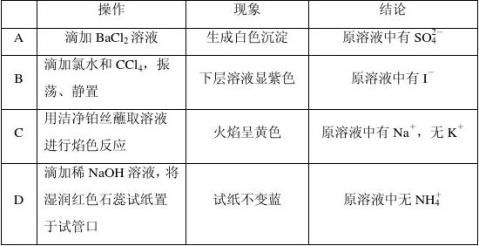
解析 本题主要考查常见离子的鉴别,意在考查学生的实验能力。A项加入BaCl2溶液
2得到白色沉淀,原溶液中可能含有SO23或SO4或Ag;B项溶于CCl4呈紫色的为I2,
-
-
+
即原溶液中含有I;C项观察K的焰色反应应透过蓝色钴玻璃,排除Na的干扰;D项检验NH4应加入浓NaOH溶液,且需要加热。
+
-++
反思归纳
无色溶液中离子检验的一般思路
气体是CO2或SO2,原溶液中可能存在的离子是
-
高中化学必修1化学方程式总结
1、钠及其化合物的转化关系2②NaCl2①Na2O+2HCl=2NaCl+H2O②2Na+2HCl=2NaCl+H2↑++++Na…
- 高一化学必修1化学方程式及离子方程式汇总(背诵版)
-
高中化学必修一方程式大全
化学方程式一化学方程式总结1硫酸根离子的检验BaCl2Na2SO4BaSO42NaCl2碳酸根离子的检验CaCl2Na2CO3Ca…
-
高中化学必修1化学方程式总结
高中化学必修1化学方程式总结一钠及其化合物的转化关系1钠在空气中燃烧2NaO2点燃Na2O22钠在氧气中燃烧4NaO2点燃2Na2…
-
高一化学必修一化学方程式及离子方程式小结
必修一化学方程式及离子方程式小结1硫酸根离子的检验BaCl2Na2SO4BaSO42NaClSO4BaBaSO42碳酸根离子的检验…
-
离子共存与离子反应方程式的书写判断规律总结
离子共存与离子反应方程式的书写判断(09)12.下列离子方程式正确的是A.向盐酸中滴加氨水:H++OH-=H2OB.Fe(OH)3…
-
离子共存判断规律总结
1、因发生复分解反应而不能大量共存:(1)H?与OH(2)OH——、弱酸的酸式酸根离子不能大量共存;、NH?4与H?金属活动性顺序…
-
高中化学-高一化学-元素推断题目总结
元素周期表练习题目1.X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别…
-
初中化学常见的几种题型总结 (除杂、分离、鉴别、鉴定、推断)
初中化学常见的几种题型总结除杂分离鉴别鉴定推断知识要点1除杂题解答除杂质一类的题目时要注意三原则三要领五种常用的方法三原则不引入新…
-
初中化学常见的几种题型总结 (除杂、分离、鉴别、鉴定、推断)
初中化学常见的几种题型总结除杂分离鉴别鉴定推断知识要点1除杂题解答除杂质一类的题目时要注意三原则三要领五种常用的方法三原则不引入新…