盐类的水解 典型题
1.将0.2mol·LHCN溶液和0.1mol·L
( )
-
-+-1-1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是 -A [HCN]<[CN] B [Na]>[CN] C [HCN]-[CN]=[OH] D [HCN]+[CN]=0.1mol·L
2.浓度均为0.1 mol·L的甲酸和氢氧化钠溶液等体积相混合后,下列关系式正确的是
( )
A.(Na)>c(HCOO)>c(OH)>c(H) B.c(HCOO)>c(Na)>c(OH)>c(H)
C.c(HCOO)=c(Na)>c(H)=c(OH) D.c(Na)=c(HCOO)>c(OH)>c(H)
(本题考查了学生对弱酸强碱盐的水解规律的掌握)
3.下列事实①NaHCO3溶液呈碱性 ②NaHSO4溶液呈酸性 ③长期使用化肥(NH4)2SO4会使土壤酸性增大,发生板结 ④加热能增加纯碱的去污能力 ⑤配制CuCl2溶液,用稀盐酸溶解CuCl2固体 ⑥明矾能净水 ⑦氯化铵溶液可作焊药去除金属制品表面的-++-+--++--+-+-+-1---1锈斑 ⑧加热FeCl3·6H2O晶体,往往得不到FeCl3固体 ⑨NH4F溶液不能用玻璃瓶盛放。其中与盐类水解有关的是 ( )
A.全部 B.除②⑦以外 C.除②以外 D.除⑨以外
(本题考查学生正确掌握盐类水解的规律和应用)
4在纯碱溶液中滴入酚酞,溶液变红。若在该溶液中再滴入过量的氯化钡溶液,所观察到的现象是 ;其原因是(以离子方程式和简要文字说明): 。
(本题考查了学生对影响盐类水解的因素知识的理解,涉及到平衡移动以及指示剂的知识)
新活题网站
1.相同物质的量的下列溶液,碱性最强的是 ( )
A.Na2CO3 B.NaNO3 C.Na2SiO3 D.Na2SO3
(本题考查学生盐类的水解规律与溶液酸碱性)
2.将0.1mol下列物质置于1L水中充分搅拌后,溶液中阴离子数最多的是 ( )
A.KCl B.Mg(OH)2
C.Na2CO3 D. MgSO4
(本题考查的知识是盐类的水解和盐类的溶解规律)
3.相同温度、相同物质的量浓度的四种溶液:①CH3COONa ②NaHSO4 ③NaCl ④NaClO,按PH由大到小的顺序排列,正确的是 ( )
A.④①③② B.①④③②
C.①②③④ D.④③②①
(本题涉及盐类水解规律和溶液酸碱性与pH等知识,考查了运用能力)
4.CH3COOH和CH3COONa等物质的量混合配制成的稀溶液,PH=4.7,下列说法中错误的是 ( )
A. CH3COOH的电离作用大于CH3COONa的水解作用
B. CH3COONa的水解作用大于CH3COOH的电离作用
C. CH3COOH的存在抑制了CH3COONa的水解
D. CH3COONa的存在抑制了CH3COOH的电离
(本题考查了学生分析问题,用已学的盐类水解和电离的知识解决问题的能力)
5.等物质的量浓度的下列四种溶液中,NH4的浓度最大的是( )
A.NH4Cl B.NH4HCO3
C.NH4HSO4 D.NH4NO3
(本题考查溶液酸碱性对NH4水解的影响)
6.在相同温度下,等体积等物质的量的浓度的4种稀溶液:①Na2SO4、②H2SO4、③NaHSO4、④Na2S中所含带电微粒数由多到少的顺序是 ( )
A ①=④>③=② B ④=①>③>②
C ①>④>③>② D ④>①>③>②
(本题是考查学生有关电解质的电离和盐类水解的知识)
7.同时对农作物施用含N,P,K的三种化肥,对给定下列化肥:①K2CO3 ②KCl ③Ca(H2PO4)2 ④ (NH4)2SO4 ⑤氨水。其中最合理的组合方式是 ( )
A.①③④ B.②③④ C.①③⑤ D.②③⑤ ++
(本题考查含N,P,K的三种化肥在混合时是否反应或因水解而发生反应而降低肥效) 8.在常温下,纯水中存在电离平衡 H2

OA.NaHSO4 B.KAl(SO4)2 C.NaHCO3 D.NaAc
(本题考查盐类水解对水的电离的影响)
9.现有Al2(SO4)3,HAc,NaCl,BaCl2四种溶液,可以将它们区别开的一种试剂是 ( ) A.H2SO4 B.AgNO3 C.Na2CO3 D.NaHCO3 (本题考查学生物质的鉴别)
10.在氯化铵溶液中,下列关系式正确的是 ( )
-++-A.c(Cl)>c(NH4)>c(H)>c(OH) B.c(NH4)>c(Cl)>c(H)>c(OH)
C.c(Cl)=c(NH4)>c(H)=c(OH) D.c(NH4)=c(Cl)>c(H)>c(OH) (本题考查离子浓度大小比较)
11.将等体积的0.4mol/LCH3COONa和0.2mol/LHNO3溶液混和,则混和液中下列关系正确的是 ( ) A、c(Na]>c(CH3COO]>c(NO3]>c(H]>c(OH) B、c(Na]>c(CH3COO)>c(H]>c(NO3)>c( OH) C、将混和溶液加水稀释过程中,的比值变小 D、将混和溶液稀释10倍以后,
10
+
-+
+
-+
-+
--+
+
-+
-+
-
H+OH,如要使水的电离程度增大,并使c(H)增大,应加入的物质是( )
+-+
?
+-
?
-
[H?]
[CH3COO?]
溶液的PH值接近7,[NO3]=10mol/L
?
-11
12.下列有关说法正确是 ( )
①泡沫灭火器内的铁桶里盛碳酸氢钠溶液,不能把硫酸铝溶液盛在铁桶里的原因是Al水解产生的H会腐蚀铁桶
②把AlCl3溶液蒸干后再灼烧,最后得到的固体产物主要是Al2O3而不是AlCl3。这是由于加热促进Al的水解,又使生成的HCl以气体形式逸散,而使Al水解完全生成Al(OH)3,Al(OH)3受热分解生成Al2O3。
③水垢的主要成分是CaCO3和Mg(OH)2,基本上不含MgCO3,这是因为MgCO3微溶于水,长时间加热,水解生成了更难溶的Mg(OH)2。 ④Na2CO3溶液不应贮存在玻璃塞试剂瓶中,这是由于Na2CO3水解生成碱,使玻璃塞与其反应胶结。 ⑤FeCl3溶液放置久了会产生浑浊现象,这是由于FeCl3水解生成了Fe(OH)3的缘故 A.①②③④ B. ①②④⑤ C. ②③④⑤ D.全部 (本题考查学生盐类水解的应用)
13.盐的水解平衡会受到温度、浓度及外加酸碱等因素的影响,对于下列水解反应:Fe3++3H2O
3+
3+
3+
+
Fe(OH)3+3H+,填写改
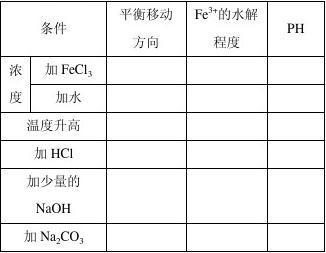
(本题考了影响水解的因素)
14.在电解质溶液中,不论存在多少离子,总有下列守恒关系:
(1)电荷守恒:电解质溶液中无论含多少种离子,但溶液总是呈电中性的。即整个溶液中________所带的负电荷总数一定等于_____所带正电荷总数。
如在Na2CO3溶液中有__________________ __
(2)原子守恒(物料守恒):电解质溶液中尽管有些离子水解、电离等原因发生改变,但某原子总数是保持不变的。 如Na2CO3中存在___________________ _.
(3)质子守恒:在多元弱酸的正盐中,由于存在酸根离子的多步水解,每步水解的过程中酸根离子每结合一个H,溶液中
+
必定余出一个OH。考虑水的电离有一个等量关系。 如Na2CO3中存在___________________ (本题考查学生盐溶液中的三个守恒和应变能力)
15.CuCl2溶液中含少量杂质FeCl2为制备晶体CuCl2·2H2O,拟定实验步骤如图所示
—

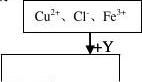

22请回答下列问题:
(1) 最适宜的氧化剂是 A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4 (2)物质Y是 (3)除去Fe的有关离子方程式是
(4)为了防止水解,要得到CuCl2·2H2O应控制得一定条件是 。 (本题综合考查盐的水解、氧化还原反应、离子方程式书写)
A. Na2FeO4在溶液中显强酸性,能消毒杀菌
B.在Na2FeO4中Fe为+6价,具有强氧化性,能消毒杀菌 C.Na2FeO4的还原产物Fe3+水解为 Fe(OH)3胶体,可使水中悬浮物凝聚沉降
D.Na2FeO4的还原产物Fe2+水解为Pe(OH)2胶体,可使水中悬浮物凝聚沉降
6.镁粉放入NH4Cl溶液中能放出H2、NH3,产生这种现象的原因是 ( ) A.是金属镁把NH3置换出来
B.是镁具有强还原性,NH4具有氧化性,发生氧化还原反应 C.是因为NH4水解显酸性,Mg与H反应放出H2,平衡右移 D.是因为Mg与水反应,生成的Mg(OH)2与NH4Cl反应 7.在0.1摩/升的乙酸钠溶液中,下列离子浓度关系不正确的是 ( ) A.c(Na+)=c(CH3COO-)+c(CH3COOH)
B.c(Na+)+c(OH-)=c(CH3COO-)+2c(CH3COOH)+ c(H+)
C.c(Na+)>c(CH3COO-) >c(OH-)>c(CH3COOH)> c(H+)
D.c(Na+)>c(OH-)=c(CH3COOH)>c(CH3COO-)> c(H+)
8.用物质的量都是0.1 mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中c(CH3COO)>c(Na),对该混合A.c(H)>c(OH)
B.c(CH3COOH)+c(CH3COO)=0.2 mol/L C.c(CH3COOH)>c(CH3COO) D.c(CH3COO)+c(OH)=0.2 mol/L
9.下列盐溶液因水解而显酸性的是( ) A.Na2S B.NaHCO3 C.Na2HPO4 D.NH4Cl 10.一元酸HA溶液中,加入一定量强碱MOH溶液后,恰好
----+
--+
+
+
+
3+
(B卷)
1.在Na2S溶液中存在着多种离子和分子,下列关系正确的是 ( ) A.(OH)=(HS)+(H)+(H2S) B.(OH)=(HS)+(H)+2(H2S) C.(OH)=(HS)+2(H]+(H2S) D.(Na)>(S)>(OH)>(HS)
2.物质的的浓度、体积都相同的NaF和NaCN溶液中,离子总数的关系正确的是(已知HF比HCN易电离) ( B) A.NaF=NaCN B. NaF>NaCN C. NaF<NaCN D.无法确定
+
2-----+
--+
--+
检测提高
1.能够说明氨水是弱碱的事实是 ( ) A.氨水具有挥发性
B.1mol·L-1氨水溶液的pH=10 C. 1mol·L-1NH4Cl溶液的pH=5 D.氨水与AlCl3溶液反应生成Al(OH)3
2.为了使(NH4)2SO4溶液中c(NH4)和c(SO4)之比更接近于2:1,可向溶液中滴加少量的 ( ) A. H2SO4 B.盐酸 C.NaOH溶液 D.NaCl溶液 3.已知物质的量浓度相同的三种盐溶液:NaX,NaY,NaZ,它们的PH依次为:8,9,10,,则可知对应酸的酸性强弱顺序为( )
A.HX > HY> HZ B.HX > HZ > HY C. HY> HZ > HX D. HZ > HY > HX
4.下列物质的溶液中所含离子种类最多的是 ( ) A.Na2S B.Na3PO4 C.Na2CO3 D.AlCl3 5.用铁酸钠(Na2FeO4)对未来河湖的淡水消毒是城市饮用水处理的一种新技术,下列对Na2FeO4用于饮用水消毒处理的分析正确的是 ( )
+
2-
溶液的下列判断正确的是 ( )
完全反应,反应后的溶液中,下列判断正确的是( ) A.c(A-)≥c(M+
) B.c(A-)≤c(M+
)
C.若MA不水解,则c(OH-)<c(H+
) D.若MA水解,则c(OH-)>c(H+
)
11.把100毫升、2摩/升的NaOH溶液,100毫升、2摩/升的H2SO4溶液以及一定量的氨水混合,所得的溶液使酚酞试液显浅红色,则溶液中离子浓度关系正确的是 ( ) A.[SO2-]=[Na+
]>[NH+
-+
4
4]>[OH]>[H] B.[Na+
]>[SO2-]>[NH+
-+
4
4]>[OH]>[H] C.[NH+]>[SO2-+
-+
4
4]=[Na]>[OH]>[H] D.[H+
]+[NH+]+[Na+
] = [OH-]+2[SO2-4
4]
12.有一种IA族金属的酸式盐AHB和H2B溶液,在相同条件下,AHB溶液中HB-的电离程度小于HB-的水解程度。下列说法正确的是 ( ) A.AHB的溶液呈弱酸性
B.室温下,同浓度的AOH和H2B溶液,电度度前者小于后者 C.该盐的电离方程式为AHBA++H++B2-
D.溶液各离子的摩尔浓度大小顺序为:
[A+
]>[HB-]>[OH-]>[H+]
13.某酸的酸式盐NaHY在水溶液中,HY-的电离度小于HY-的水解程度。有关叙述中正确的是( ) A.H2Y在电离时为:H2Y+H2O
HY-+H3O+
B.在该盐的溶液中,离子浓度为: c(Na+
)>c(Y2-)>c(HY-)>c(OH-)>c(H+
) C.在该盐的溶液中,离子浓度为: c(Na+
)>c(HY-)>c(Y2-)>c(OH-)>c(H) D.HY-水解方程式为:HY-+H
+
2-2O
Y+H3O+
14.已知PH=5的MgCl2溶液中含有杂质FeCl3,为除去杂质可加入的试剂是 ( ) A.MgO B.MgCO3 C.NaOH D.NaHCO
15.物质的量浓度相同的下列各组物质的溶液中,对指定的离子的浓度作大小比较,其中错 误的是 ( ) A.c(PO3-
4):Na3PO4>Na2HPO4>NaH2PO4>H3PO4 B.c(CO2-3):(NH4)2CO3>Na2CO3>NaHCO3>NH4HCO3 C.c(NH+4):(NH4)2SO4>(NH4)2CO3>NH4HSO4>NH4Cl D.c(S2-):Na2S>H2S>NaHS
16.相同条件下测得①NaHCO3 ②CH3COONa ③NaClO三种稀
溶液的pH值相同,则它们的摩尔浓度由大到小的关系是 ( ) A.①②③ B.③①② C.②①③ D.③②① 17.FeCl3与下列物质的反应,其中与水解无关的物质是 (1)紫色石蕊试液(2)碘化钾(3)煮沸的蒸馏水(4)氢硫酸(5)偏铝酸钠溶液(6)苯酚钠溶液(7)硫氰化钾(8)铜粉(9)小苏打溶液 ( ) A.(1)(2)(4)(6) B.(2)(4)(7)(8) C.(3)(5)(8)(9) D.(2)(4)(6)(8)
18.某二元酸H--
2A在水中发生电离: H2A = H+
+ HA,HA
H+
+ A2-, 下列叙述中不正确...的是: ( ) A. 在NaHA溶液中: [Na+
] > [HA-] > [OH-] > [H+
] B. 在Na+
2--+
2A溶液中: [Na] > [A] > [OH] > [H]
C. 在NaHA溶液中: [Na+] > [H+] = [HA-] + 2[A2-] > [OH-
] D. 在H+
-2--
2A溶液中: [H] = [HA] + 2[A] + [OH]
19.0.1mol/L Na2CO3溶液中,三种阴离子物质的量浓度由大到小的顺序为:____>____>____。 20.BiCl3水解生成BiOCl。
⑴写出水解方程式 。 ⑵医药上把BiOCl叫做次氯酸铋。你同意此名称吗? (填“是”或“否”)理由 。
⑶如何配制BiCl3溶液? 。 ⑷把适量固体BiCl3置于浓NaCl溶液中可得澄清液,请说出可能的原因 。
21.现有电解质溶液:①Na2CO3②NaHCO3③NaAlO2④CH3COONa ⑤NaOH 且已知:CO2+3H2O+2AlO-2-2=2Al(OH)3↓+CO3 ①当五种溶液的pH相同时,其物质的量浓度由大到小的顺序 (填编号,下同) ②将上述物质的量浓度均为0.1mol/L的五种溶液,稀释相同倍数时,其pH变化最大的是 ③在上述五种电解质溶液中,分别加入AlCl3溶液,无气体产生的是 ④将上述①②③这三种电解质溶液混合,发生反应的离子方程式为 22.在一元强碱MOH溶液中加入一元酸HA溶液,充分反应后,溶液呈中性。甲同学认为溶液中c(A-)=c(M+
),而乙同
学认为c(A-)与c(M+
)是否相等,要看一元酸HA是强酸还是弱酸。你认为_______同学的说法正确,理由是__________________________________。
23.在常温的条件下:为了表示弱电解质的相对强弱,把溶液种已电离的电解质分子数占原来总分子数的百分数称作电离度。设某pH值的硫酸溶液中水的电离度为α1,相同pH值的硫酸铝溶液中水的电离度为α2, 那么α1和α2的数值相比较,α1
α2。(填“>”“<”“=”)
某硫酸和硫酸铝两种溶液的pH值都是3,那么硫酸中水电离出的c(H+
)是硫酸铝中水电离的c(H+
)的
倍。
若设某pH值的硫酸中水电离出的c(H+)=1.0×
10-amol/l,设相同pH值的硫酸铝中水电离出的c(H+)=1.0×10-b
mol/l,(a、b都是小于14的正数),那么a、b之间 满足的关系式是
、
(用一个等式和一个不等式表示)。
24.浓度相同的下列各种溶液PH值由小到大的顺序是:
________ __。
①HNO3 ②H2SO4 ③H2CO3 ④KOH ⑤Ba(OH)2 ⑥Na2CO3 ⑦KNO3 ⑧AlCl3 ⑨CuCl2
25.在NaH2PO4溶液中存在的平衡有(用离子方程式表示):____________________ _。 设计一实验说明NaH2PO4的电离程度比水解程度大
_________________________ 。 26.二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:H+
-
-
+
2-
2A=H+HA, HA=H+A已知相同浓度时的电离度α(H2A)>α(HA-),设有下列四种溶液: A.0.01 mol·L-1
的H2A溶液 B.0.01 mol·L-1的NaHA溶液
C.0.02 mol·L-1
的HCl与0.04 mol·L-1
的NaHA溶液等体积混合液
D.0.02 mol·L-1
的NaOH与0.02 mol·L-1
的NaHA溶液等体积混合液
据此,填写下列空白(填代号): (1)c(H+
)最大的是 , 最小的是 。 (2)c(H2A)最大的是 , 最小的是 。
(3)c(A2-)最大的是 , 最小的是 。
(A卷)
典型题点击
1.B D 2.A 3.C
2.两溶液恰好完全反应后得到甲酸钠溶液,由于甲酸根
的水解,HCOO-的浓度比Na+
的浓度变小,溶液呈碱性,故应选A。 3. NaHSO4是强酸的酸式盐,可以不考虑水解。其余的盐都要考虑盐的水解
4.现象为:产生白色沉淀,且红色褪去。
原因:在纯碱溶液中,CO2?
3水解,
讲析:CO2?3?H2O?HCO?3?OH?,溶液呈碱性,加入酚酞后溶液呈红色;加入BaCl2后,Ba2??CO2?3?BaCO3? (白色),由于c(CO2?3)减小,水解平衡左移,c(OH-
)减小,酚酞褪色。
新活题网站
1.C 2. C 3. A 4.C 5.C 6.D 7.B 8.B 9.C 10.A 11.AD 12.D 13
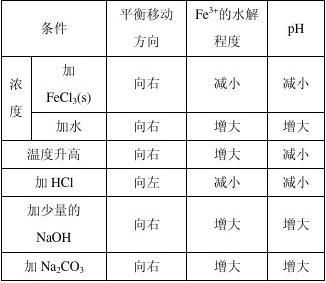

14.
(1)阴离子 阳离子 2c(Na+
)+c(H+
)=2c(CO2—
3)
(2)2c(Na+)=2c(CO2--
3)+2c(HCO3)+2H2CO3 (3)c(OH-)=c(H+
)+c(HCO-
3)+2c(H2CO3) 15.
(1)C (2)CuCO3或CuO或Cu(OH)2(3)
Fe3??3H2OFe(OH)3?3H?
CuCO3?2HCl?CuCl2?CO2??H2O
(4)加入浓盐酸或在HCl气氛中.
第16课时 (B卷) 纠错训练
1.BD 2.B
检测提高
1. BC 2.B 3. A 4.B 5.BC 6.C 7.D 8.B 9.D 10. BD 11. CD 12. D 13. A 14.AB 15. B 16.C 17.B 18.AC
19. c(CO2---
3) c(OH) c(HCO3)
20.(1)BiCl3?H2O?????
?BiOCl??2HCl (2)不同意,因BiOCl中Cl为-1价而不是+1价 (3)将BiCl3溶解于含适量HCl得蒸馏水中 (4)增大溶液中Cl-
浓度,抑制了BiCl3得水解 21. (1)④>②>①>③>⑤ (2) ⑤ (3) ③④⑤
(4)HCO??
3?AlO2?H2O?Al(OH)?3?CO23
22.甲同学正确,根据电荷守恒原理,c(M+)+c(H+)=c(A-
)+c(OH-),因溶液呈中性,即c(H+
)=c(OH-),所以(M+
)=(A-
)。23. < 10-8
a+b=14 b>7>a 24. ②①③⑨⑧⑦⑥④⑤ 25.
H???
2PO4?HPO2?2?
4;HPO3?
44?H
??
HPO2?
4?H22PO4?OH
H?2PO4?H2H3PO4?OH?;H2O
H??OH?
取NaH2PO4溶液,用
pH
试纸测溶液的pH,得
pH?7,说明H?2PO4的电离程度大于其水解程度。
26.(1)A D (2) C D (3)D A
-
盐类的水解知识点总结
1盐类的水解1复习重点1盐类的水解原理及其应用2溶液中微粒间的相互关系及守恒原理2难点聚焦一H2OH盐的水解实质nnn当盐AB能电…
-
盐类的水解知识点(学生版)
盐类的水解知识大复习一探究盐溶液的酸碱性结论强酸弱碱盐显酸性强碱弱酸盐显碱性强酸强碱盐显中性二盐溶液呈现不同酸碱性的原因三盐的水解…
-
盐类的水解知识点总结
1盐类的水解1复习重点1盐类的水解原理及其应用2溶液中微粒间的相互关系及守恒原理2难点聚焦一H2OH盐的水解实质nnn当盐AB能电…
-
盐类的水解知识点总结
盐类的水解知识点总结1复习重点1盐类的水解原理及其应用2溶液中微粒间的相互关系及守恒原理2难点聚焦一H2OH盐的水解实质nnn当盐…
-
盐类的水解知识点总结
1盐类的水解1复习重点1盐类的水解原理及其应用2溶液中微粒间的相互关系及守恒原理2难点聚焦一盐的水解实质H2OHOHnnn当盐AB…
-
化学选修4第四章第三节《盐类的水解》知识总结
化学选修四第四章第3节《盐类的水解》知识总结一、探究盐溶液的酸碱性强碱弱酸盐的水溶液,呈碱性;强酸弱碱盐的水溶液,呈酸性;强酸强碱…
-
盐类的水解知识点总结
1盐类的水解1复习重点1盐类的水解原理及其应用2溶液中微粒间的相互关系及守恒原理2难点聚焦一H2OH盐的水解实质nnn当盐AB能电…
-
盐类水解知识点总结
盐类水解基础知识点在溶液中盐的离子跟水所电离出来的H或OH生成弱电解质的过程叫做盐类的水解盐类的水解所条件盐必须溶于水盐必须能电离…
-
盐类的水解知识点总结
1盐类的水解1复习重点1盐类的水解原理及其应用2溶液中微粒间的相互关系及守恒原理2难点聚焦一H2OH盐的水解实质nnn当盐AB能电…
-
盐类的水解知识点总结
盐类的水解知识点总结1复习重点1盐类的水解原理及其应用2溶液中微粒间的相互关系及守恒原理2难点聚焦一H2OH盐的水解实质nnn当盐…