大学土壤微生物分离实验报告
从土壤中分离纯化培养微生物并作初步观察鉴定
【摘要】利用分离纯化微生物的基本操作技术对土壤中的微生物进行分离与纯化,根据细菌在选择培养基的存活情况,确定该菌种的固氮解磷解钾属性。
【关键词】细菌芽孢杆菌 培养基、选择培养基的配制 高压蒸汽灭菌
前言:
在自然条件下,微生物常常在各种生态系统中群居杂聚。群落是不同种类微物的混和体。为了生产和科研的需要,人们往往需要从自然界混杂的微生物群体中分离出具有特殊功能的纯种微生物;或重新分离被其他微生物污染或因自发突变而丧失原有优良性状的菌株;或通过诱变及遗传改造后选出优良性状的突变株及重组株。这种获得单一菌株纯培养的方法称为微生物的分离纯化技术。
分离纯化技术主要由采集样品、富集培养、纯种分离和性能测定等几个基本环节组成。
实验目的:
1、学习从土壤中分离、纯化微生物的原理与方法。
2、学习、掌握微生物的鉴定方法。
3、对提取的土样进行微生物选择培养、分离、纯化,根据菌落的存活状况来判断未知菌的属性。
实验原理:
菌种来源:选择无机磷农药含量较高的土壤,有机磷农药化工厂 旁边的土壤和排污口区的污水.
培养基的选取:五组选择培养基,分别以辛硫磷、甲胺磷、敌敌畏、草甘膦及五种有机磷农药混合为微生物生长的唯一氮源磷源。
分离纯化微生物:稀释倒平板法、涂布平板法、稀释摇管法、平板划线分离法。
此次实验采取的是平板分离法,该方法操作简便,普遍用于微生物的分离与纯化,其基本原理主要包括两个方面:(一)选择适合于待分离微生物的生长条件或加入某种抑制剂造成只利于待分离微生物生长,而抑制其它微生物生长的环境,从而淘汰大部分不需要的微生物。(二)微生物在固体培养基上生长形成的单个菌落可以是由一个细胞繁殖而成的集合体,因此可通过挑取单菌落而获得一种纯培养。获得单菌落的方法可通过稀释涂布平板法或平板划线法等技术来完成。
微生物的观察可以用显微镜观察其细胞形态,也可以用肉眼观察其菌落形态。前者是微生物的显微镜观察技术,后者是微生物的肉眼观察技术。
1. 实验器材、试剂与实验方法:
1.1器材:
试管、三角瓶、烧杯、量筒、玻璃棒、天平、牛角匙、pH试纸、棉花、牛皮纸、记号笔、线绳、纱布、培养皿、自动立式压力蒸汽灭菌器、烘箱、玻璃珠、移液枪、枪头、称量纸、药匙、试管架、接种环、酒精灯、超净工作台, 粉碎机,接种环,移液枪配枪头。
1.2试剂:
牛肉膏、蛋白胨、琼脂、可溶性淀粉、葡萄糖、1mol/L NaOH、1mol/LHCl、NaCl、95%乙醇、75%酒精,草甘膦,甲甘磷,敌敌畏,辛硫磷。
1.3土样、样品:
取自二十三冶草莓园的土壤,建设北路的大棚蔬菜菜地土壤,化工厂污水口。
1.4 实验方法
1.4.1配制培养基:
(一)配制牛肉膏蛋白胨琼脂培养基200ml(用2个100ml三角瓶和2支试管分装)
牛肉膏蛋白胨培养基是一种应用最广泛和最普遍的细菌基础培养基。
配方如下:牛肉膏 0.6g 蛋白胨 2g NaCl 1g 琼脂 3~4g 水 200ml pH 7.4-7.6
1、称药品 按实际用量计算后,按配方称取各种药品放入大烧杯中。牛肉膏和蛋白胨可分别放在小烧杯或表面皿中称量,用热水溶解后倒入大烧杯。蛋白胨极易吸潮,故称量时要迅速。
2、加热溶解 在烧杯中加入少于所需的水量,然后放在石棉网上,小火加热,并用玻璃棒搅拌,待药品完全溶解后再补充水分至所需量。若配制固体培养基,则将称好的琼脂放入已溶解的药品中,再加热融化,在此过程中,需不断搅拌,以防琼脂糊底或溢出,最后补充所失水分。
3、调pH 用pH试纸或酸碱度计检测培养基的pH值,若pH偏酸,可滴加1mol/L NaoH,边加边搅拌,并随时检测,直至达到所需pH范围。若偏碱,则用1mol/l HCL进行调节。pH调节通常放在加琼脂之前。注意pH值不要调过头,以免回调而影响培养基内各离子的浓度。
4、过滤 液体培养基可用滤纸过滤,固体培养基可用4层纱布趁热过滤,以利结果的观察。
5、分装 按实验要求,可将配制的培养基分装入试管或三角瓶内。分装时可用三角漏斗以免使培养基沾在管口或瓶口上而造成污染。分装量:固体培养基约试管高度的1/5;分装入三角瓶内的以不超过其容积的一半为宜,半固体培养基以试管高度的1/3为宜。
6、加棉塞 试管口和三角瓶口塞上用普通棉花(非脱脂棉)制作的棉塞。棉塞的形状、大小和松紧度要适合,四周紧贴管壁,不留缝隙,才能起到防止杂菌侵入和有利通气的作用。要使棉塞总长3/5塞入试管口或瓶口内,以防止棉花脱落。有些微生物需要更好的通气,则可用8层纱布制成通气塞。有时也可用试管帽或塑料塞代替棉塞。
7、包扎 加塞后,将三角瓶的棉花外包一层牛皮纸或双层报纸,以防止灭菌时冷凝水沾湿棉塞。若培养基分装于试管中,则应先把装同类培养基的试管扎成捆后,再于棉花塞外一层牛皮纸。然后用记号笔注明培养基名称、组别、日期。
8、灭菌 将上述培养基于121.3摄氏度湿热灭菌20min。如因特殊情况不能及时灭菌,则应放入冰箱内暂存。
9、摆斜面 灭菌后,如制斜面,则需趁热将试管口端搁在一根长木条上,并调整斜度,使斜面的长度不超过试管总长的1/2;待其凝固,
10、无菌检查 将灭菌的培养基放入37摄氏度温箱中培养24-48h,无菌生长即可使用。或储存于冰箱或清洁的橱内,备用。
(二)选择培养基
配方如下:可溶性淀粉4g,KNO3 0.2g,NaCl 0.1g,K2HPO4.3H2O 0.1g, FeSO4.7H2O 0.002g, 琼脂3~4g, 水200mL, pH7.4~7.6。
1、称量和溶解 先计算后称量,按用量先称取可溶性淀粉,放入小烧杯中,并用少量冷水将其调成糊状,再加至少于所需水量的沸水中,继续加热,边加热边搅拌,至其完全溶解.对微量成分FeSO4.7H2O可先配制成高浓度的储备液后再加入,方法是先在100 ml 水中加入1g的FeSO4.7H2O,配成0.01mg/ml的储备液,再在200 ml的培养基中加入以上储备液0.02 ml即可.待所有的药品完全溶解后,补充水分到所需的总体积.如果要配制固体培养基,其琼脂溶解过程同牛肉膏蛋白胨培养基配制.
2、pH 调节`分装 包扎 灭菌及无菌检查同上(一)
(三)配制马丁氏培养基200ml(用1个100ml三角瓶和2支试管分装)
马丁氏培养基是用于分离真菌的选择培养基。配方如下: K2HPO4 0.2g,MgSO4.7H2O 0.1g, 蛋白胨1g, 葡萄糖2g, 琼脂3~4g, 水200mL,自然pH
1、称量和溶解 先计算后称量,按用量称取各成分,并将其溶解在少于所需水量的水中。待各成分溶解后,补充水分至所需体积。再将孟加拉红配成1%的水溶液,在200 ml的培养基中加入以上孟加拉红溶液0.66ml,混匀后,再加入琼脂加入融化,方法同(一)
2、同(二)2
3、链霉素的加入 链霉素受热容易分解,所以临用时,将培养基融化待其温度降至45摄氏度左右时才能加入。可先将链霉素配成1%的溶液(配好的链霉素溶液保存于-20摄氏度),在100ml培养基中加入1%链霉素0.3ml,使每毫升培养基中含链霉素30ug。
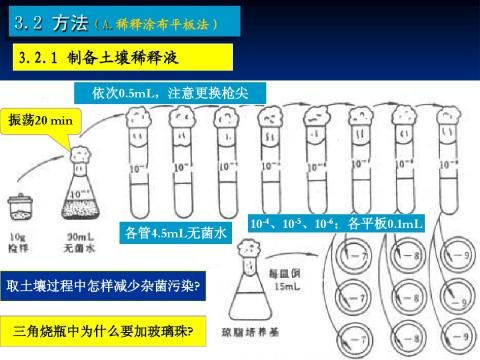
1.4.2 制备土壤稀释液:
1、取土壤
取表层以下5~10cm处的土壤样品,放入灭菌的袋中备用,或放在4oC冰箱暂存。
2、制备稀释液(要无菌操作)
(1)制备土壤悬液:取土样0.5g,迅速倒入带玻璃珠的无菌水瓶中(玻璃珠用量以充满瓶底为最好),振荡5~10min,使土样充分打散,即成10-2的土壤悬液。
(2)稀释:用无菌移液管吸10-2的土壤悬液0.5mL,放入4.5m 无菌水中,即为10-3稀释液,如此重复,可依次制成10-3~10-7的稀释液。注意:操作时管尖不能接触液面,每一个稀释度换一支移液管,每次吸土液,要将移液管插在液面,吹吸3次,每次吸上的液面要高于前一次,以减少稀释中的误差。
示意图如下:

0.5ml 0.5ml 0.5ml 0.5ml 0.5ml






10-2 10-3 10-4 10-5 10-6 10-7
稀释过程示意图
(图中左侧梯形为三角瓶,其中加入49.5ml无菌水与0.5g土样,土壤溶液稀释度为10-2
依此类推,右侧三试管中土壤稀释度分别为: 10-3、10-4、10-5、10-6、10-7 )
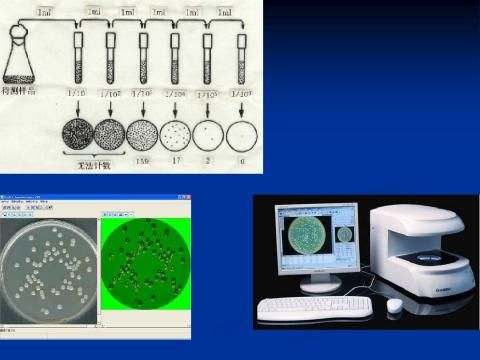
1.4.3 混菌测定菌落数的方法
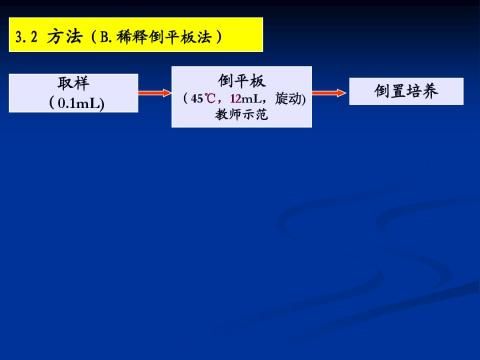
1)细菌 取10-6, 10-7 两管稀释液各1ml,分别接入相应标号的平皿中,每个稀释度接两个平皿。然后取冷却至50℃的牛肉膏琼脂培养基,分别倒入以上培养皿中(装量以铺满皿底的2/3为宜),迅速轻轻摇动平皿,使菌液与培养基充分混均,但不沾湿皿的边缘,待琼脂凝固即成细菌平板,倒平板时注意无菌操作。
2)放线菌 取10-3、10-4两管稀释液,在每管中加入10%酚液5~6滴,摇匀,静置片刻,然后分别从两管吸出1ml加入相应标号的平皿中,选用高氏1号培养基,用与细菌相同的方法倒入平皿中,便可制成放线菌平板。
3)霉菌 取10-2、10-3两管稀释液各1ml,分别接入相应的平皿中,每个稀释度接两个平皿。在熔好的马丁氏固体培养基中,每100ml加入灭菌的乳酸1ml,轻轻摇匀,然后用与细菌相同的方法倒入平皿中,便可制成霉菌平板。
4)酵母菌 在3)即可能分离到。
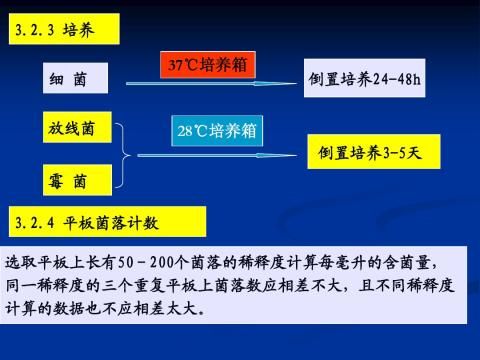
1.4.4培养
将接种好的细菌、放线菌、霉菌平板倒置,即皿盖朝下放置,于28~30oC恒温培养,细菌培养1~2d,放线菌培养5~7d,霉菌3~5d。可用于观察菌落,用于进一步纯化分离或直接转接斜面。
1.4.5平板划线分离微生物
1、倒平板 按无菌操作要求,在洁净工作台或在火焰旁操作,取融化并冷却至不烫手的固体培养基(约50oC),倒入无菌培养皿,倒量以铺满皿底为限,平放待其冷却凝固,备用。

2、划线分离 使用接种环,从待纯化的菌落或待分离的斜面菌种中沾取少量菌样,在相应培养基平板划线分离(如图),划线的方法多样,目的是获得单个菌落。
3、培养方法同“土壤稀释分离”。
4、菌落观察 从培养好的未知平板中,挑选8个不同的单菌落,逐个编号,根据菌落识别要点区分未知菌落类群,并将观察结果填入表4-1。
1.4.6斜面接种
 1、取新鲜固体斜面培养基,分别做好标记(写上菌名,日期、接种人等),然后用无菌操作方法,把待接菌种接入以上培养基斜面中。
1、取新鲜固体斜面培养基,分别做好标记(写上菌名,日期、接种人等),然后用无菌操作方法,把待接菌种接入以上培养基斜面中。
2、接种方法 用接种环沾取少量待接菌种,然后在新鲜斜面上“之”字形划(如图),方向是从下部开始,一直划至上部。注意划线要轻,不可把培养基划破。
3、接种后恒温培养[同1.4.4]。
2. 试验结果与讨论
从实验结果中可以推断出土壤中分离的微生物的种类,根据菌落数判断土壤中微生物的含量,实验过程中很多没注意的事项,可能影响实验结果的正确性。
2.1实验的结果
区分和识别各大类微生物通常不外乎包括菌落形态(群体形态)和细胞形态(个体形成)等两方面的观察。细胞的形态构造是群体形态的基础,群体形态则是无数细胞形态的集中反映,故每一大类微生物都有一定的菌落特征,即它们在形态大小、色泽透明度、致密度和边缘等特征上都有所差异,一般根据这些差异就能识别大部分菌落。
(一)菌落数观察记录表

(二)未知菌落的形态观察记录表

四大类微生物菌落的基本特征

附加说明:
1.三根试管中的菌形态特征比较明显,能够辨认区分,霉菌菌苔干燥,较松,所以表面粗糙;细菌菌苔湿润,表面光滑,整体扁平,呈较透明状态;放线菌菌苔较干燥,长得较致密。
2.倒平板时,时间的掌控至关重要,操作过慢将导致部分培养基先凝固,平板不平。
3.划线时组员应待培养基凝固后划线,否则部分平板会被划破;随着实验的进行,组员划线有所进步。
4.斜面接种:接种环较细,力度各方面较难把握。操作时,应尽量细心,小心的操作。
2.2 讨论
2.2.1 实验可靠性分析:
由于一些实验操作细节处理不当,实验的结果可能存在一些误差。但总体上实验的结果还是具有一定可靠性的。
2.2.2、注意事项:
1、称药品后应做好标志,勿与其它药品混在一起;称完药品应及时盖紧瓶盖。
2、注意pH值不要调过头,以免影响培养基内各离子的浓度。
3、使用高压灭菌锅应严格按照操作程序(加水、排冷空气、降零)进行,避免发生事故;灭菌时操作者切勿擅自离开。
4、应用记号笔在相应位置注明培养基的名称、组别、日期。
5、干热灭菌时消毒箱中物品不要摆得太拥挤,以免阻碍空气流通而影响灭菌效果;灭菌物品不要与消毒箱内壁的钢板接触,以防包装纸烤焦起火。
6、倒平板时时间要掌握好,避免培养基凝固,并且倒完后应当轻轻摇动平板两圈,使平板够平;待培养基凝固后划线,力度要适当,尽量不要将培养基划破。
7、接种时,应尽量挑取生长较好,比较纯的。
8、在接种时候应先用酒精灯将接种环前面的铂丝烧红,即对其进行灭菌;待温度降下来之后再接种。每次接种完后,要进行下一次接种之前,都要采取同样的方式。
9、应即时对试管和平板进行观察,并做相应的记录。
10、一般土壤中,细菌最多,放线菌和霉菌次之,而酵母菌主要见于果园和菜园土壤中,故从土壤分离细菌时应取较高的稀释度,否则菌落将连成一片而不能计数。
11、放线菌的生长时间比较长,故制作平板时,培养基的量应多加一点。
12、观察菌落特点时应选择分离的较开的很大的菌落,对培养基和试管要编好号码,不要随意移动开盖,以免搞混菌号或受到污染。
13、实验完成后,应对实验数据的收集、处理和筛选。认真比对分析并作好记录,通过老师的指导及查阅相关文献对数据进行正确的筛选和整理,最终得到实验结果。
2.2.3心得体会:
(1)通过实验我们学习了微生物实验中较基本的操作技能,掌握了配置培养基的一般方法和步骤、从土壤中分离微生物的方法,对无菌操作技术有了一定的了解,同时使组员的合作更加高效、密切。
(2)在做关于分离实验时,无菌操作特别重要。因操作不当很容易感染,使所做的平板或斜面失败,故操作前应先对所要使用的物品进行紫外线灭菌,(包括操作前要给自己的手用75%的酒精消毒);操作时应严格遵守操作规程,勿将实验操作在无菌工作台外进行,避免因人为因素而使实验产生误差。
(3)掌握足够的理论知识是我们能够较好的理解和完成实验的一个先决条件。因此,我们要学习好相关的理论知识,做好实验前的预习工作。
(4)根据不同的微生物生长对不同环境适应能力不同,实验中我们加入一些特定的物质(如链霉素等),抑制那些不适应该环境的的菌种的生长从而筛选出我们所需的菌种。
(5)微生物与我们生活息息相关,在食品行业中至关重要,作为食品专业的学生应认真学习这门学科,并掌握其实验操作。
参考文献:
何国庆 食品微生物学 《中国农业大学出版社》 20##年
李洪臣 杨秀艳 四大类群微生物菌落的比较 《生物学教学》 20##-11年
陈坚、刘和、李秀芬、华兆哲 《环境微生物实验技术》 20##年
林先贵 土壤微生物研究原理与方法 《高等教育出版社》 20##-3年
【abstract】
Through several methods and techniques, we get four types of soil bacteria separated. According to the observation of the morphology of the colony, we initially unknown bacteria categories.
【Key Words】
Actinomyces yeast Bacterial colonies microbial groups mold
Solid culture medium
第二篇:土壤微生物的分离






- 微生物实验报告模板
-
微生物学实验报告格式
微生物学实验报告专业学号姓名实验一培养基的配制和高压蒸汽灭菌一实验目的二实验原理三实验材料实际用到哪些试剂材料玻璃器皿等都要写出包…
-
微生物学实验报告
微生物学实验报告实验一普通光学显微镜的使用及细菌染色与形态观察第一部分显微镜的使用一目的要求1熟悉普通光学显微镜的构造油镜的使用原…
-
微生物学实验报告
20xx级制药专业工业微生物学实验报告姓名刘甜甜学号20xx304090班级制药122班指导老师王健日期20xx611一实验目的1…
- 微生物学实验报告[1]
-
食品微生物检验总结
1.食品微生物检验是应用微生物学的理论与方法,研究外界环境和食品中微生物的种类、数量、性质、活动规律、对人和动物健康的影响及其检验…
-
食品微生物学实验报告
常见微生物的分离培养与观察一,实验目的1,掌握显微镜的使用方法,操作原理。2,了解培养基的制备并掌握制备方法3,掌握杀菌锅杀菌方法…
-
微生物实验报告
金黄色葡萄球菌的分离提纯和鉴定实验一金黄色葡萄球菌的分离培养一实验目的1掌握BairdParker培养基的配制方法2掌握利用选择性…
-
微生物实验报告
实习报告XX学校2015年1月13日1、实习时间、地点和实习单位2、实习目的通过食品微生物检验实习,掌握培养基的配制、包扎及灭菌;…
-
微生物检验实习报告
实习报告实习名称系别年级专业学生姓名指导老师食品微生物检验实习11级食品科学与工程专业王磊1140905035王瑶琼吴菲菲黄大川邵…
-
大学生物化学实验报告标准格式汇总
生物化学实验报告班级姓名实验一血清蛋白质醋酸纤维薄膜电泳目的原理仪器组成操作与结果结果粘贴实验二酶的特异性目的原理操作与结果将以上…